笑傲江湖之小细胞肺癌适应症投研系列第三篇_安进(上)
药不能停,继续。
本篇撸一下小细胞肺癌领域新晋的实力玩家安进。安进这篇需要捋清的东西比较多,加之案例非常典型,安进的篇幅会相对前两篇大幅加长,所以拟分为上,中,下三篇。
上篇讲一些关于安进公司简介,小肺,靶点和TCE的基础概念,中篇详细梳理一下安进塔拉妥的临床开发历程和动态,下篇在竞争格局的角度洞察安进在包括小细胞肺癌在内的DLL3高表达实体瘤的策略。
本篇为上篇。
一.安进公司简介
安进2024年营收超过300亿美金,在全球药企里排名第十三位。业务包含四大板块,其中肿瘤是其第二大业务板块,肿瘤板块25年营收超过100亿美金。

下图可以看到肿瘤板块里的产品比较分散,没有特别大的单品。也可以看到安进没有PD1/PDL1产品,但是安进有业界领先的TCE(T细胞衔接器)平台,其中最著名的是BLINCYTO,贝林妥欧单抗,同时靶向CD3和CD19,2014年获FDA批准上市用于血液瘤,也是世界上第一款获批上市的TCE,25年卖了15亿美金。
而该公司在小细胞肺癌适应症的明星产品IMDELLTRA,塔拉妥,也是世界上第一款获批上市,用于治疗实体瘤的TCE,上市的第二年,也就是2025年,就卖了6.27亿美金,26年应该超过十亿美金,将成为安进公司又一款十亿美金分子,从塔拉妥的放量也表明了小细胞肺癌的未满足需求之强烈。

二.小细胞肺癌和肿瘤表面靶点回顾
小细胞肺癌是公认肺癌中最凶猛的一类,具有高度侵袭性,快速进展,快速全身转移,对免疫检查点抑制剂呈现冷肿瘤,极易产生耐药复发的特性。
其中两个关键抑癌基因TP53和RB1的失活,是小细胞肺癌细胞极高增值效率的底层生物学驱动力,但是目前还没有有效的药物能搞定这两个抑癌基因的失活问题。小细胞肺癌在肿瘤体积还比较小时,肿瘤细胞容易脱落进入血液循环,造成早期就发生远处转移。小肺肿瘤细胞也会形成细胞外基质(ECM),形成外围保护层,这也是导致药物耐药的原因之一。
并且小细胞肺癌不像非小细胞肺癌,有一大堆可以阻断生物学信号通路的驱动基因,如EGFR,ALK等,可以针对这些靶点开发TKI靶向药,事实证明这些靶向药物给非小细胞肺癌病人带来了长期生存获益。
所以,长期以来,小肺都是难啃的硬骨头,即使T药和度伐利尤单抗的出现,也只带来了中位OS两到三个月的提升,提升幅度很小。
后来科学家发现了小细胞肺癌肿瘤细胞上表达了一些靶点如B7H3,DLL3,SEZ6,TROP2靶点,也就是肿瘤表面的生物标记物。其中DLL3是最为干净的靶点,这个也从各个ADC的临床数据可以看到,以ZL1310为代表的DLL3 ADC的安全性最佳。
对于DLL3这个干净,非常适合小细胞肺癌的靶点,有多种MOA机制成药路径,比如ADC,TCE(双抗或者三抗),CAR-T。当然这些机制间可以联用。
安进针对该靶点研发了TCE,而再鼎选择开发DLL3 ADC。
三.实体瘤第一款TCE:塔拉妥
前面提到安进研发成功了世界上第一款TCE,贝林妥欧单抗,2014年获FDA批准上市,针对血液瘤。而第一款针对实体瘤的TCE,塔拉妥,2024年通过加速审批途经获FDA批准上市。
作为全世界TCE技术路线的头号玩家,花了漫长十年的探索,才克服了TCE在实体瘤成药的重重困难,最终率先在小细胞肺癌适应症上成药 。
TCE要在实体瘤成药,有一些关键挑战:靶向非肿瘤(On-target Off-tumor)毒性风险,实体瘤物理屏障T细胞浸润瓶颈,实体瘤复杂微环境抑制耗竭T细胞,半衰期不够导致药物在进入肿瘤组织前已被肾脏清除。
但安进通过持续的摸索,创新,最终通过塔拉妥像世界证明,TCE在实体瘤也可以成药。塔拉妥的成药是非常有标杆意义的,鼓舞了业界。证明TCE在实体瘤不是不能成药。所以有第一就会有第二。相信未来,在其他实体瘤,也会看到新的TCE药物成药。
四.塔拉妥作用机制介绍
我们知道,肿瘤免疫疗法多种多样,以PD1/PDL1为代表的免疫检查点抑制剂(ICI)只是肿瘤免疫疗法中的一种,PD1/PDL1这方面最有实力的是默沙东和BMS,代表产品为K药和O药,去年K药卖了超300亿美金,O药卖了超100亿美金。
而安进公司的TCE是肿瘤免疫疗法的另一个分支,安进是这个分支的开山鼻祖。
我先简单说一下PD1/PDL1和TCE(CD3/DLL3)杀伤肿瘤机制的区别,这部分知识对于理解安进塔拉妥的差异化还是有必要的。虽然两者都有人体T细胞参与,但是肿瘤杀伤机制差别比较大。
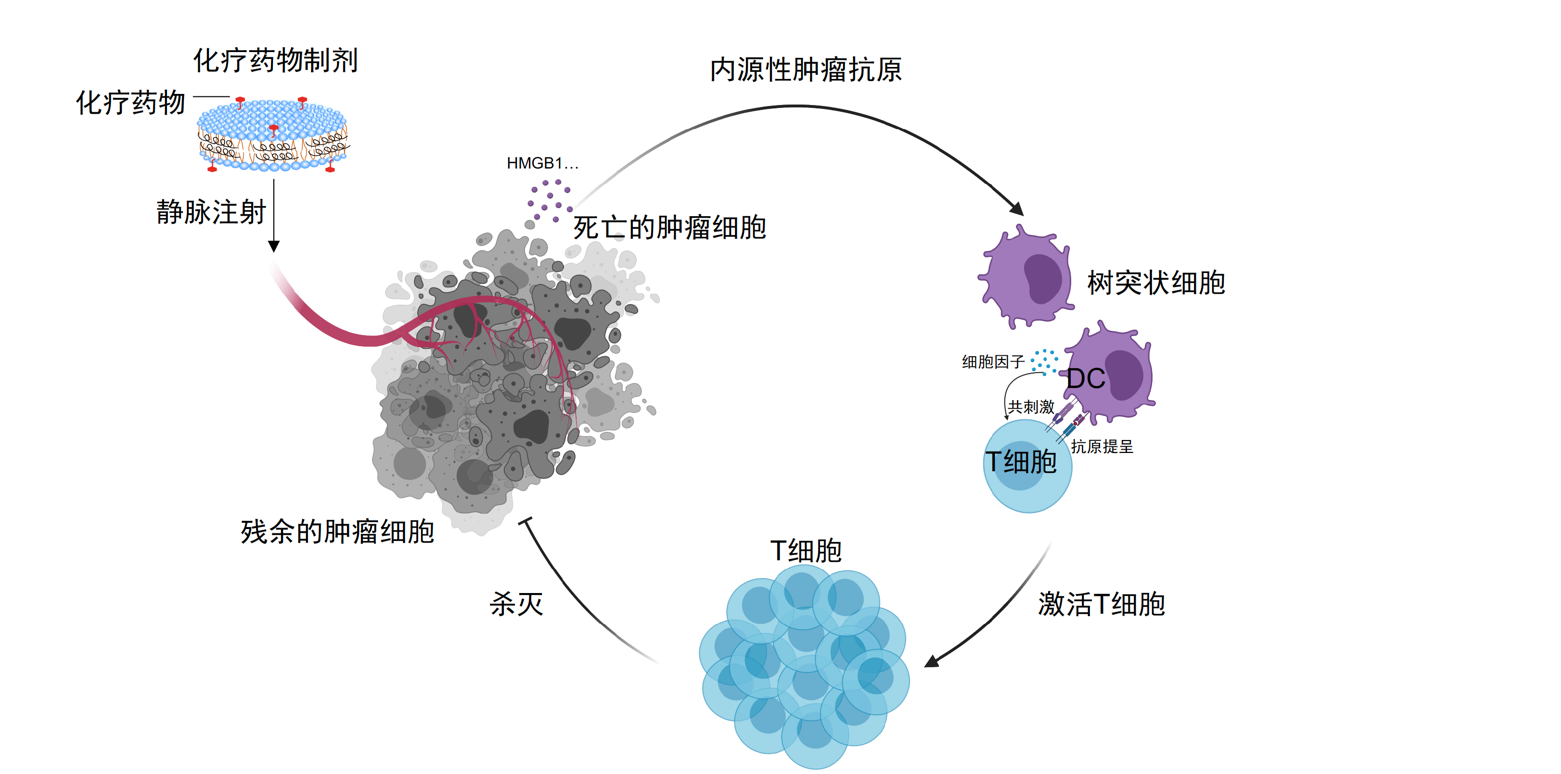
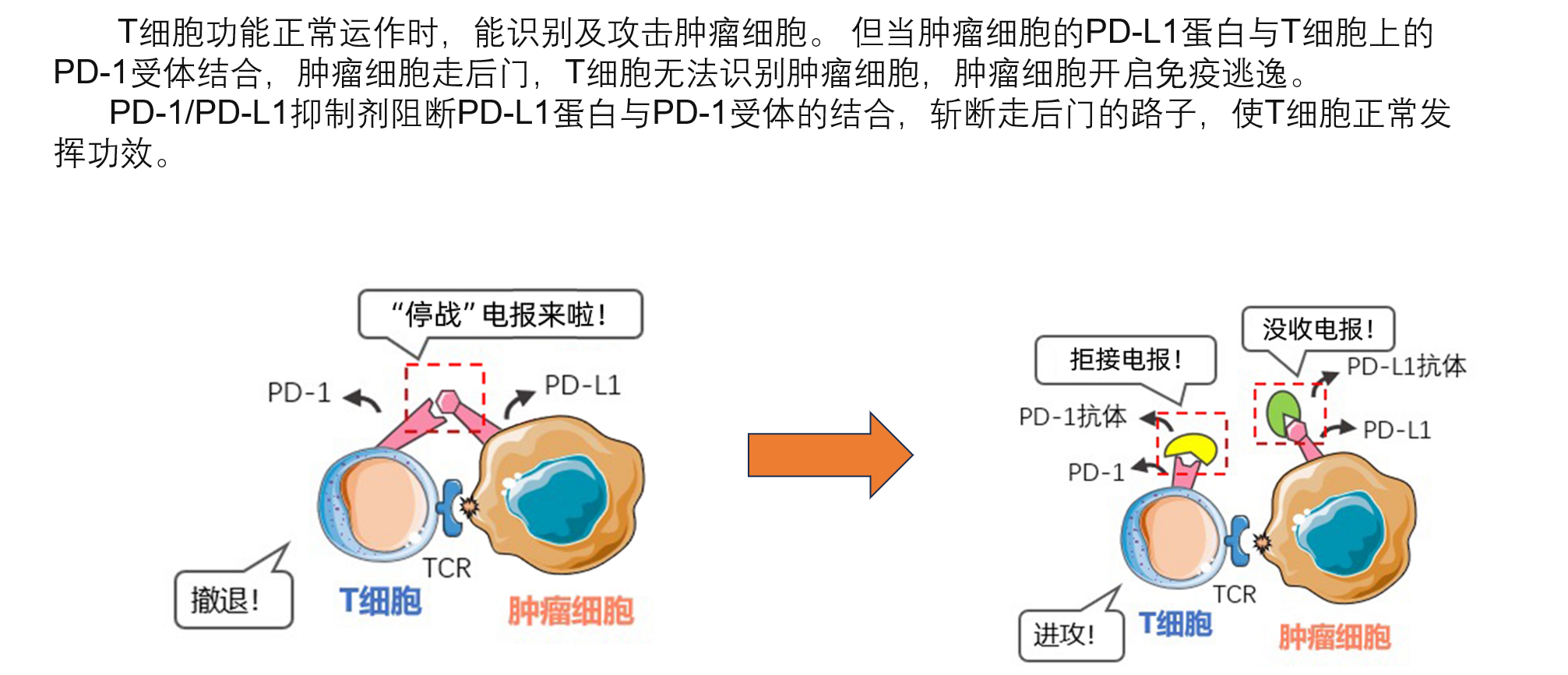
下面两张图简单讲了PD1/PDL1抑制剂药物机制的原理,核心点是通过复杂的抗原提呈过程,提呈什么呢?肿瘤细胞的样貌特征,树突状细胞拿到肿瘤细胞(罪犯)的样貌特征,相当于画了一张带有肿瘤细胞样貌特征的通缉令给T细胞(警察),T细胞带着这张通缉令去找肿瘤细胞,发现一个都会比较一下,如果对上了,就要开杀戒。但是肿瘤细胞很狡猾,有个走后门的通路,而PD1/L1抑制剂把这条走后门的路数堵上,让T细胞可以正常对肿瘤进行杀伤。
这个机制的前提是肿瘤细胞表面高度表达PDL1,但是小细胞肺癌恰恰是冷肿瘤,只有部分病人表达PDL1,一项对IMpower133研究的回顾分析也证实T药只能对一小部分病人带来生存获益。
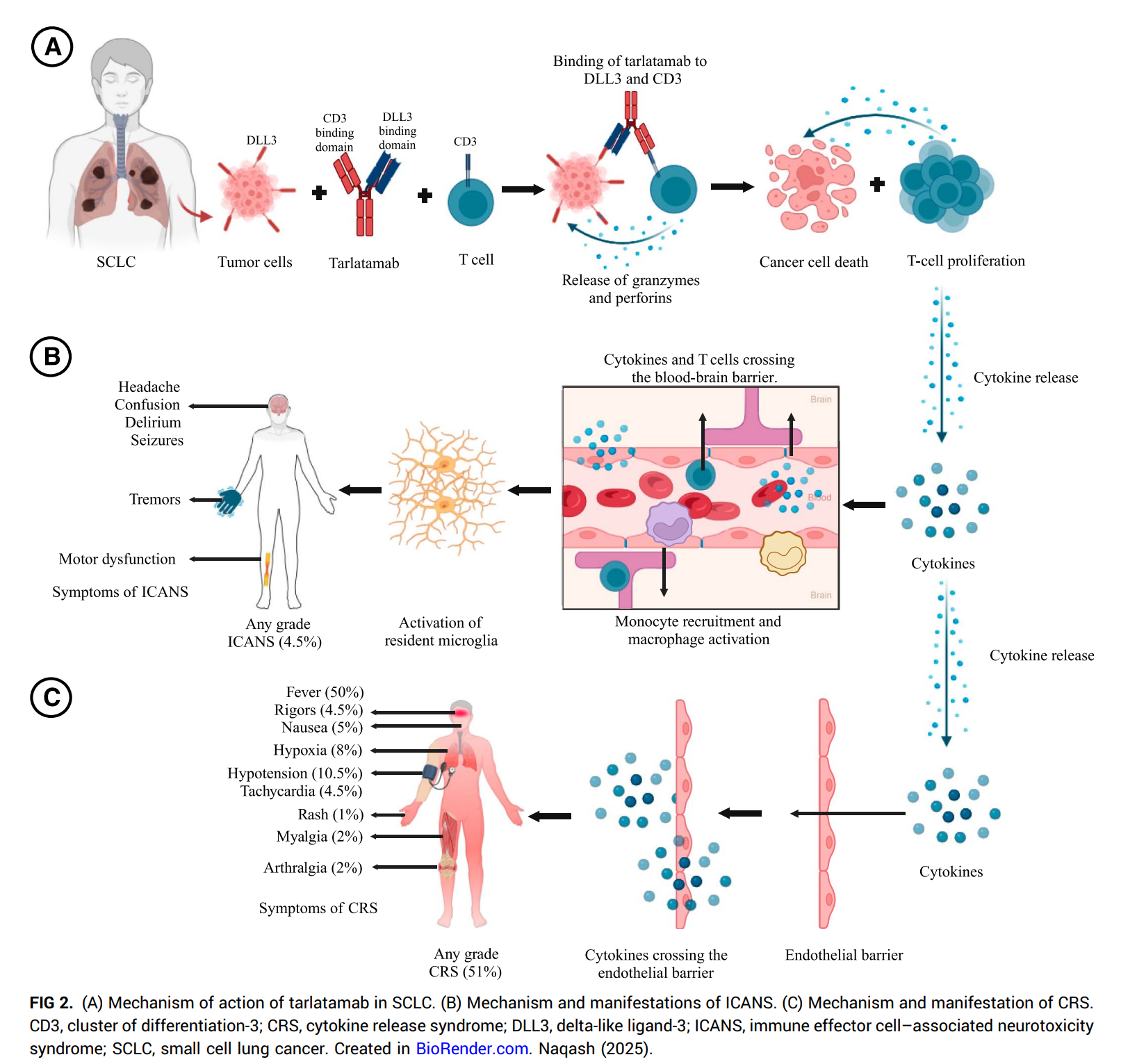
塔拉妥作为一款TCE,作用机制就不一样了,如下图所示,塔拉妥通过拉郎配的方式,把表达DLL3的肿瘤细胞和表达CD3的T细胞拉在一起,T细胞就会大开杀戒,而无需肿瘤细胞的画像,也就是不需要像PD1/PDL1那样复杂的抗原呈递过程。是一种高效的免疫杀伤方式。
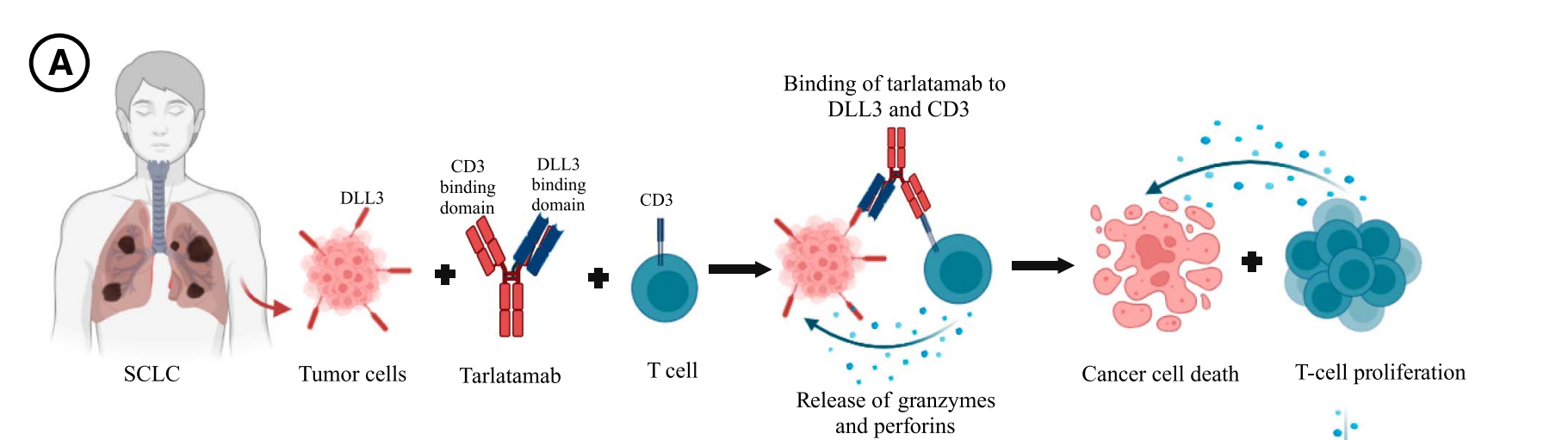
但是这种机制需要依赖一个靶点,肿瘤表面要有特定的蛋白(靶点),并且最好这个(蛋白)靶点只能表达在肿瘤表面,不能表达或者非常低表达在正常细胞。否则T细胞也会把正常细胞进行杀伤,那就产生了毒性。也就是说,靶点要很干净。
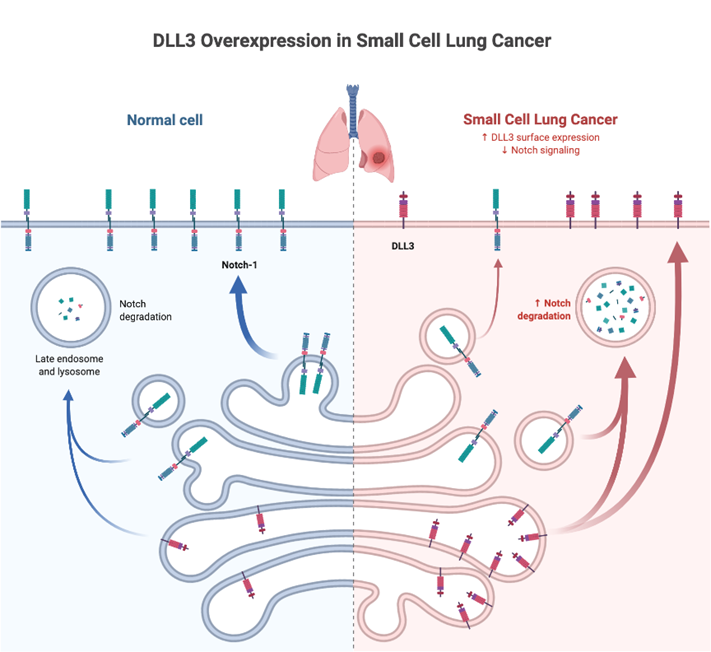
而小细胞肺癌正好提供了这么一个干净的靶点,就是DLL3靶点。下图可以看到,正常细胞不表达DLL3,但是小细胞肺癌肿瘤细胞会表达DLL3。这就是塔拉妥为什么可以用在小细胞肺癌上的关键所在,当然其他高表达DLL3的,如NEC,也是塔拉妥可以开发的适应症。
但是TCE强效也带来了比较明显的副作用,CRS和ICANS,这个在第一款贝林妥欧开发过程中就已经伴随而来。安进采用的策略是通过剂量爬坡给药的方式,尽量降低塔拉妥的副作用,但是这需要病人短期住院进行全程监视,不可避免给病人带来额外的时间和金钱成本,也对医院的资质提高了要求,在小诊所是不具备塔拉妥给药条件的。所以,塔拉妥这枚硬币的另一面就是患者依从性不够好。当然,这也为后来者带来了改进的空间。
本篇先到这里,下一篇详细梳理一下安进塔拉妥的临床开发历程和动态。
ps,前几天在公园拍了一张让人忍俊不禁的照片
