“非淡泊无以明志,非宁静无以致远。”亚盛医药2025ASH会议有感
本次ASH会议,或许是这些年来持续跟踪过程中,个人觉得最精彩的一次。
CLL的神仙打架,MM的临床变局,CML的百尺竿头更进一步,以及MDS为将来的突破探明了方向,每一个适应症的重要报告发布,都有非常值得可圈可点的地方。
落实到亚盛医药的各项已发布的进展,都落在了预期之内,同时,通向成为全球Biopharma的道路,更加清晰了几分。
以下抓紧时间进入正题。
一、维奈克拉对于HR-MDS最大的贡献,是为利沙托克拉的临床成功开发奠定了扎实的基础
本次的MDS口头报告,是在ASH会议的第一天,容纳上千人的会场进行,全场几乎座无虚席。
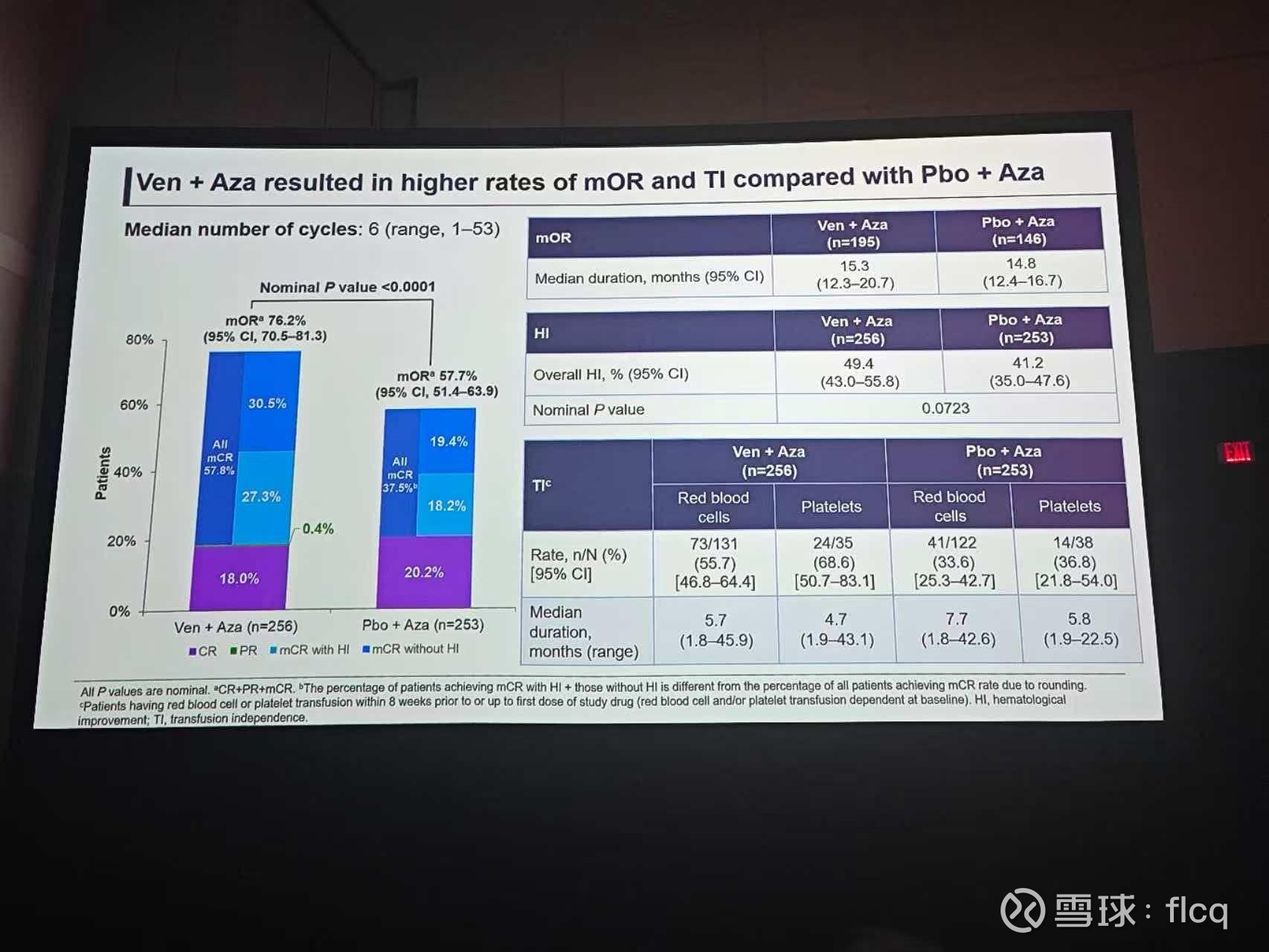
口头报告的重头戏是关于维奈克拉的两项HR MDS研究,一个是三期的VERONA试验,一个是Ven+Aza在全美19家医院的一项上千人真实世界研究的数据发布。
在HR MDS这个适应症上,基于标准治疗阿扎胞苷,加一个维奈克拉到底有没有效?
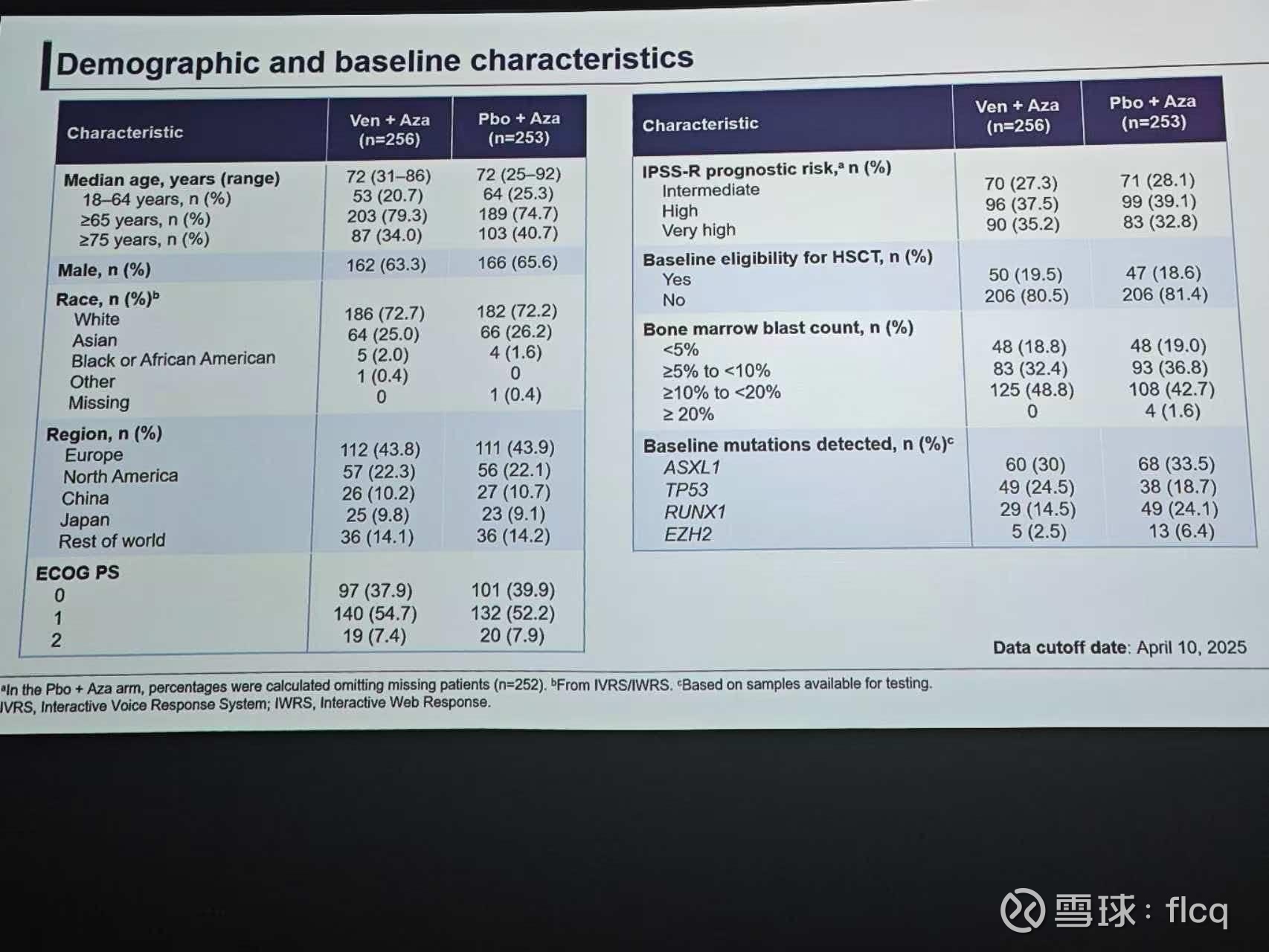
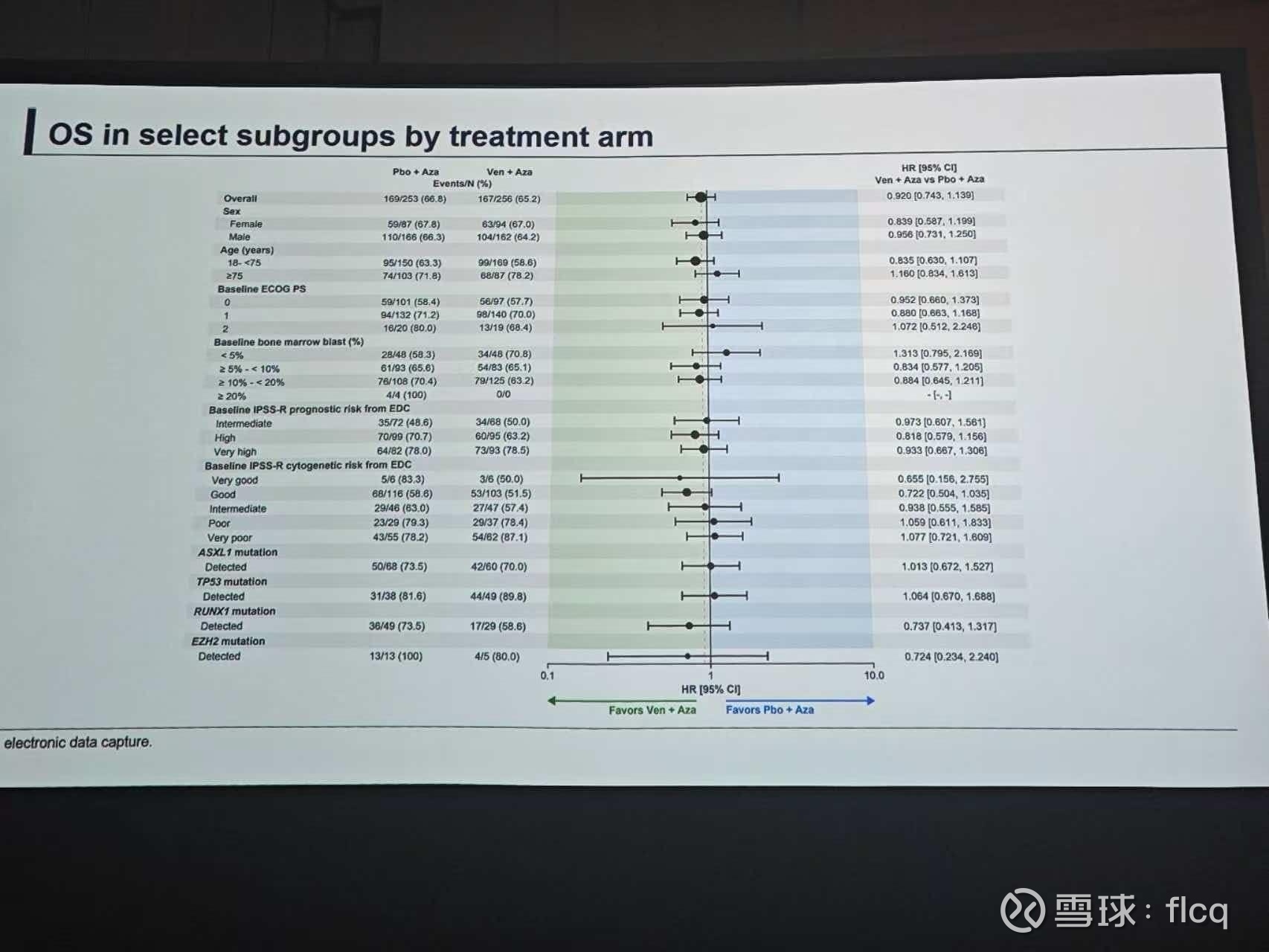
在全美19家中心的真实世界研究中,清清楚楚地写着:有效,而三期的VERONA注册性研究,却无法在OS上形成统计学差异。
V药明明是一款对HR MDS有效的药物,可临床三期一败涂地的根本原因是什么?
这几个月以来,我在思考这个问题的时候,找了很多的这样那样的原因,但与此同时,一直在想要找到一个逻辑很简单直白的答案,一个在根源上能说清楚到底是为什么的答案。
“Seven days…”MD Anderson的MDS全球头号PI的话一直在耳边回响。
分子是武器,临床设计是灵魂。
魔鬼藏于细节之中,案场一线有神明。
在Ven+Aza的1b期临床方案结果中,RP2D剂量下,AZA 75mg+14天 VEN400mg,患者的中位治疗时间,是4个周期,而且,是开放标签少数中心管理下的4个周期。
此前AZA单药在HR MDS上的各项研究和应用,中位治疗时间都在6个周期。
艾伯维/罗氏的团队,带着14天的方案,带着1b期中位治疗时间4个周期的剂量方案,走进了临床三期。
Verona失败的种子,在那一刻已经悄然埋下。
在全美的真实世界研究中,包括在国内各个血液科的真实世界应用中,Ven的剂量是定制方案,可根据患者的耐受性来进行灵活调整,7天400mg,14天200mg,7天200mg,患者的获益,是基于灵活的尽可能的耐受的剂量调整,以及临床单位是支持治疗(抗感染,输血等)条件最好的研究中心。
为什么调整Ven的剂量?因为HR MDS首先要抑制的是MCL-1,而抑制Bcl-2则是在抑制MCL1基础上加的buff。抑制MCL-1,靠的是AZA,AZA不能动。
4个周期的中位治疗时间,没有让Ven的临床团队引起足够的重视,也许他们心里的还对28天降到14天而担心疗效不足,没有再进一步向下摸两组剂量,扎实定一个容错率更高的RP3D剂量。
Verona是双盲,这个RP2D带来的直接后果,就是患者不耐受,盲态下只能减量AZA。
而减量AZA又会涉及到一个极其关键的细节,75mg标准剂量的AZA,到底减量多少?
对照组也有27%的单药AZA减量,75mg减到50mg占满了安全窗,治疗组由于400mg 14天长半衰期的VEN占据大量安全窗,毒性超标,造成高达48%的AZA减量,其中很多患者AZA剂量减到35mg甚至更低。
35mg和75mg的AZA能是同一个效果?低剂量的AZA,压不住MCL-1。
所以,我们看到的Verona的治疗组,不是浅显的两个药打一个药,而是用一个不太精确但能表达意思的形容,是中位4个周期75mgAZA+400mgVen,中位超过4个周期的35mgAZA+400mgVen的大杂烩治疗组方案,去和中位6个周期75mg的AZA来对狙。
讲真,这个联合治疗组,从纸面实力上来细致分析,这两个组,很难说清楚谁实力更强。联合上减量Aza的后果,比起减量Ven要差太多了。
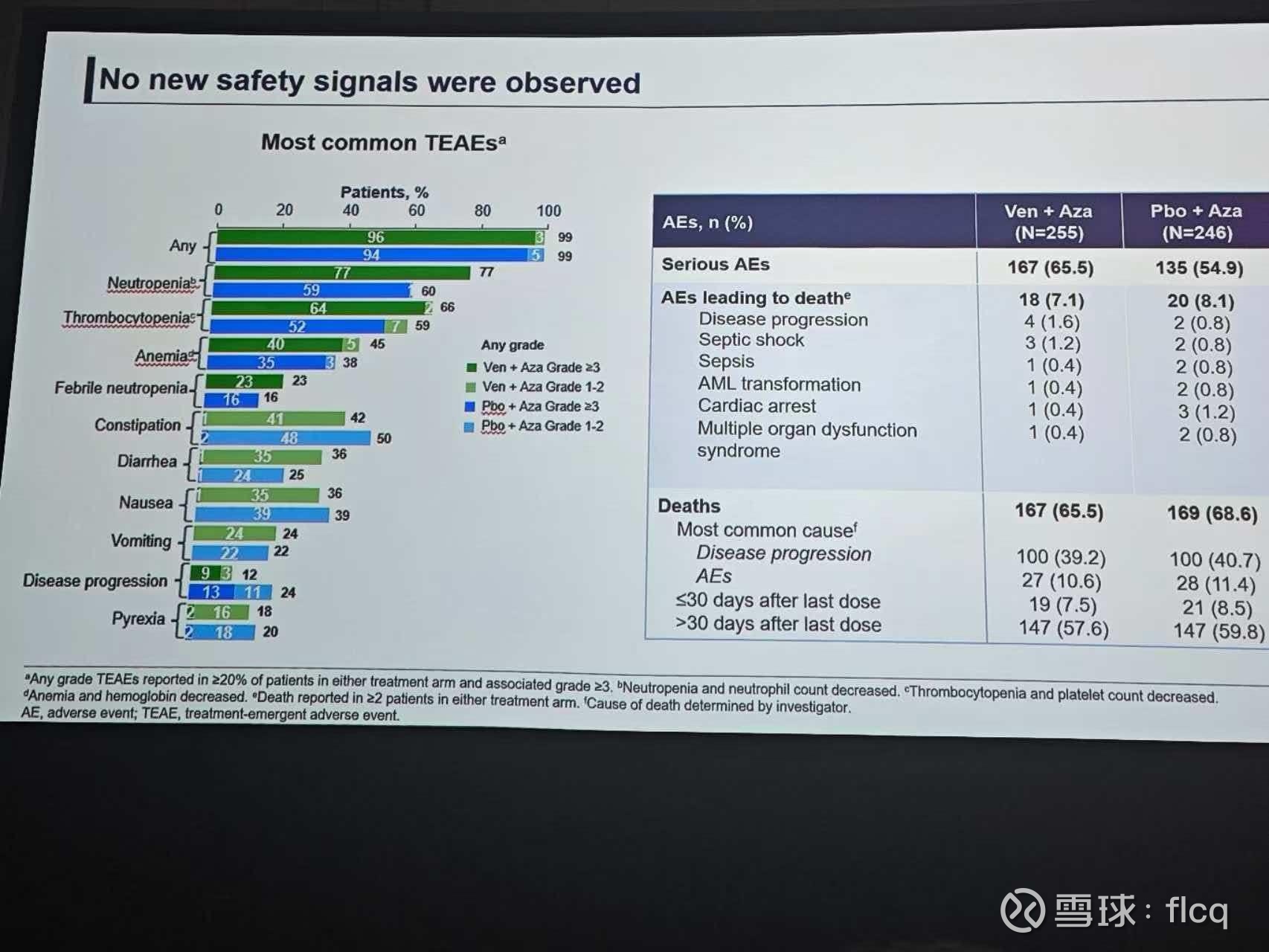
因此,最终的结果的确也是难解难分,这个低剂量AZA+Ven盲态下的4个周期方案,在和AZA足剂量6个周期的对比中,无论从CR还是OS上,都没出现统计学差异。治疗组的CR率,实在是差劲得让人不敢相信这个结果是真的。
现在可以一句话形容Verona为什么失败?因为治疗组上场的根本就不是正常状态的AZA+VEN,同时,游走在安全性的悬崖,全球100多个中心的支持治疗水平不一,让治疗组更多严重不良反应在向OS转化的进程充满了荆棘。
如果,Ven多做个2b,往下做两个剂量组?如果RP3D是“Seven days”?或许结果大有不同。
然而,Verona的暗夜,依然泛出了熹微的晨光,照亮了AZA+Lisa方案GLORA4前进的方向。
原始细胞<5%的不要入或者少入,加一个bcl2贡献不了疗效反而增加毒性。
TP53突变尽量少入,虽然Ven在这类患者中竟然弱于对照组让人无法相信,但在真实世界研究中,非TP53突变的患者OS高达30多个月的获益程度让人感到非常振奋。
虽然低剂量AZA影响了治疗组缓解深度,CR率差强人意,然而治疗组接近80%的ORR仍然逼近了日常发挥的水平。而这一缓解指标带来了更高的骨髓移植率,更多的治疗组患者接受了骨髓移植,从而转化成了os的远端获益。
入组年龄往下压一压,也能够带来更高的移植比例增加胜率。
同时,维奈克拉在Verona上的失败,也让FDA充分认识到在HR MDS上,一款新药的成药难度,最终点头同意GLORA4采用双终点方案,且CR的认定以2023年更新后的版本为准。这不仅大幅提升了Glora4的胜率,同时也能够使得加速审评框架下实现早日上市销售,从而创造了条件。
Lisaftoclax的“Hit and run”短半衰期的特性带来的安全窗,药物机制带来的疗效优势,闭卷考试下更好的安全性带来的正常发挥水准的能力,以及入组患者避免维奈克拉踩过的雷,2023版CR率新认定方式的神助攻,加总所形成的累积优势,临床团队精细的管理,将最大限度地保证各类优势向全面的胜势进行转化。
本次ASH会议的MDS会场,虽然Lisaftoclax是来打酱油的,然而Verona和维奈克拉真实世界研究燃烧的火炬,照亮了Glora4的前程。
至于Glora4对于亚盛医药有多重要,懂的都懂。
附:维奈克拉高危MDS真实世界研究摘要
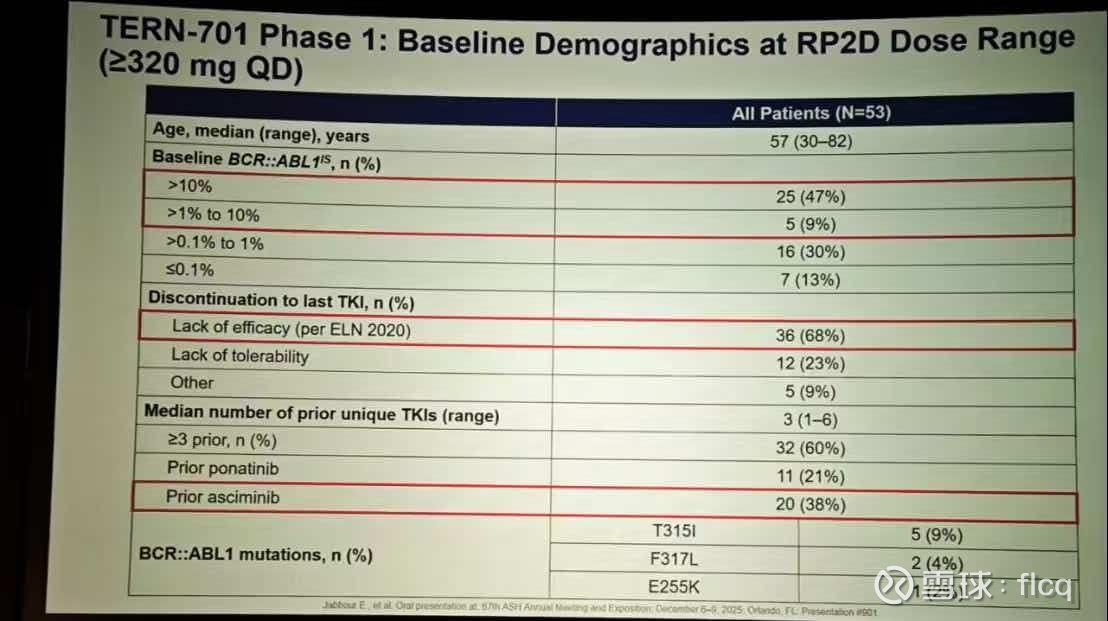
二、Terns-701的惊艳数据亮相,对于奥雷巴替尼在CML上的开发前景,将会带来怎样的挑战和促进?
701的数据,一眼好,认真看10秒钟就能非常笃定的那种好,有一种701以后的别的药,都别再做CML的那种既视感的那种好。
要不是之前全方位覆盖过CML的全部竞品,知道701是变构抑制剂,不然看到这样的数据,真会为奥雷巴替尼捏一把汗。
好在,奥雷巴替尼是TKI,701是变构抑制剂,完全不同的作用机制,使得他们在CML上的互补性显著大过于竞争性。
701和阿思尼布同为变构抑制剂,结合的位点不同,间接抑制BCRABL,从单药疗效和安全性数据来看,701更有潜力成为一款升级版的阿思尼布。
美国和其他全民健保的国家和地区,都是属于吃自助餐的市场,患者只看疗效,不看价格,因此阿思尼布在挺近一线的首年,就在美国市场的一线CML的市场中,斩获18%的处方量,而这一比例预计在后续将飞速爬升。
在不远的将来,我们也能看到701上一线头对头阿思尼布,加入变构抑制剂在一线CML渗透的情景。
变构抑制剂耐药后用什么?最佳的选择其实只有一个,就是具备差异化的机制,最强的TKI。除非患者是年轻美女,否则奥雷巴替尼是变构抑制剂耐药之后的唯一最优解。
在过去,只有123代TKI的时代,一开始舍不得用最好的药,怕耐药以后无药可治。
时至今日,CML患者最大的福音,是同时拥有了阿思尼布,奥雷巴替尼和Terns701这三个有差异化机制的互补组合,一个好药耐药以后,还有下一个,因此放心尽早用好药。新的好药进入临床后期,给予了患者更大的信心。
CML的市场将随着奥雷巴替尼和701 两款新药的加入,变得更大。在吃自助餐的市场,不需要考虑一二代TKI这些仿制药。
同时,奥雷巴替尼还有几个独特的优势,在T315i突变,加速期和急变期,有着充足的临床数据证明自己的卓越性。
打一个最形象的比方,阿思尼布是内斯塔,701是卡纳瓦罗,奥雷巴替尼就是小将布冯。
本次ASH,奥雷巴替尼在二线CML上的数据,进一步证明了先站稳3L+之后,进一步向前线挺进的确定性。同时,PI还想着拿奥雷巴替尼上一线,因为可能会使相当大一部分患者实现停药功能性治愈。就看武田想不想冲了。
总而言之,Terns701的横空出世,对于奥雷巴替尼而言,有竞争,也有成就。共同有利于患者,共同做大CML市场蛋糕。
其实,这些天来$Terns(TERN)$ 的走势,说明美国投资者挺愿意为CML出价的,这是好事。
至于很多朋友关心的Terns701和奥雷巴替尼的疗效对比。
我只想说,两个不同环境下的单臂研究的数据仅供参考,能够看一个大概用于定性就好了,无法下一个定论。
同时,如果一定要进行对比,至少得先把基线大致对齐才好比。
就像是Tern701的基线,RP2D剂量下,前面3L+比例是60%,阿思尼布经治是38%,普纳替尼经治是21%,而奥雷巴替尼的数据,前面3L+比例高达82%,阿思尼布经治比例31.3%,普纳替尼经治比例高达57.5%。
所以,没办法在基线对不齐的情况下直接对比,只能说两个都是很好的药,临床进度更快的一家(奥雷巴替尼)能够占一些先手。

三、MM的临床水准升格,对于利沙托克拉在该适应症的开发前景会带来怎样的影响?
多发性骨髓瘤的临床进展新突破,全面进入到了BCMA和GPRC5D时代。
TCE双抗/三抗和CAR-T的持续性迭代,优秀的临床数据层出不穷,有效性刷到100%以后,缓解的深度,持续时间,安全性和依从性的升级成为了竞争的核心。
多发性骨髓瘤作为几乎无法治愈的疾病,得益于上一两代药物来那度胺和达雷木单抗,患者的总生存期从2年的拉到了5年以上,慢病化的进程中,也累计了非常巨大的患者池,而这些患者,在其中某一线疗法耐药之后,一定要去换一个新的疗法进行接续。
MM的治疗目标,100%ORR不是唯一的终点,目前已经演化成了长期治疗,多线治疗,需要不同机制药物持续序贯管理的一项慢性病。
Bcl-2抑制剂的开发价值点,在于进入其中某一线作为全口服方案的联合用药。免疫调节剂来那度胺泊马度胺是口服药,蛋白酶体抑制剂伊沙佐米是口服药,地塞米松是口服药。
口服方案,在便利性和依从性上能创造优势,开发的关键点,是体现出有效性的升级,最重要的是需要更好的安全性,在维持治疗中扮演重要的角色。
关于Lisaftoclax在多发性骨髓瘤的开发预期和开发逻辑,所有的已知信息还停留在去年的ASH,高剂量针对R/R MM的全人群。当前期待着三期注册临床的方案的尽快获批和开启。
同时,值得注意的是,MM口服方案中,新机制的引入总会让新的临床探索机会变得很有趣。本次ASH会议,亚盛医药在MM上并非什么都没干,而是发布了表观遗传调控药物,口服EED抑制剂APG5918的临床前模型,能够克服免疫调节药物(来那度胺/泊马度胺)的耐药,以及和免疫调节药物的联合治疗协同的前景。
APG5918这个药很有趣,如果能够在MM上实现登场,那么除了表观遗传PRC2/EED的机制,克服来那度胺泊马度胺免疫调节剂耐药,更有开发想象空间的是其具备的免疫调节机制,能作为免疫疗法的增敏剂,和BCMA,GPRC5D的双抗/三抗/CAR-T形成联合治疗,改善免疫细胞功能,增强杀伤活性,改变肿瘤细胞抗原表达,以及基于表观遗传打破肿瘤免疫的逃逸机制,全方位带来肿瘤免疫的增敏。从而为患者带来更加深入持久的缓解,甚至往实现功能性治愈的目标冲击。
多发性骨髓瘤,在人类征服肿瘤疾病的进程中,提供了一个经典的药物开发演进范式。当前的多种实体瘤,正在像多发性骨髓瘤一样,从OS只有1-2年的绝症,在多种机制新药和联合用药的序贯管理下,向OS3-5年及以上的慢性病进发。
四、CLL神仙打架进入白热化,亚盛在此其间的开发空间,是濒临出局还是接近握住胜负手?
本次ASH,CLL在神仙打架的提档竞赛中再度更新。
整个市场新方向归纳起来就三类,BTK非共价冲一线和做经治(礼来,默沙东),BTK蛋白降解剂迭代BTK抑制剂(百济,Nurix),以及Bcl-2和BTK之间的联用。
从整个适应症临床格局上来讲,就是两个开发方向,一个是一线治疗当前有效性已经拉满完全慢病化的情况下,评价长期安全性和依从性谁能做得更好。另一个就是经治耐药市场怎么做。
本次ASH,一个预期之内的临床试验结果,朴实无华地给出了一个很好的答案。
APG2575,作为Bcl-2的方案中,仍然是只需要5天剂量爬坡,联合用药情况下无需BTK导入的唯一选择,仍然是需要长期安全性用药中最好的Bcl-2。
其它的就看各大药企不断拿出更强的BTK,能否在单药的情况下做到更多的事情。
关于CLL,今天不想写太多,一两年前已经写了太多太多的文章,其中一年前有一篇分析得比较清楚,当前基本就是按照此前写的剧本来走的。
五、AML的未来的临床突破是什么?亚盛医药的临床开发反映了对AML怎样的理解?
有一说一,亚盛或许从一开始,就没想过要在美国通过2575+AZA的方案冲AML unfit一线,不然也不会仅仅只入组了7名患者。
作为血液科预后最差,少数尚未被慢病化的适应症,AML的临床突破始终建立在通过更加有效的药物带来深度持续的缓解,且患者骨髓基线就很差,药物还得具备很好的安全性,使得患者可耐受提升依从性。
维奈克拉之后,这些年来真正的临床主要进展是在靶向药,将AML进行分型。FLT3,IDH1,NPM1,KMT2A,精准治疗带来了相对于过往标准治疗当中真正的有效性突破。
Lisaftoclax不能被定义为亚盛医药在AML上的适应症答案,它更像是一个去争取线权的抢滩先锋。GLORA3在中国和非美国家开展的全球试验,让亚盛医药能够拿到unfit一线治疗的线权,而在美国市场,Lisaftoclax则是力图针对于缺乏标准治疗的复发难治的市场实现成药机会。
AML短期的临床开发方向,短期是靶向联合延长生存期,长期是实现弱化疗甚至无化疗。
在AML全面走向不同机制的靶向联合时代,亚盛医药在Lisaftoclax全面抢滩登陆以后,储备了至少3-4款分子的联合治疗方案,在将来持续优化和迭代。
因此现在还不是看亚盛医药在AML上实现多少峰值的时候,现在的核心,是2575在AML上实现抢滩登陆,顺利完成GLORA3,在美国开出R/R AML的注册临床。
六、接下来的彩蛋是什么?
新分子:将意味着亚盛在血液科的基本盘之外,有了更大的图谋。
联合用药:口服药物的组合开始上临床强度,开始基于挑战身位进行加速。
(已完结)