IRONMAN-II试验解读:铁基生物可吸收支架在冠状动脉疾病治疗中的前景评估
$先健科技(01302)$ $乐普医疗(SZ300003)$
IRONMAN-II试验的2年随访结果将在10月底的TCT2025会议公布,到时候可以来看看AI预测结果准不准。
第一部分 冠脉支架的演进:从永久牢笼到“隐形”植入物
1.1 永久性金属药物洗脱支架(DES)未被满足的需求
现代药物洗脱支架(DES),特别是以依维莫司洗脱钴铬合金支架(CoCr-EES)为代表的第二代产品,无疑是介入心脏病学领域的一场革命。与裸金属支架和第一代DES相比,它们显著降低了再狭窄和支架内血栓的发生率,成为经皮冠状动脉介入治疗(PCI)的基石 。然而,尽管取得了巨大成功,一个永久性金属植入物的存在本身也带来了固有的、长期的局限性,临床上常称之为“血管囚禁”(vessel caging)。
这些局限性构成了推动支架技术进一步发展的核心驱动力。首先,永久存在的金属支架可引发慢性血管炎症和内皮功能障碍,限制了血管正常的舒缩反应(reactive dysmotility)。其次,金属笼的机械性束缚阻碍了血管在远期发生适应性的正性重构(late positive remodeling),并使其丧失了对生理性剪切力作出反应的血管舒缩功能(reactive vasomotion)。此外,尽管发生率很低,但永久植入物仍带来持续的、年复一年的器械相关不良事件风险,如新生动脉粥样硬化和极晚期支架内血栓 。最后,永久支架的存在会“囚禁”(jailing)边支血管的开口,并可能使未来的外科血运重建(如冠状动脉旁路移植术)变得复杂化 。这些未被满足的临床需求,共同指向了一个明确的研发方向:开发一种能够提供短期支撑然后消失的瞬时性血管支持装置,而非永久性植入物。
1.2 第一代生物可吸收支架(BRS)的希望与险途
为了应对永久性金属支架的挑战,生物可吸收支架(BRS)的概念应运而生。其理论构想极具吸引力:在PCI术后提供临时的机械支撑以对抗血管的急性和慢性回缩,同时洗脱抗增殖药物抑制内膜过度增生,最终在完成使命后完全被机体吸收,从而“解放”血管,恢复其自然结构和生理功能 。
以Absorb生物可吸收血管支架(BVS)为代表的第一代聚合物BRS是这一理念的首次大规模临床实践 1。然而,临床现实却与理论预期相去甚远。多项大规模随机临床试验一致表明,在植入后的3年吸收窗口期内,与CoCr-EES相比,Absorb BVS与更高的器械内血栓和心肌梗死发生率相关 。这一令人失望的结果背后,是第一代BRS在材料和设计上的根本性缺陷:
材料的局限性: Absorb BVS采用的聚左旋乳酸(PLLA)聚合物,其径向支撑力远不及金属合金。为了获得足够的机械强度,其支架丝厚度不得不增加至约157 µm 。
器械相关问题: 过厚的支架丝导致了一系列问题,包括支架扩张不充分、急性回缩率高以及扩张能力受限。这些因素共同作用,增加了早期支架内血栓的风险 。
生物吸收过程: PLLA通过本体降解(bulk erosion)的方式进行吸收,这一过程不均匀且难以预测,常常导致支架在吸收过程中失去结构完整性,发生断裂和腔内解体,为晚期和极晚期血栓的形成提供了温床 。
Absorb BVS的失败并非生物可吸收这一“理念”的失败,而是第一代“材料与设计”的失败。这一关键认知指引了后续的研发方向。临床界最初对“不留痕迹”的概念抱有极大热情 ,但Absorb BVS在与金标准Xience EES的头对头比较中,尤其是在血栓安全性方面的劣势,导致其最终退出市场,也让整个BRS领域陷入低谷 。然而,对失败案例的深入分析表明,问题根源直指PLLA材料过厚的支架丝及其不良的机械性能 。因此,合乎逻辑的下一步并非放弃生物可吸收概念,而是寻找一种能够克服这些特定局限性的新材料。铁,凭借其高径向强度,使得制造具有DES般纤薄支架丝的BRS成为可能,从而直接解决了第一代技术的核心症结。IRONMAN-II试验正是在这样的背景下,对“第二代BRS”假说的一次关键验证。
1.3 金属生物可吸收平台的理论基础:寻找更优材料
从第一代聚合物BRS的经验教训中,研究人员开始探索替代材料 。镁基支架是其中一个方向,但同样面临挑战,包括支架丝较厚、降解过快导致径向支撑力过早丧失等问题 。
在此背景下,铁作为另一种候选生物可吸收金属材料,展现出独特的优势。其固有的物理特性使其成为一个极具吸引力的平台:优异的机械性能,包括强大的径向支撑力和良好的延展性;同时,铁作为人体必需的微量元素,具有良好的生物相容性 。然而,将铁应用于BRS面临一个核心的工程难题——其固有的腐蚀降解速率过慢 。如何精确控制并加速其降解过程,使其与血管愈合的时间轴相匹配,成为开发铁基BRS技术的关键。这为IRONMAN-II试验中所评估的这款新型铁基支架的特定技术创新埋下了伏笔。
第二部分 西罗莫司洗脱铁基生物可吸收支架(IBS):技术深度解析
2.1 器械的解剖学构造
IRONMAN-II试验中评估的新型西罗莫司洗脱铁基生物可吸收支架(IBS)是由Biotyx Medical(前身为Lifetech Scientific)开发的一款创新器械 4。其设计精巧,旨在克服第一代BRS的缺陷。
支架骨架: 核心是一个超薄(70 µm)的氮化铁平台 。70 µm的支架丝厚度是一个关键参数,与Absorb BVS的约157 µm和现代CoCr-EES的约81 µm相比,具有显著优势。更薄的支架丝轮廓被证实与更低的血栓形成风险和更快的内皮化速度相关 。
亚微米涂层: 支架表面覆盖有一层亚微米级的锌层。这是一个至关重要的创新设计,其作用是双重的:在植入初期,它能保护铁基骨架免于过早腐蚀;而在后期,它则作为牺牲阳极,通过电偶腐蚀效应加速铁的降解 。
药物与聚合物: 支架外层涂覆有可降解的聚D,L-丙交酯(PDLLA)聚合物,用于洗脱抗增殖药物西罗莫司 。西罗莫司是一种成熟的mTOR抑制剂,已在众多成功的DES平台中得到广泛应用。以一个3.0x18 mm规格的IBS为例,其精确成分包括:10.0 mg铁、0.44 mg锌、0.64 mg PDLLA和0.18 mg西罗莫司 。
2.2 生物吸收动力学:一种可控的降解过程
IBS的核心创新在于其经过精密工程设计的多阶段生物降解过程,旨在实现可控、可预测的吸收。
第一阶段(最初3-6个月): 维持机械完整性。在此阶段,锌层保护着铁基骨架,确保支架在PCI术后血管愈合的关键时期提供必要的径向支撑力 。猪冠脉模型的临床前研究显示,在植入后6个月内未观察到明显的生物腐蚀 。
第二阶段(后续数月至约2年): 加速且可控的降解开始。铁的氮化处理和与锌层形成的电偶效应共同促进了一个可预测的腐蚀过程 。这一过程的时间线被设计为与血管壁的愈合周期相匹配。
完成阶段(约2年): 在大约2年后,支架预计完全被生物吸收,最终只留下一个愈合的、被“解放”的血管 。
2.3 临床前及首次人体(IBS-FIM)研究证据
在启动更大规模的IRONMAN-II随机对照试验之前,IBS已经积累了坚实的临床前和初步人体研究数据。
临床前数据: 在猪和兔的动物模型中,IBS展示了良好的安全性、生物相容性,与EES相比未见过度炎症反应,且未发生支架内血栓 。值得注意的是,研究发现IBS的支架丝内皮覆盖速度甚至比CoCr-EES更快 。
IBS-FIM试验(NCT03509142): 这项前瞻性、单臂研究纳入了45例非复杂病变患者,为IBS提供了首个人体应用数据 。
临床结局(3年): 结果非常鼓舞人心。靶病变失败(TLF)率在6个月时为2.2%,3年时为6.7%,且所有TLF事件均由临床驱动的靶病变血运重建(CI-TLR)构成。至关重要的是,在长达3年的随访中,未发生任何死亡、心肌梗死或支架内血栓事件 。
影像学结局(QCA, OCT): 这些数据为IBS的优异表现提供了机制上的解释。
定量冠状动脉造影(QCA)显示,支架内晚期管腔丢失(LLL)值低且稳定:6个月时为0.33 mm,3年时为0.37 mm 。
光学相干断层扫描(OCT)显示了快速且完全的血管愈合过程:支架丝覆盖率在6个月时已达99.8%,1年后达到100% 。
OCT测量的3年支架丝吸收率达到了95.4%,证实了其生物吸收的时间线与设计相符 。
IBS的设计体现了针对第一代BRS特定失败模式的多方位工程解决方案。它并非简单的材料替换,而是一个复杂的多组分系统。Absorb BVS的失败源于PLLA材料强度不足导致的厚支架丝(约157 µm),这是血栓事件的主要驱动因素 。IBS的对策是采用高强度的氮化铁,实现了70 µm的超薄支架丝,直接解决了这一核心问题 。同时,Absorb BVS不可预测的本体降解导致支架解体和晚期事件 ,而IBS通过锌牺牲层和氮化技术实现了可控的多阶段降解 3。这一过程确保了在内皮化(1年时已100%覆盖)完成后才开始显著降解,从而降低了晚期事件风险 。此外,纯铁降解过慢的难题也被氮化和锌电偶腐蚀技术所攻克 。因此,IBS不仅仅是一个“铁支架”,其每个组成部分(铁、氮化、锌、PDLLA、西罗莫司)都是为抵消前代BRS技术的已知失败机制而精心设计的。IBS-FIM试验的优异结果正是这一精准工程理念的直接体现。
第三部分 解构IRONMAN-II试验:一场巅峰对决
3.1 试验架构与终点
IRONMAN-II是一项前瞻性、多中心(中国36家中心)、随机对照试验(RCT),旨在直接比较新型IBS与现代金属DES的性能 。
设计与人群: 共518例冠状动脉疾病患者按1:1的比例被随机分组 12。尽管IRONMAN-II的具体入排标准未在现有资料中详述,但根据IBS-FIM和IRONMAN-III研究的惯例,可以推断其入选人群主要为单一、非复杂的“新生”(de novo)冠状动脉病变患者 。
随机化: 257例患者被分配至IBS组,261例患者被分配至金属DES组 。
主要终点: 该试验的统计学效能设计旨在检验IBS在主要终点上的非劣效性。主要终点为术后2年时,通过QCA测量的节段内晚期管腔丢失(in-segment late lumen loss, LLL) 。这是一个关键信息:试验的主要终点是一个影像学替代指标,而非临床事件终点。这通常用于评估器械的抗再狭窄效果。
主要次要终点: 包括一系列能够提供更深层机制信息的影像学和生理学指标,如2年时的定量血流分数(QFR)和通过OCT测量的平均血流横截面积 。靶病变失败(TLF)等临床结局将作为关键的次要终点进行评估。
3.2 支架对比分析
本试验的核心是两种代表了不同技术哲学路径的器械之间的直接比较。
试验组:西罗莫司洗脱铁基生物可吸收支架(IBS): 其特性已在第二部分详细阐述。核心特点:70 µm支架丝厚度、氮化铁骨架、西罗莫司药物、可生物降解、最终完全吸收。
对照组:钴铬合金依维莫司洗脱支架(CoCr-EES): 这是当代PCI领域的“金标准” 。尽管IRONMAN-II的设计方案中未指明具体的支架型号 12,但其原型是XIENCE系列等平台。核心特点:约81 µm支架丝厚度、钴铬合金、依维莫司药物、耐久性生物相容性聚合物、永久性植入物 。CoCr-EES以其在长期随访中极低的支架内血栓率和靶病变失败率而著称 。
为了清晰地展示两种技术的根本差异,下表对它们的关键特性进行了总结。
表1:器械特性对比:西罗莫司洗脱IBS vs. CoCr-EES
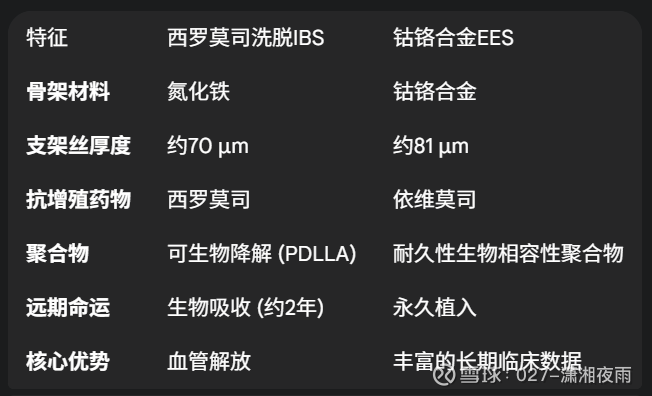
这张表格直观地揭示了试验的本质:这是一场关于“瞬时支撑后解放血管”与“永久支撑以维持管腔”两种策略的较量。IBS的假设是,通过在完成短期支撑任务后消失,可以避免永久植入物的长期风险,并恢复血管的自然生理功能。
第四部分 解读早期信号:IRONMAN项目的初步结果
4.1 1年期汇总数据分析(IRONMAN-II & III)
目前可获得的最具影响力的IBS临床数据,来源于在2024年TCT会议上公布的一项汇总分析。该分析合并了IRONMAN-II试验的IBS组(n=259)和IRONMAN-III单臂试验(n=802)的数据,共纳入1061例接受IBS植入的患者 。
患者与病变特征: 该队列代表了低至中度复杂度的DES试验人群:平均年龄59岁,73.2%为男性,31.5%患有糖尿病,81.6%为不稳定性心绞痛。病变主要位于左前降支(54.1%),74.9%的病变被归类为ACC/AHA B2/C型 。
手术成功率: 器械成功率、病变成功率和临床成功率均极高,分别为100%、99.7%和99.3%,表明IBS具有良好的输送性和即刻手术性能 。
1年期临床结局(N=1061):
靶病变失败(TLF): 2.9%
心脏性死亡:0.0%
靶血管心肌梗死(TV-MI):1.1%
缺血驱动的靶病变血运重建(ID-TLR):2.6%
器械内血栓(确切/可能): 0.4%(4例患者)
这些数据,特别是0.0%的心脏性死亡率和仅0.4%的器械内血栓率,是极其重要的早期信号。
4.2 早期安全性与有效性的背景分析
将IBS的1年期数据与CoCr-EES的历史标杆数据进行比较,可以更好地理解其临床意义。例如,在里程碑式的PLATINUM试验中,CoCr-EES组的1年TLF率为2.9% 。IBS在千人级别队列中2.9%的TLF率,在数值上与CoCr-EES在其关键性试验中的表现完全相同,这提示在1年这个时间点,IBS的临床有效性至少不劣于金标准。
更重要的是安全性。0.4%的器械内血栓率是一个非常出色的结果,完全处于现代DES公认的安全范围内(通常<1%)。这一发现直接回应了困扰第一代BRS最核心的安全隐患。这表明,IBS通过其创新的工程设计(如超薄支架丝、可控降解等),可能已经成功克服了导致第一代BRS失败的“阿喀琉斯之踵”——早期器械内血栓。这一深刻的发现将关于IBS的讨论焦点从“它是否足够安全?”转向了“它能否兑现解放血管的长期益处?”。
表2:IBS基础性研究的关键结局汇总
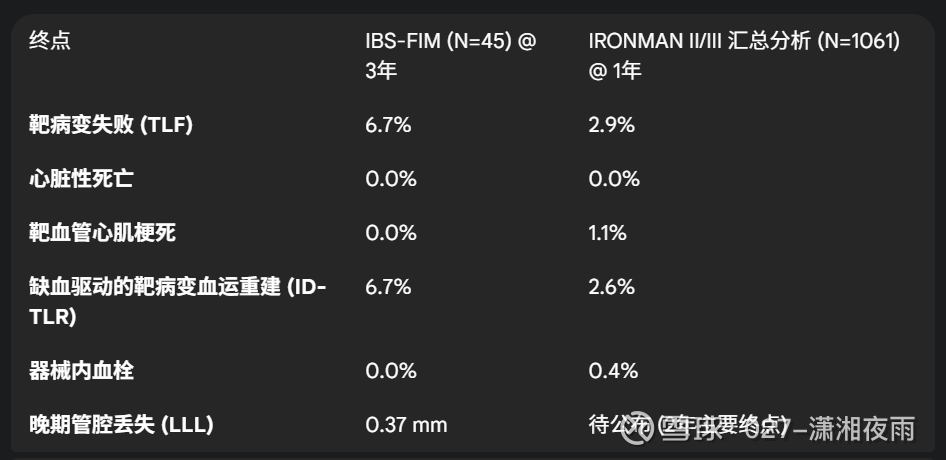
此表清晰地展示了IBS技术从小型首次人体研究到大规模队列的性能演变。数据的一致性,特别是持续的低不良事件率,增强了对其安全性和有效性的信心,并为预测IRONMAN-II的最终结果提供了坚实的基础。
第五部分 预测IRONMAN-II的2年期结果:基于证据的推演
5.1 对主要终点(节段内晚期管腔丢失)的预测
IRONMAN-II的主要终点是证明IBS在2年节段内LLL方面不劣于CoCr-EES 。
证据基础: IBS-FIM试验提供了最直接的证据。在该研究中,支架内LLL在6个月时为0.33 mm,并在3年时保持稳定在0.37 mm 。这种晚期未见显著增加的稳定性是预测其长期表现的关键。
预测: IBS将成功达到与CoCr-EES相比的非劣效性界值。预计IBS组的2年LLL将在0.30-0.40 mm之间。这一数值与现代DES的典型范围一致,也与FIM研究的结果相符。
5.2 对临床终点(TLF及其组分)的预测
标杆数据: 首先,需要为对照组建立一个可靠的性能预期。PLATINUM试验的5年期数据显示,CoCr-EES的TLF率为9.3% 。这是IBS需要面对的严峻挑战。
对IBS的预测: 基于1年期2.9%的TLF率,预计IBS组在2年时的TLF率将保持在较低水平,约为4.0-5.0%,并达到相对于CoCr-EES的非劣效性。
“追赶”现象的讨论: 一个核心问题是,IBS能否避免Absorb BVS在1至3年吸收期间观察到的不良事件“追赶”现象 。IBS-FIM研究中OCT观察到的快速且完全的内皮化(1年时100%覆盖)为此提供了强有力的机制性支持 。理论上,当支架丝在开始显著降解前已被健康的组织完全覆盖,晚期事件的风险应被大大降低。因此,有理由相信IBS将不会重蹈覆辙。
5.3 对器械内血栓的预测
证据基础: 1年期汇总分析的血栓率为0.4% ,而IBS-FIM研究的3年血栓率为0.0% 。超薄支架丝和快速的血管愈合是强大的保护因素。
预测: 到2年时,IBS的支架内血栓率将继续维持在极低水平,可能≤0.5%。在关键的吸收期内未出现晚期或极晚期血栓的信号,将是该试验最重要的安全性发现之一,也将使IBS与其聚合物前辈产生本质区别。
为了进行严谨的预测,首先需要明确对照组的预期表现。
表3:CoCr-EES的5年期标杆结局(源自PLATINUM试验)

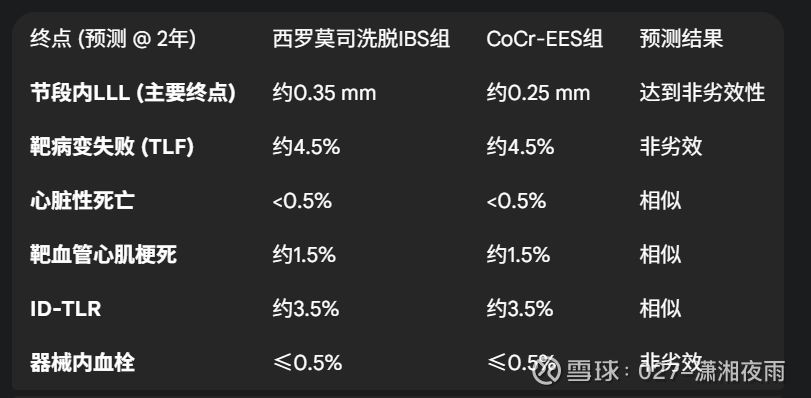
基于以上标杆数据和IBS已有的证据,可以对IRONMAN-II的2年期结果进行如下预测。
表4:IRONMAN-II试验的2年期结局预测
第六部分 最终评估:铁基生物可吸收支架的临床价值与未来轨迹
6.1 证据整合:BRS的新篇章?
综合所有现有数据,西罗莫司洗脱铁基生物可吸收支架(IBS)代表了真正的“第二代”BRS技术。它通过根本性的材料科学和工程设计创新,成功地解决了第一代聚合物支架在机械性能和降解特性上的核心缺陷。IBS实现了类似DES的即刻手术性能和优异的早期临床安全性(特别是极低的血栓率),同时保留了远期解放血管、恢复生理功能的理论优势。这使其成为一项极具潜力的颠覆性技术。
6.2 在导管室中的定位
假设IRONMAN-II的2年期结果如预测般理想,IBS将在临床实践中找到其独特的应用场景。
理想的患者/病变亚群: 年轻患者、长病变或弥漫性病变患者、重要大血管(如左前降支近段)病变患者,以及预期寿命较长、最能从避免永久金属植入物中获益的患者群体。此外,正如相关研究所提示,它在儿童先天性心脏病领域也可能具有特殊价值 。
优势场景: 血管恢复正常舒缩功能的能力,在对生理性血管反应要求较高的场合可能特别有益。更重要的是,它为患者保留了未来的治疗选择——无论是再次经皮介入还是外科手术,血管都将处于一个更“原始”和健康的状态。
6.3 尚存问题与未来之路
尽管前景光明,IBS要成为常规临床实践的标准选项,仍需回答一些关键问题。
需要长期(5-10年)数据: IRONMAN-II的2年数据将是里程碑,但BRS的最终承诺——即降低极晚期事件风险和完全恢复血管功能——只有通过更长时间的随访才能得到最终证实。
在复杂病变人群中的数据: IRONMAN项目目前主要聚焦于相对简单的病变。未来,该技术需要在更具挑战性的场景(如分叉病变、严重钙化病变、急性冠脉综合征)中进行检验,以明确其应用的边界。
结论
西罗莫司洗脱铁基生物可吸收支架(IBS)是迄今为止最有前途的BRS技术。它在设计上精准地规避了第一代产品的陷阱,并在早期临床研究中展现出与顶级金属DES相媲美的安全性和有效性。IRONMAN-II试验有望提供首个高质量的随机对照证据,来证实其在中期随访中的表现。如果结果积极,这将可能标志着介入心脏病学期待已久的“第四次革命”——一种临床可行的、安全有效的生物可吸收支架时代的真正到来。