2025 ASH | 传奇生物异体CAR-T (LUCAR-G39D) 一期数据解读

核心观点
2025 ASH 上公布的 LUCAR-G39D(靶向 CD20/CD19 双靶点同种异体 CAR-γδT 疗法,用于治疗成人复发或难治性 B 细胞非霍奇金淋巴瘤(NHL))一期临床数据,总体评判为:“安全性特征卓越,概念验证成功,持久性仍需长期随访数据的‘压力测试’。”
📊 临床数据概览

1. 安全性评价
关键数据锚点
0 Grade GvHD (移植物抗宿主病)
0 ICANS (神经毒性)
56.3% CRS (细胞因子释放综合征,全部缓解)
• 0 例 GvHD(移植物抗宿主病):这是最重要的数据!通常用别人的细胞治病,细胞会攻击病人的身体(排异)。这里发病率是 0。这归功于传奇生物使用了特殊的 γδ T(伽马-德尔塔 T)细胞,这种细胞天生“不认生”,不会攻击病人。
• 0 例 ICANS(未观察到神经毒性信号):在当前样本中未出现像手抖、失语、癫痫甚至脑水肿这样可怕的副作用。这意味着病人不需要进 ICU 抢救脑子,大大降低了医院的护理负担。
• 56.3% CRS(细胞因子释放综合征),全部缓解:CRS 就像是严重的流感发烧,是免疫系统在杀癌细胞的正常反应。只要能控制住(全部缓解),就是安全的。
思考:
🛡️ GvHD 的“天然屏障”验证
LUCAR-G39D 使用 γδ T 细胞,这种细胞天然不依赖 MHC 识别抗原。“0 例 GvHD” 不仅仅是一个好数字,它是对 γδ T 细胞平台天然安全属性的临床病理生理学验证。这意味着该疗法可能不需要极其严苛的基因编辑就能保证免疫安全性。

2. 疗效评价:早期信号积极,需理性看待 CR 率
关键数据
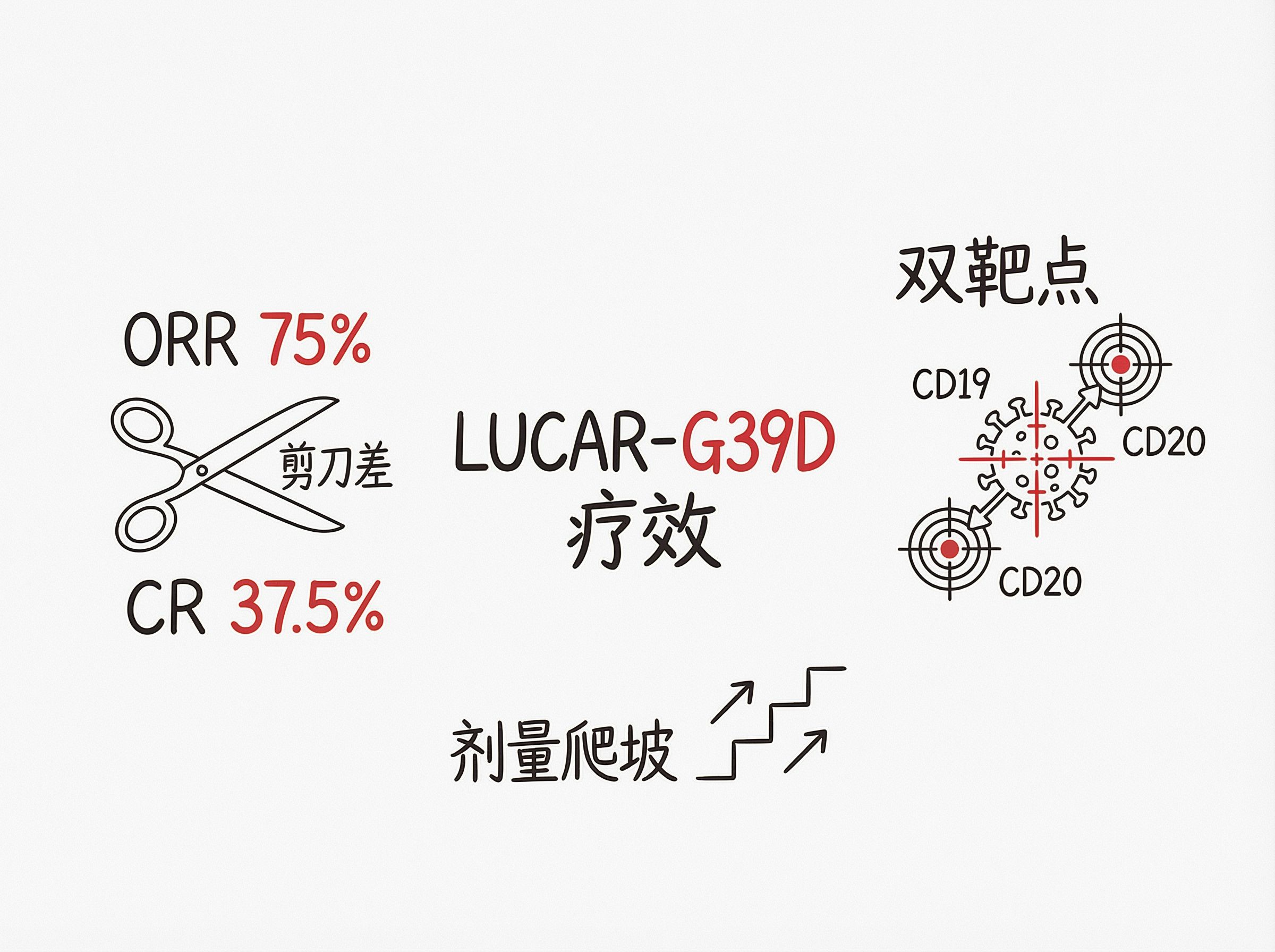
ORR (总缓解率): 75% (12/16)
CR (完全缓解率): 37.5% (6/16)
• 75% 的总缓解率 (ORR):在 16 个试过各种药都无效的难治淋巴瘤病人中,12 个人的肿瘤缩小了。考虑到这是 Phase 1(一期)试验,里面包含了低剂量组(试探剂量的),这个比例相当高。
• 37.5% 的完全缓解率 (CR):有 6 个人的肿瘤完全消失了。虽然比不上成熟的自体 CAR-T(通常能到 50%-60%),但对于现货型产品来说,这是一个非常令人鼓舞的起点。随着剂量优化(只看高剂量组的话),这个数字可能会更高。
思考
🎯 双靶点策略的有效性
CD19/CD20 双靶点设计是为了克服单一抗原丢失导致的复发。在多线治疗失败的患者中取得这样的数据,证明双靶点涵盖了更广泛的肿瘤克隆演化。
3. 持久性:展现出克服排斥的早期潜力
关键数据
83.3% (10/12) 的缓解患者在数据截止时仍维持缓解状态(中位随访 6.1 个月)。
83.3% 的人维持缓解:这是最大的惊喜。以前的通用型 CAR-T 有个通病叫“来得快去得快”,体内存活时间短。但这里,绝大多数起效的病人,在数据截止时疗效依然维持。这说明传奇生物的双靶点设计(CD19/CD20)旨在降低抗原逃逸风险,增加了治疗的稳健性。
这是数据中最令人意外的亮点。异体 CAR-T 通常面临宿主免疫排斥,导致疗效“昙花一现”。
83.3% 的维持率暗示传奇生物可能通过淋巴清扫方案或 γδ T 细胞本身的特性,在早期随访中一定程度上克服了宿主排斥。这是判断该管线能否成药的核心指标,但仍需更长期的随访数据来验证其真正的持久性。

4. 剂量与风险:正在爬坡
关键数据
DL4/DL5 严重不良事件 (SAE): 25% (4/16)
试验共分 5 个剂量等级。随着剂量加大,副作用开始出现是正常的。
一期试验的目的就是摸索出“药效最强且副作用可控”的剂量点。目前的 SAE 比例在可接受范围内,且没有死亡病例,说明安全窗口依然很宽。

⚠️ 风险提示 (Reality Check)
样本量 (Sample Size):n=16 在统计学上非常微小,结论属于“强信号”,而非“确证性证据”。
📝 总结
从临床科学角度看,LUCAR-G39D 的一期数据是一份“机制验证成功 (Mechanism Validated)”的成绩单。
它用临床数据证明了 γδ T 细胞 作为通用型载体的可行性(安全性),并展示了初步的抗肿瘤活性。对于传奇生物而言,这验证了其脱离 BCMA 单赛道、布局下一代通用型细胞治疗平台的研发能力。
这是一个极具潜力的 “First-in-Class” 苗子,但距离成为标准疗法 (Standard of Care),仍需更长周期的关键性研究数据支持。