天坛生物/长风破浪会有时,直挂云帆济沧海

不怕经历困难,排除万难,直到,挂云帆济沧海的那一天。
今天的业绩说明会,很多比较真诚的回复,管理层也真诚务实。很有看点。一个一个真心问,一个真诚答。![]()
![]()
1.
天坛生物上半年业绩一般,全面能完成年初预测的主营业务收入吗?下半年有何拉动业务收入举措?毛利率下降是血液制品价格下降造成。这是个长期趋势吗?公司有何举措改善毛利率水平?
回复, 2024年末,公司根据市场情况优化销售策略,调整了部分产品销售价格,2025年截至目前,产品价格维持稳定,与2024年全年相比,产品价格有所下降。2025年度,公司将采取多项措施,努力实现年度目标,一是提高终端市场占有率,增大销量,压降库存;二是进一步深化生产精细化管理,严格执行生产计划,确保血浆应投尽投,产品应交尽交。
2.
天坛生物国外血液制品注册。出口有专业团队吗?当前注册的品种和国家有哪些?今后公司对国际化发展有何考虑?
回复, 公司设立了国际合作部,有专业团队负责公司国际市场开发和注册准备工作,已经实现破伤风人免疫球蛋白、静注人免疫球蛋白(pH4)、乙型肝炎人免疫球蛋白、狂犬病人免疫球蛋白等产品出口。公司深度融入国家“一带一路”倡议,持续推进现阶段重点产品的国际认证和国际注册,深化国际化布局,打造具有全球影响力的血液制品企业。
3.云南血液制品智能工厂投产时间?云南血液制品公司投产后对天坛生物毛利率有拉动吗?主要产品有哪些?内需,出口占比公司是如何安排的?2026年业务收入多少?
回复, 云南项目已完成主要品种的注册现场核查和GMP符合性现场检查,现正在进行检查缺陷整改,目前申报品种的审评按注册进度开展。后续,公司将积极与政府部门沟通,努力加速天坛上海云南项目主要品种的生产场地转移相关工作,预计2026年投产。投产后将充分发挥产能优势,确保所属浆站增量血浆实现生产销售。云南项目主要生产人血白蛋白、静注人免疫球蛋白、人凝血酶原复合物等产品。
4.
天坛生物皮下注射用免疫球蛋白2026年上半年可以获得注册生产吗?距离规模化生产还有多久?毛利率多少?国内需求量多大?对公司吨浆利润拉动多少?
回复, “皮下注射人免疫球蛋白”已完成临床试验,于2024年12月递交上市许可申请,获得受理,并已于2025年6月获得药品GMP符合性检查告知书,待取得注册证书和最终生产许可后,可实现规模化生产。该产品蛋白浓度提高至20%,并采用氨基酸无糖配方,实现给药途径从静脉注射向皮下注射的转变,具有更有效、更舒适、更便捷、更经济的特点。该产品上市后,将为患者带来全新治疗选择。待产品获批上市后,公司将根据市场情况合理制定销售政策,持续加大市场学术推广力度,加快形成新的业绩增长点。
5.
天坛生物昆明重组凝血八因子何时才能投产?规模生产,市场竞争力如何?和国内其它竞争对手有何优势?
回复 , 公司昆明基地暂无重组凝血八因子。公司下属成都蓉生“注射用重组人凝血因子Ⅷ”生产场地变更及其关联变更事项已获得《药品补充申请批准通知书》,并于2025年8月接受GMP符合性检查,正在审评缺陷整改。公司实现“注射用重组人凝血因子Ⅷ”规模化生产后,单位生产成本将降低,同时通过加强市场营销力度,提升产品销量。
6.
公司去年溢价收购了中原瑞德,控股公司中国生物刚刚溢价收购了派林生物,说明公司非常看好血液制品这个行业。天坛生物作为血液制品中的优秀企业,对外收购,虽然做大了分母,但是分子未必能同步扩大,公司每股业绩未必同步得到增长,公司是否考虑做做减法,回购公司股份,相当于购买天坛生物这只优质公司的股权,在目前公司股价严重低迷的状况下回购,既能提高投资者信心,也能充分利用闲置资金,提高公司每股收益。
回复,公司控股子公司成都蓉生收购天坛瑞德100%股权,新增一家血液制品生产企业和5个在营单采血浆站,扩大业务规模,同时有助于湖北血浆资源的整合,具有重要战略意义。公司结合实际情况,通过加大现金分红力度、不断提高信息披露质量、加强投资者关系管理等方式,促进公司投资价值合理反映上市公司质量。
7.
公司存货大增是何原因?
回复,公司存货余额较2024年底基本保持稳定,公司存货增幅与行业相比处于合理水平。
8.
你好领导:血制品行业整体需求是紧缺的,但是行业各公司重复建设严重,比如莱士,天坛,旗下好几个生产基地和生产线,能不能打通各企业子公司的生产,流通环节,采浆分开,生产统一,销售统一。多余的牌照予以注销。希望向上面领导建言,我们是真的希望行业健康发展,像国外那样。
回复,公司组建了专业团队,正在对国家相关政策进行研究。推动分段生产需要协调国家药监局、各省药监局、税务局等相关部门,公司已着力开展相关工作,希望能够争取试点。
9.
您好领导,请问目前层析法高浓度静丙推广的难点在哪里。
回复,
第四代层析静丙10%采用国际领先层析纯化技术(辛酸沉淀+两步离子交换层析+亲和层析工艺),以及病毒灭活及去除技术(低pH孵放+20nm过滤),工艺升级达到国际领先水平。产品多项质量指标高于中国药典以及欧洲药典标准,高浓高纯,无糖等渗,各类不良反应(如过敏、溶血、血栓)的风险杂质含量均降低。
层析法高浓度静丙作为一个新产品,需要通过持续学术推广,使临床一线医生充分认识该产品的效能,以及对患者带来的帮助,特别是其对重症感染、原发性免疫缺陷等患者群体带来的临床获益,包括更快的症状改善、更低的不良反应发生率等价值。这个认知建立和临床应用的过程需要给予充分的时间周期,通过持续的学术教育和临床实践积累,逐步实现产品的临床价值转化和市场渗透。
10.
您好领导 请问贵公司10%层析法静丙提取率相对于传统第三代静丙成本提升多少,同时请问成本提升多少同比。
回复,公司层析静丙吨浆入库收率较普通静丙有所提升,目前正在持续优化生产工艺流程,力争进一步提升吨浆入库收率,压减单位生产成本。
11.
请问公司人血白蛋白、静丙和凝血产品的毛利率均较上年同期大幅下跌,原因是价格下跌还是成本上升呢?如果价格下跌,是由集采降价所致还是供需错配竞争激烈导致低价销售呢?如果成本有所上升,具体是哪些成本上升,单次付给献浆者的费用有增加吗?
回复,2025年上半年,血液制品市场发生了一些变化,受医保控费等政策影响,公司调整了部分产品销售价格,毛利率有所降低。公司始终重视成本管控工作,提升成本精益管理水平,明确成本压控重点,严格控制各类开支规模,各子公司单位产品生产成本较上年同期基本持平。
12.
你好领导:公司对全国血制品市场需求的看法如何,总体未来十年需求大概是多少吨血浆需求量,不考虑重组白蛋白的情况下。例外如果不考虑外资进口量,国内需求未来十年存在多少的血浆缺口,老龄化下采浆量只会越来越少了。如何应对。谢谢!
回复,目前国内人血白蛋白的需求量折合血浆约为36000吨到40000吨,随着中国老龄化加速,预计血液制品需求量将持续保持稳定并增长。公司持续保持与行业主管部门的沟通,积极推动下属浆站建设及执业申请相关工作。同时,公司将持续提升已执业浆站献血浆者服务水平、加强献血浆者招募和献血浆知识宣传,提升内部管理,优化激励机制,努力提升采浆量。
13.
您好领导,公司应收账款增加,主要是院外还是院内,账期是多少,烂账的概率有多大。什么时候能够扭转应收账款的局面。
回复,公司根据市场情况变化,对销售信用政策进行了调整,对战略级、重要级经销商给予一定的信用账期,一般为2个月。公司持续加强应收账款管理,风险可控。公司将根据市场情况持续优化调整销售信用政策。
14.
公司有哪些研发方向?重组凝血八因子何时投产?皮下注射免疫球蛋白何时投产?
回复,
1、公司持续完善研发管线布局,建立了涵盖血液制品和重组产品的研发管线,近年来,公司成都蓉生静注人免疫球蛋白(pH4)(10%、层析工艺)、注射用重组人凝血因子Ⅷ、人纤维蛋白、人凝血因子Ⅷ、人凝血酶原复合物、狂犬病人免疫球蛋白、天坛兰州人凝血酶原复合物等多个新产品获得上市注册批准。目前公司在研包含血液制品和基因重组产品十余个,其中:成都蓉生“皮下注射人免疫球蛋白”、“注射用重组人凝血因子Ⅶa”两个产品已完成Ⅲ期临床试验,递交上市许可申请,获得受理;成都蓉生“注射用重组人凝血因子Ⅷ-Fc融合蛋白”和“人凝血因子Ⅸ”、天坛贵州“人凝血酶原复合物”等产品处于临床试验中,进展顺利。探索性开展细胞治疗开发。
2、成都蓉生重组凝血因子已于2023年9月上市,目前重组凝血因子车间建设项目已完成竣工验收。成都蓉生重组凝血因子车间建设项目竣工验收后,根据《药品注册管理办法》、《药品生产监督管理办法》和《已上市生物制品药学变更研究技术指导原则(试行)》等法规要求,公司及时开展了注射用重组人凝血因子Ⅷ生产场地变更的相关研究工作,并报药品审评部门审批。现阶段本品生产场地变更及其关联变更事项已获得《药品补充申请批准通知书》,尚需通过药品GMP符合性检查、变更药品生产许可证后,可实现该产品生产规模的扩大。
3、“皮下注射人免疫球蛋白”已完成临床试验,于2024年12月递交上市许可申请,获得受理,并已于2025年6月获得药品GMP符合性检查告知书,待取得注册证书和最终生产许可后,可实现生产。该产品蛋白浓度提高至20%,并采用氨基酸无糖配方,实现给药途径从静脉注射向皮下注射的转变,具有更有效、更舒适、更便捷、更经济的特点。该产品上市后,将为患者带来全新治疗选择。
以上是回复的情况,
总结,云南投产2026年,新产品几个上市估计也要2026年,应收账款没有大问题,2个月账期,存货没有显著增加。价格下降告一段落,现在价格稳定。在研首次公开细胞治疗,血制品的需求,国内目前是血浆约为36000吨到40000吨,包括进口白蛋白,未来在老龄化下需求增加,浆源萎缩。价格不可能大幅下跌。公司成立专业团队推动分段生产试点。
关于分段式生产试点,
参考一下国外的情况

一.
杰特贝林
血浆采集
总共342个浆站 : 美国325个、欧洲12个、中国5个,(已被蓉生收购)
血浆分离中心
5个: 德国马尔堡工厂、瑞士伯尔尼工厂、美国坎卡基工厂、澳大利亚布罗德梅多斯工厂、中国湖北工厂(原中原瑞德公司)
血浆配送中心
2个: 印第安纳州配送中心、德克萨斯中心
储存中心
3个: 美国印第安纳州存储中心、瑞士伯尔尼存储中心、澳大利亚墨尔本存储中心
检测中心
2个, 美国诺克斯维尔检测中心、瑞士伯尔尼检测中心
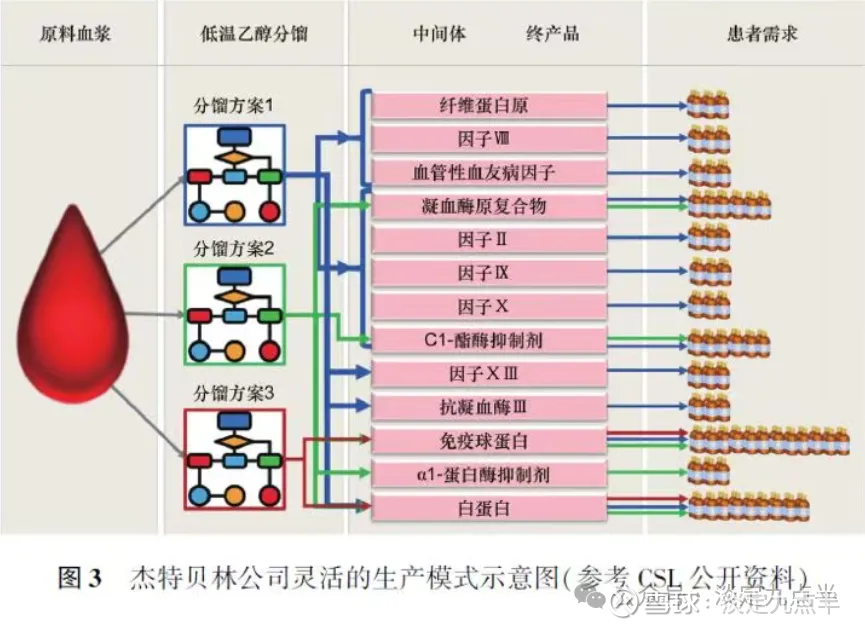
杰特贝林公司灵活的合作生产模式杰特贝林公司拥有全球最大的血浆采集网络CSLPlasma
截至 2022年,杰特贝林公司在美国、欧洲和中国运营342 个血浆采集中心,其中美国325个、欧洲12个、中国5个(收购中原瑞德公司)。
在美国采集的原料血浆将被送往杰特贝林公司经美国FDA 批准的2个配送存储中心储存或3个血浆分离工厂分离纯化。
配送存储中心负责血浆或中间体组分的配送和储存,其中印第安纳州的配送存储中心是美国最大的-40 ℃冷藏设施中心
杰特贝林公司的血液制品生产模式可以分为2步。
第1步从血浆开始,通过血浆分离技术将血浆分离为多种中间产品,如冷沉淀、组分Ⅱ+Ⅲ、组分V等。
第2步将血浆分离出的多种中间体作为起始原料,进行活性成分原液生产、灌装和包装,生产最终产品。
血浆分离中心生产中间产品有多种分离方案同一批血浆使用不同的分离方案产生的中间产品不同,中间产品的种类决定了最终产品的种类,通过灵活选用可替代的不同分离方案可以调整最终产品的产量(见图3)。
血浆分离出的中间产品作为纯化和批量生产最终产品的起始原料,中间产品可以来自不同的血浆分离中心,转移过程通过自建或行业通用的运输配送中心完成。
不同血浆分离中心生产的同一种中间产品,可以转移到任何一个获批的生产场地进行批量生产。
过程可以充分利用宝贵的血浆,根据患者对产品的需求量,灵活选择可替代的分离锕甕具娅站案蘀亠铡糈耽鍃販呇蕾眯较竽衞癆瑜姸足对高产量和低产量产品的需求。
二.
日本武田
血浆采集浆站
233个: 美国和欧洲(奥地利、捷克共和国和匈牙利)
血浆分离中心
6个: 美国卡温顿工厂、美国洛杉矶工厂比利时莱西纳工厂、奥地利维也纳工厂、意大利列蒂工厂、意大利比萨工厂
血浆配送中心
1个: 美国加利福尼亚州配送中心(收购于 Baxalta 公司)
储存中心
3个: 美国加利福尼亚州存储中心、奥地利维也纳存储中心(收购于Baxalta公司)、比利时莱西纳存储中心(在建)
检测中心
1个: 奥地利维也纳检测中心
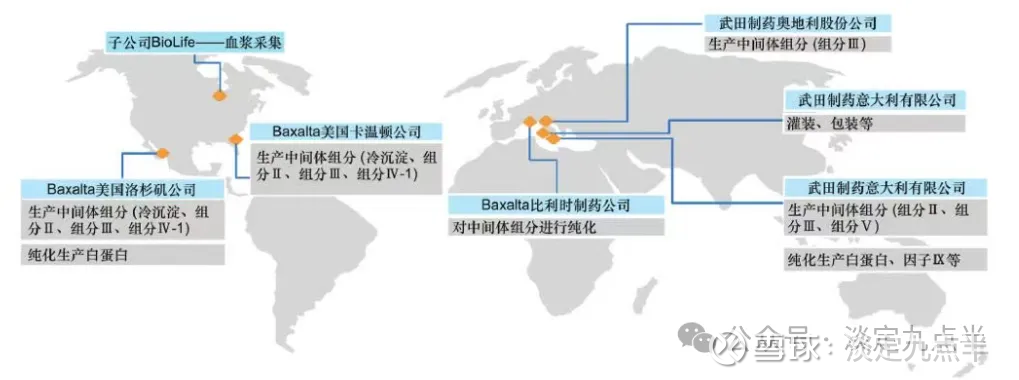
武田制药公司分工明确的合作生产模式武田制药公司设立专门的 BioLife Plasma Services 血浆服务公司,其作为武田制药公司的全球血浆捐献网络,
在美国和欧洲(奥地利、捷克共和国和牙利)运营233个血浆采集中心,拥有涵盖献血浆者到患者的整个血浆价值链的端到端能力,为武田制药公司提供血浆。
武田制药公司总部在日本东京,在全球有五大血液制品生产场地,其中美国2个场地、比利时1个场地、奥地利1个场地、意大利1个场地。
武田制药公司的生产模式采取血浆组分分离与血液制品生产可以分段的模式(见图4)
第1阶段是对采集的血浆进行低温乙醇沉淀、吸附和分离处理,获得中间产品组分,主要在百特洛杉矶工厂、意大利工厂、奥地利工厂、百特卡温顿工厂等完成。
第2阶段是将血浆中间产品组分作为原料,转移到进行下游加工的生产场地,下游处理包括对中间产品组分的纯化、装和包装等,主要在百特比利时工厂、美国卡温顿工厂完成。最后,终产品通过销售业务部门进行全球分销。
三,基立福
血浆采集
392 个: 美国、德国、奥地利、匈牙利,捷克共和国、加拿大和埃及等
血浆分离
4个:西班牙帕雷茨工厂、美国洛杉矶工厂、美国克莱顿工厂、加拿大蒙特利尔工厂
血浆配送
2个:美国田纳西州配送中心、新建美国田纳西州配送中心
血浆存储
3个:西班牙帕雷茨存储中心、美国洛杉矶存储中心、德国莱比锡存储中心
血浆检测
2个:美国奥斯汀检测中心、美国圣马科斯检测中心
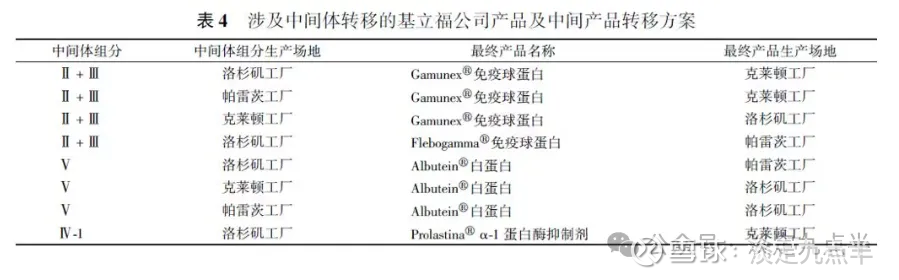
基立福公司中间体高效转移的合作生产模式基立福公司设置血浆采购业务部门,负责血浆采集相关的所有活动,包括献血浆者的评估和选以及血浆采集中心的运营,所有血浆都将用于生物制药部门后续生产。
基立福公司在美国、德国、奥地利、匈牙利、捷克共和国、加拿大和埃及等建立了392 个血浆采集中心
基立福公司通过获得美国FDA和欧洲EMA 批准的包含中间产品转移的血液制品许可证,提升了生产的灵活性,能够提高生产效率,同时更好地应对美国欧盟和其他国家或地区市场之间的需求变化(见表4)。
基立福公司的生产模式是将前端分离出的中间产品组分(如冷沉淀、组分亚+Ⅲ)根据实际生产需求灵活转移,后端分离出的中间产品组分(如组分I-1、组分V)集中转移到其他许可的场地生产。
通过这种中间体的灵活转移,可以使生产效率最大化,产品供应更灵活。
希望加快分段生产流程改革,提升企业运营效率,以及减少资源浪费,基础重复建设。
声明
以上皆是个人思想,学习和参考之用,不作为他人宣传和投资依据。
如有侵权联系删除。