【满纸荒唐言】福泰制药Nav1.8/Nav1.7简单总结
这个系列就当胡乱写的随笔,所以标题就不加洋文故弄玄虚了…
起手叠甲:本人并未做过研发,且并非神内/疼痛科大夫,为数不多跑过的胶甚至看不出结果;以下所有内容均为杜撰虚构,如有雷同,纯属巧合
最近$福泰制药(VRTX)$ 被VX-993 (Nav1.8) 伤的不轻,想着趁机深入学习下疼痛赛道;各位老师都是医药板块的常客,背景不做详细介绍了;如有错,请骂醒
本文只讨论vrtx的俩产品,不涉及其他公司,且没有投资建议…

止痛药的发展有两大核心路径:
第一条路径是阿片类:吗啡、可待因、芬太尼等通过作用于中枢神经系统的阿片受体,迅速抑制强烈的疼痛信号,是外科手术、癌症晚期等场景不可或缺的药物。问题是耐受性、依赖性、成瘾风险,甚至因过量导致呼吸抑制而死亡。
第二条路径是非甾体抗炎药(NSAIDs):阿司匹林、布洛芬、塞来昔布,通过抑制环氧化酶(COX),减少前列腺素合成,从而降低炎症和疼痛。问题是胃肠道出血、肾损伤、心血管风险,限制了长期大剂量使用。
这两类药物共同局限是:作用广泛,缺乏特异性;要么中枢成瘾,要么外周副作用显著。
能否绕开这两条途径,找到一种只精准作用于痛觉传导路径,而尽量不干扰其他生理功能的靶点,是科学家一直在思考的方向
临床及监管需求:
NOPAIN Act 于2025 年 1 月 1 日正式生效,要求Medicare对符合条件的非阿片类镇痛药物(如静注布洛芬等)提供单独报销,报销比例为药物平均销售价格的106%(即ASP+6%)。而符合法案要求的药物可通过CMS快速通道纳入Part D
纳入报销的药物需满足:1)机制明确:通过抑制痛觉信号传导而非作用于阿片受体发挥镇痛作用;2)临床证据:在随机对照试验或同行评审文献中证明可减少阿片类药物用量或替代其使用;3)安全可控:无显著成瘾性或严重不良反应(FDA guideline:至少跟踪12w)
实施范围:政策覆盖医院门诊和门诊手术中心,适用于术后镇痛、创伤性疼痛等急性疼痛场景,暂不包括住院患者或慢性疼痛
NOPAIN for Veterans Act 强制要求美国退伍军人事务部(VA)将FDA批准的所有非阿片类止痛药纳入标准化药品目录,禁止替换为阿片类药物,并全额覆盖药费。同时明确以减少退伍军人阿片类药物依赖为核心目标
FDA Opioid Policy Steering Committee (OPSC) 于17年5月成立,重点工作:1)减少阿片类物质暴露,预防成瘾;2)为阿片类物质使用相关障碍人群提供支持治疗;3)促进新型疼痛控制方法的开发;4)改进风险-获益评估措施基于此,如果梳理下FDA近十五年批准用于镇痛的几个药物:1)布比卡因脂质体注射液Exparel,现在已经是美国手术后镇痛的标准治疗,后面还有罗哌卡因脂质体注射液Anjeso,符合上述第3条原则;2)他喷他多片(防滥用)和口服液,μ受体激动+去甲肾上腺素再摄取抑制剂,从剂型上避免滥用,符合第1条;3)偏向性μ受体激动剂奥赛利定(TRV130),镇痛-不良反应分离的新机制,符合第3条
4)一些降低阿片类用量的阿片+非甾体或类似的复方制剂,如Seglentis,符合第1条;5)其他还有非阿片类制剂,如利多卡因贴剂和辣椒素贴剂用于PHN、局麻药+非甾体抗炎药用于术后镇痛的Zynrelef等,符合第3条(源:柳叶若江湖)不过现在FDA似乎在审评中从“疗效优先”转向“安全可控”,并更倾向将广义适应症拆解为多个微适应症逐个验证 (如suze的dpn, lsr, pnp), 那就是持续挤牙膏...总结:监管需求强,利好非阿片类药物研发及推广
Nav1.7/Nav1.8靶点机制:
先来点文绉绉的靶点机制介绍 (不感兴趣直接拉到总结部分):
电压门控钠(NaV)通道在痛觉反应过程中动作电位(AP)的产生和传播中起着关键作用,是镇痛的有效靶点。目前靶向钠通道的药物,由于缺乏钠通道家族不同亚型的选择性,尤其在中枢神经系统(CNS)和心脏系统中表现出较高的潜在风险,导致了治疗窗口很窄。因此开发具有良好亚型选择性的钠通道药物,具有极高的价值。
在目前已知的九种钠通道亚型中,Nav1.7,Nav1.8以及Nav1.9被认为主要在周边神经系统(PNS)尤其是伤害感受型的背根神经节(DRG)中特异性分布。
Nav1.7(SCN9A基因编码):
Nav1.7是阈值通道,调节动作电位的生成,在急性炎症性疼痛和遗传性疼痛障碍(如遗传性红斑性肢痛症,EM/ET)中起核心作用。它放大发生器电位,降低伤害感受器的激活阈值,导致超兴奋性和中枢敏化。
传统的非选择性钠通道阻滞剂(如利多卡因)或阿片类药物通过广谱抑制神经元兴奋性或作用于中枢阿片受体,但存在治疗窗窄、中枢副作用和成瘾风险。Nav1.7抑制剂旨在提供高选择性镇痛,避免这些缺点,但需克服亚型选择性问题。
在急性疼痛(如术后疼痛)中,Nav1.7上调导致C纤维和Aδ纤维阈值降低,加剧疼痛;但在慢性疼痛(如神经性疼痛)中,其作用受SUMO化修饰和PKC磷酸化等(别管是啥,反正对初步结论影响不大)修饰影响,并非所有疼痛状态都依赖Nav1.7。
Nav1.8(SCN10A基因编码):
Nav1.8主要在外周伤害性神经元表达,负责炎症性和神经性疼痛的信号传导。其特点是快速从失活中恢复,驱动重复放电和神经元超兴奋性,且不涉及CNS,因此无成瘾风险或运动功能障碍风险。
传统的阿片类药物(如吗啡)通过中枢μ-阿片受体(MOR)抑制疼痛,但易导致耐受性和成瘾,局部麻醉剂(如布比卡因)非选择性阻滞所有钠通道亚型,引起心血管和CNS毒性,而Nav1.8抑制剂选择性阻断外周疼痛信号,避免CNS副作用。
在急性疼痛(如内脏痛或术后痛)中,Nav1.8介导动作电位传播;在慢性疼痛(如糖尿病神经病变,DPN)中,其功能增益突变导致持续性超兴奋性。Nav1.8的快速恢复特性使其在重复放电中起关键作用,适合急性疼痛管理。
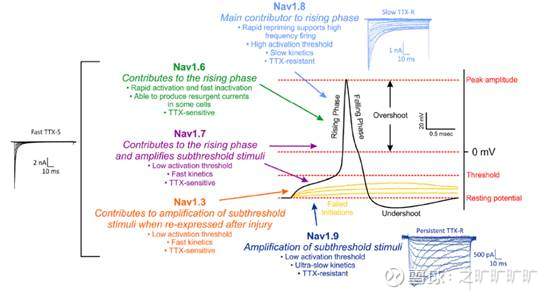
总结:1)因Nav在AP产生及传导过程的重要作用,开发靶向Nav的止痛药是必然趋势;2)对Nav不同亚型选择性很重要,以避免CNS及心脏等的脱靶毒性;3)故主要分布于PNS的Nav1.7/Nav1.8/Nav1.9成为首选又是自然而然的结果,尤其是只在PNS表达的Nav1.8;4)疼痛传播:Nav1.7点火,Nav1.8传播,Nav1.9放大
在研产品:
只能说依旧是CNS多壮士...
这篇先聊聊acute pain, 先吃7个,后面再煮7个
acute pain比chronic pain似乎更好做:前者是短期、伤害性的线性信号传导,Nav1.8等外周靶点高效,可快速阻断传导;而chronic pain机制复杂,涉及中枢敏化、多因子调制、神经可塑性改变,可能单一外周靶点不够,且chronic pain的临床试验常发现pbo应答率较高,故需要更大样本量和周期 (fda guideline是2+1)
standard of care不总结了,想必覆盖过恩华/人福/海思科的巴菲特、彼得林奇们应该都熟
以 Vertex Nav1.8 抑制剂开发为例:
VX-150: 2014年发布,第一代Nav1.8,磷酸前药结构,选择性提升400x,但p2后终止开发 (18年底公布结果;完成了Nav1.8 poc;不过临床用药量实在太高: HD 1500mg, then 750mg q12h,且还有安全性问题)
VX-128: 2018年p1终止开发 (因PK及安全性问题;with greater potency, but terminated due to tolerability issues)
VX-961: 2020年p1终止开发 (因PK及安全性问题;failed to meet Vertex’s desired pharmacokinetic and tolerability profile)
VX-548 (Journax/Suzetrigine): 第二代Nav1.8, 选择性超30,000x, acute pain批了,DPN (糖尿病周边神经病变, chronic pain) 两个p3在做 (26e),LSR (腰骶神经根病变, chronic pain) hold (25q2)
不过suze p2 day1 Tmax ~6h,活性代谢物Tmax ~12h, 对acute pain而言还能进一步迭代 (后面会说,p3数据似乎还可以);引用聿学说老师的推文,止痛中位时间34/60min,半衰期23.6h
VX-993:PO/IV formulation, 靶点选择性远超suze(Nav1.8 IC₅₀=0.05nM vs suze 0.68nM;需要注意的是,在pain这块,动物模型transfer到人体似乎很容易出错), 进p2前预期比suze更高potency, 且能使用更高剂量,但口服剂型acute pain p2 fail, 不过已经打到了nav1.8机制的剂量反应曲线顶部静注剂型仍在开发中 (acute pain, 26e);后续会考虑combo (Nav1.7跟Nav1.8临床前模型看到的是synergistic, 而非additive)
Suze跟VX-993临床具体拆开看:
Suze acute pain p3
虽然都已成功,也因此获批,从曲线看似乎也都还可以:
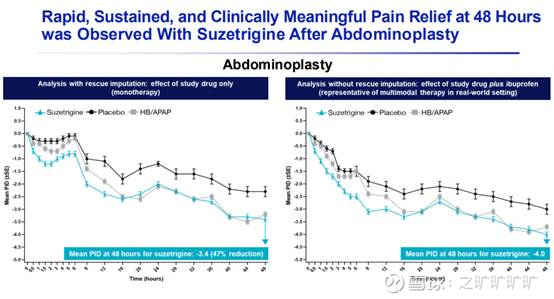
p3, Abdominoplasty (ABD, 腹壁整形术)
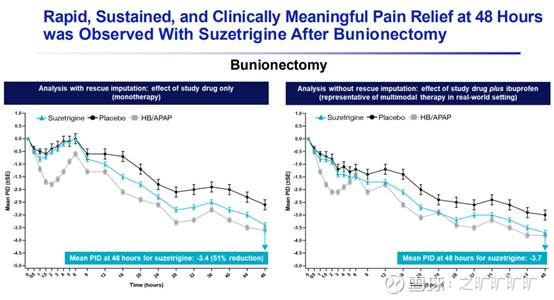
p3, Bunionectomy (BUN, 拇囊炎切除术)
具体看p3数据:ABD中,suze镇痛效果好于pbo,但跟hb/apap (氢可酮和对乙酰氨基酚,算是常见的直通组合,也是美剧豪斯医生常年嗑的药vicodin, 而氢可酮是阿片类药物)
差别不大 (不过该临床没设计suze vs hb/apap);但值得注意的是,suze起效速度更慢,起效时间更长,在术后6小时内的疗效并不比pbo更好….引用聿学说老师的推文:
“发表在British Journal of Anaesthesia, 2025,135,829—832上的一篇文章指出,这种镇痛作用的延迟可能与Nav1.8在初始损伤后的再分布有关。大量电压门控钠通道并不会直接转运至细胞膜,而是滞留在内质网中的,通过与特定相互作用蛋白或分子伴侣的结合形成“胞内池”。这种储存池可能让神经元能够快速响应刺激,使Nav1.8通道表面密度的提升速度远超从头合成所能达到的水平。这与临床前研究结果一致:针对Nav1.8的反义RNA在急性炎症动物模型(数小时)中无效,但在“慢性”疼痛模型中却有效。因此Suzetrigine在数小时后才显著起效可能是因为这种内质网滞留机制所导致”
spid48评分 (48小时内疼痛强度差异的时间加权总和评分, the higher, the better,一般
~30%改善算临床有效;临床中不常用,但fda用) vs pbo基本都在40-50分;另外,中位缓解时间为2h (?跟p2似乎又有点不一样)
BUN中,suze镇痛效果好于pbo,但弱于hb/apap, spid48评分vs pbo, suze ~29分, hb/apap ~50分 (临床没设计suze vs hb/apap);另外,中位缓解时间为4h
再回过去看p2:
ABD没问题,suze hd 100mg (first dose, followed by 50 mg q12h), md 60mg (first dose, follow by 30mg q12h), 俩cohort镇痛效果都比pbo好,且都比hb/apap要好,且hd>md而BUN出问题了,suze hd 100mg, md 60mg, ld 20mg, 结果来看,hd没问题,效果比pbo及hb/apap要好,ld效果比pbo要好,比hb/apap差,但md效果比pbo还差 (相当于比pbo, hb/apap, ld都差,剂量关系出问题了)
再回过来看p3:
ADB 100mg cohort p2跟p3效果差不多;而BUN 100mg cohort在p2赢了pbo及hb/apap,但在p3中只赢了pbo,且suze镇痛效果还缩水了 (不过还是要强调,临床没设计suze vs hb/apap),上面看曲线图也能看出来
简单放个BUN的图:
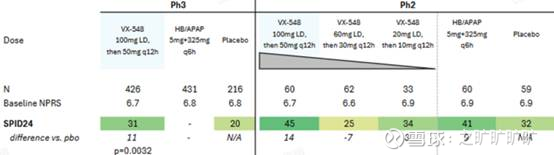
但无所谓,毕竟有NOPAIN Act,所以批了还有个问题,功能性终点达到了,但没能打过
hb/apap,是否影响患者主观使用感受,进而影响销售?
VX-993披露数据少很多,25q2公布的是BUN p2:
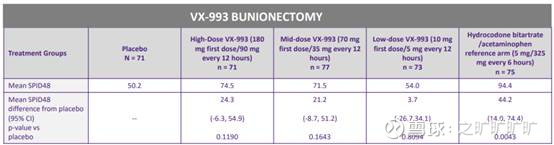
hd 180mg (suze p3 100mg), md 70mg, ld 10mg, 结果来看,三个cohort镇痛效果都比pbo好 (10mg也是),但都没打过hb/apap, 且hd跟md结果差不多 (24分vs 21分,但两个组vs pbo改善都在30%+;封顶效应?)
然而suze当时其实也是有plateau effect (图右,FDA画的):
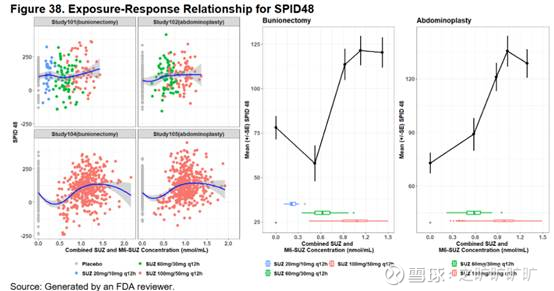
更搞笑的是,993几个cohort 95% CI下限都是负的...所以单看图结论很清晰:993有效果,但效果有封顶;打不过hb/apap
肩对肩的话,993这次BUN镇痛效果似乎比suze p3跟p2还要烂 (hb/aapa也是,但vs suze p2中的hb/apap,缩水没那么厉害...但再次,不同临床baseline不同)
但如果细看,993 p2为了最大限度提高疼痛严重程度,未采用腘窝阻滞 (popliteal fossa block, 主要用于膝关节以下手术麻醉或术后镇痛,BUN可以用,suze用了):

suze p3, Bunionectomy (BUN, 拇囊炎切除术)

VX-993 p3, Bunionectomy (BUN, 拇囊炎切除术)
结果就是 (没完全洗脱术中麻醉及镇痛药物影响),止过疼的后续疼痛是一个缓慢加剧的状态,而没止过疼的往往术后疼痛在术中镇痛药物效果消退后迅速加重
同时,腘窝阻滞在不同中心、不同研究者操作甚至不同受试者之间,所产生的效果可能均不一致 (所以suze p3跟p2数据波动? 几个临床总体感受,个体差异是真的大)
这波Wells Fargo技高一筹,押对了...
简单总结:1)acute pain suze镇痛效果好于pbo,但可能不优于hb/apap,2)suze剂量关系混乱,mid dose偏差;3)993虽然选择性远超suze,但镇痛效果并未体现出显著差异 (可能跟试验设计有关)
还有个疑问,993失败是否意味着nav1.8无法单独承担止痛主力,提前封顶?那注射剂型提高暴露能有效吗?
其他临床:
Nav1.8已fail或临床进行中的分子很多,但公开的信息并不多,如:1)Latigo Bio, SiteOne/LLY的Nav1.8正在p1, 没啥有价值的临床数据公开,不过值得说道说道的是Latigo在suze p3数据披露后两周,顶着利好完成了融资,而LTG-001公布的Tmax就1.5h,很快 (纸面上看比suze快,Latigo认为是自己分子设计更好)
2)PF-04531083 (2008年) 推到p2 (postoperative dental pain, 国内一哥的4800也是这个适应症,4800可能是vx-150 fast follower?),以及PF-06305591 (2013年) 推进到p1,但后期进展都不顺利,如1083是效果不行;Abbott A-803467 (2007年) pk问题,在临床前就被终止
总的来看,nav1.8 fail原因有:1)剂量和耐受性:高剂量导致副作用(如VX-150的头痛),限制临床应用;2)物种差异:人类和小鼠Nav1.8表达和失活曲线不同,临床前数据不直接转化(如pfe的1083);3)低选择性导致的脱靶毒性...4)现在可能要加一个plateau effect
而nav1.7进展更是寥寥,vs nav1.8,前者高选择性难做,因为Nav1.7与其他钠通道(如Nav1.4、Nav1.5)pore domain序列同源性80%+,尤其是关键残基(如DEKA滤器)完全一致,且Nav1.7与Nav1.1/1.2的电压传感域(VSD4)结构相似度>75%,易引发CNS副作用
不过nav1.7做chronic pain居多,已挂的分子比如PF-05089771,高选择性Nav1.7抑制剂 (1000x选择性,优于Nav1.5/Nav1.8),p1耐受性良好,然而p2做dpn的效果不佳 (可能因为9771需结合失活态通道,但慢性疼痛中神经元持续兴奋,失活态占比低),很复杂,我只能说很复杂...
后面找机会再聊聊chronic pain,又是两眼一抹黑的领域,机制更复杂...
Source:
1.疼痛靶点的生物学效应在新药研发中的体现,爱思益普
2.同一个靶点怎么会推 5 个化合物到临床去开发呢,振药说
3.痛还是不痛,这是个破问题——临床到底需要什么样的镇痛药,柳叶若江湖
4.疼痛、NaV1.8,以及止痛药,沉香没药
5.Suzetrigine(VX-548)在急性疼痛中的延迟镇痛效应,聿学说
6.公司资料,FDA等监管文件
由于篇幅问题,涉及到的论文不再一一列出