$中源协和(SH600645)$ 最近帮着朋友看项目,看到了一些干细胞、外泌体的项目。这些东西知道个大概,但确实不太理解其商业模式,有时候觉得这里面还有灰产的成分。反过头来,看看这家上市公司到底是在做什么:
(1)精准预防
在脐带血造血干细胞存储方面,目前,国家批准设置并获得执业验收的脐血库共7 家,分别是北京、天津、山东、上海、广东、四川、浙江,中源协和旗下的天津市脐带血造血干细胞库(许可证号:津卫血执字第 004 号)是首批经中华人民共和国卫生部批准设置并通过执业验收的造血干细胞库,下属子公司协和华东干细胞基因工程有限公司是浙江省脐带血造血干细胞库的运营单位之一。公司是国内最早运营脐带血造血干细胞库的上市公司,目前A 股上市公司拥有造血干细胞库牌照的仅有 2 家。$南京新百(SH600682)$
与此同时,公司着力打造包括新生儿脐带血造血干细胞、脐带间充质干细胞、胎盘亚全能干细胞以及成人免疫细胞、脂肪间充质干细胞、牙髓间充质干细胞在内的综合细胞库,目前建立了20 家综合细胞库;业务拓展从广覆盖向打造重点优势区域、重点人群转变,加强包括京津冀、长三角、长江经济带、成渝、海南等重点地区的建设。其中公司持续在长三角地区拓展细胞存储业务,子公司上海中源济生公司经过前期业务模式探索,已经形成“存储+保险”的生态协同。
(2)精准诊断
公司精准诊断板块业务涵盖体外诊断试剂、科研试剂及基因检测服务,其中以病理诊断为核心业务方向。病理诊断作为恶性肿瘤等重大疾病诊断的重要依据,在临床应用中具有关键地位。该领域技术门槛较高,国内市场长期由国际品牌主导,但国产企业正在加速实现替代突破,市场集中度逐步提升。 公司控股子公司中杉金桥公司作为精准诊断板块的重要业务主体,专注于病理诊断产品的自主研发与产业化,产品涵盖免疫组化抗体、染色试剂以及配套设备等多个细分领域。公司陆续推出了 Ultra 60 plus 与 Ultra 30N 系列全自动免疫组化染色设备,并实现与自研诊断试剂产品的集成应用,提升了整体产品的市场竞争力和客户粘性。随着设备装机量稳步提升和诊断试剂销售的协同增长,以及体外诊断试剂核心原料的自研开发及替代,在提升产品质量的同时降低产品成本,并实现了核心原料的自主可控,病理诊断业务已成为公司营收和利润的重要支撑。
从营收上讲,公司算是一个体外诊断试剂的公司,营业收入它还占大头:
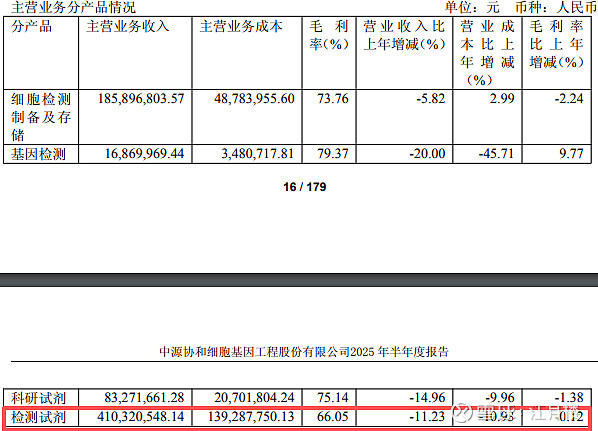
(3)细胞治疗
在细胞治疗板块,公司在干细胞和免疫细胞方面均有布局。 公司在干细胞药物申报方面不断取得突破,全资子公司武汉光谷药业自主研发的人脐带源间充质干/基质细胞注射液包括两款产品,即 VUM02 注射液(静脉输注)和VUM03 注射液(局部注射),截至目前已收到 9 个不同适应症 NMPA 核准签发的《药物临床试验批准通知书》:其中VUM02 注射液获批 8 个适应症,分别为:失代偿期肝硬化、特发性肺纤维化(IPF)、慢加急性(亚急性)肝衰竭、中、重度急性呼吸窘迫综合征、激素治疗失败的II 度至IV度急性移植物抗宿主病(aGvHD)、系统性硬化症、活动期中重度溃疡性结肠炎和临床分型为重型/危重型新型冠状病毒感染;其中治疗临床分型为重型/危重型新型冠状病毒感染获批II/III 期临床试验;治疗失代偿期肝硬化获批 Ib/II 期临床试验;VUM03 注射液获批 1 个适应症,为非活动性/轻度活动性克罗恩病复杂性肛瘘。另外,VUM02 注射液于 2025 年上半年新增适应症重型/危重型肺炎、肺炎后肺纤维化的临床试验申请,分别于 2025 年 6 月 23 日、2025 年 8 月 1 日取得《受理通知书》,目前正在技术审评中。在临床研究进展方面,治疗特发性肺纤维化(IPF)已完成I 期所有受试者给药,正开展临床安全性、有效性数据整理;其余适应症正在进行临床前准备、方案调整、研究者沟通和机构伦理审批等准备工作。此外,国际申报方面,VUM02 注射液治疗IPF 和aGvHD亦获得美国 FDA 授予的孤儿药资格认定。
公司参股的北京三有利公司与首都医科大学共同申报的“人牙髓间充质干细胞注射液”治疗慢性牙周炎于 2023 年 5 月获准开展 II 期临床试验,已于 2024 年完成全部受试者入组,正在开展定期随访工作。 根据 CDE 网站统计,近几年间充质干细胞申报药物的数量增长较快,涉及了自身免疫性疾病、呼吸系统、消化系统、骨关节病、神经系统等多种疾病,公司 MSC 药物获得药物临床试验批准的数量为国内第一。
在干细胞临床研究项目备案方面,公司及下属企业、参股公司 12 个卫健委/NMPA和中央军委后勤保障部干细胞临床研究项目完成备案。 国内免疫细胞治疗方面已经有 7 个 CAR-T 药物获批,公司参股的合源生物公司自主原研的源瑞达®(纳基奥仑赛注射液)于 2023 年 11 月正式获得 NMPA 批准上市,用于治疗成人复发或难治 B 细胞急性淋巴细胞白血病,该药物是我国首个定价低于百万的CAR-T 药物;2024 年9月,源瑞达®治疗复发或难治性大 B 细胞淋巴瘤新适应症的上市许可申请获正式受理;2024 年11月,源瑞达®获澳门特别行政区政府药物监督管理局批准上市。此外源瑞达®在自身免疫性疾病适应症治疗领域中已经获得 3 张 IND 批件,分别为针对系统性红斑狼疮相关的免疫性血小板减少症(SLE-ITP)、自身免疫性溶血性贫血(AIHA)和难治性狼疮肾炎(LN);用于治疗成人复发或难治 B 细胞急性淋巴细胞白血病患者获沙特食品药品监督管理局授予突破性治疗药物资格认定;用于治疗儿童复发或难治 B 细胞急性淋巴细胞白血病获 CDE 纳入突破性治疗品种药物。
留在这里备查。