第16项三期:默沙东启动TROP2 ADC卵巢癌临床试验
近日,根据UmabsDB数据库的记录,默沙东在clinical trials网站上,登记了来自$科伦博泰生物-B(06990)$ 的TROP2 ADC药物Sacituzumab Tirumotecan,维持联合或不联合贝伐珠单抗,与标准治疗贝伐珠单药对比,在接受一线铂类化疗后新诊断的 HRD 阴性晚期卵巢癌患者中,启动了一项3期临床试验TroFuse-021(NCT07318558),该临床预计于2026年2月启动,入组人数为900例,这也是Sacituzumab Tirumotecan在海外默沙东主导开展的第16项三期临床试验。

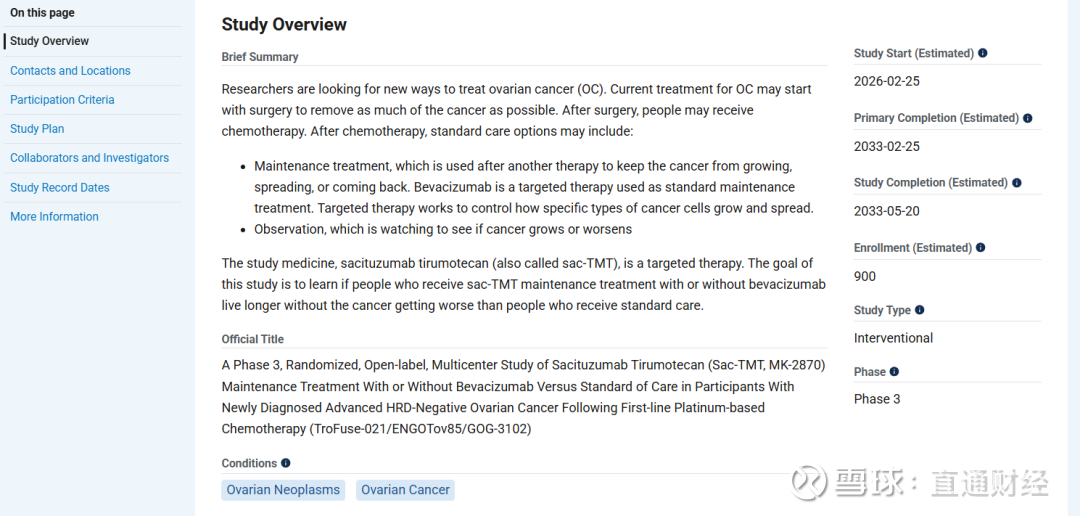
该三期临床的治疗组为Sacituzumab Tirumotecan,维持联合或不联合贝伐珠单抗,对照组为贝伐珠单药,主要临床终点为PFS。
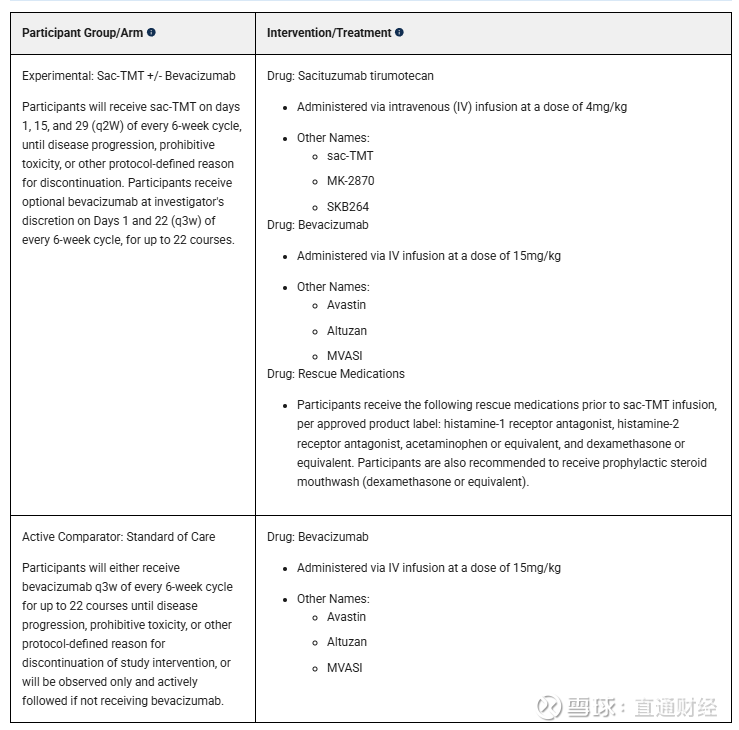
值得注意的是,这是Sacituzumab Tirumotecan在卵巢癌中开展的第二项三期临床试验,此前Trofuse-022探索铂类化疗敏感性二线双铂化疗失败后的三线患者。
Sacituzumab Tirumotecan(SKB264)是$科伦博泰生物-B(06990)$ 和默沙东合作开发的TROP-2 ADC药物,其采用了和吉利德Trodelvy类似的结构设计,均是pH依赖的裂解方式,但是连接子方面采用了优化的,不可逆的位点特异性甲磺酰基嘧啶-硫醇偶联,其半衰期显著高于前者。
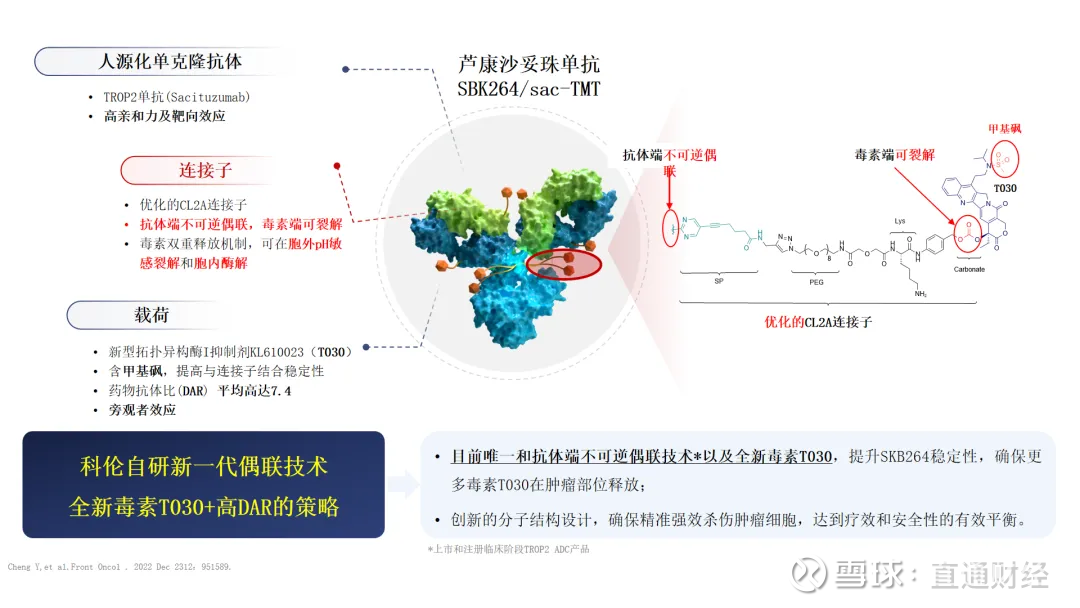
毒素方面其采用贝洛替康衍生物KL6100023,活性一定程度高于SN38,虽然第一三共采用了活性更高的依喜替康衍生物Deruxtecan,但是由于其采用更低的DAR4偶联率,后期临床并未显示充足的疗效,Sac-TMT(SKB264)可以说基于更平衡的结构设计,转化出更优的临床结果。
国内方面,Sacituzumab Tirumotecan目前已经获批用于三阴乳腺的二线治疗,和EGFR突变非小细胞肺癌二线和三线治疗三项适应症,多个关键三期临床同步开发中。

海外方面,科伦的全球合作伙伴默沙东目前围绕Sacituzumab Tirumotecan已经累计启动了16项全球三期临床,覆盖非小细胞肺癌、子宫内膜癌、乳腺癌、胃癌、宫颈癌、卵巢癌等多个瘤种。
Trofuse-004:既往接受过治疗的EGFR突变或其他突变晚期或转移性非鳞状非小细胞肺癌;
Trofuse-005:既往经含铂化疗及免疫治疗后的子宫内膜癌;
Trofuse-007:PD-L1高表达(TPS≥50%)转移性非小细胞肺癌;
Trofuse-009:EGFR突变、经EGFR-TKI治疗后进展的晚期非鳞状非小细胞肺癌;
Trofuse-010:不可手术切除的局部晚期或转移性HR+/HER2-乳腺癌;
Trofuse-012:辅助治疗既往经新辅助治疗术后未达到病理完全缓解的三阴乳腺癌;
Trofuse-015:晚期或转移性胃食管腺癌;
Trofuse-019:辅助治疗手术后未达到病理完全缓解的非小细胞肺癌;
Trofuse-020:复发性或转移性宫颈癌;
Trofuse-022:铂类化疗敏感性复发性卵巢癌;
Trofuse-023:转移性鳞状非小细胞肺癌。
Trofuse-011:一线或PD-L1 CPS小于10三阴乳腺癌。
Trofuse-033:错配修复完整的子宫内膜癌症。
2870-032:三阴性乳腺癌或HR低阳性/Her2阴性乳腺癌新辅助治疗。
Trofuse-003:联合PD-1抗体Keytruda用于一线宫颈癌治疗
Trofuse-021: 联合不联合贝伐珠单抗用于二线卵巢癌的治疗
2023年10月份以来,默沙东密集启动Sacituzumab Tirumotecan的16项单药或联用的全球三期临床,覆盖多个瘤种。正如默沙东在ESMO2023上所言,Sacituzumab Tirumotecan已经具有肿瘤领域的基石药物潜质,未来一方面将覆盖更广阔的癌种,另一方面将从后线向前线积极拓展。

期待该项临床早日传来临床捷报,更多有关抗体药物研发具体信息、专利及临床等动态进展,敬请关注Umabs DB全球数据库(网页链接)的更新。