Uniqure:AAV基因治疗领导者

01公司概况
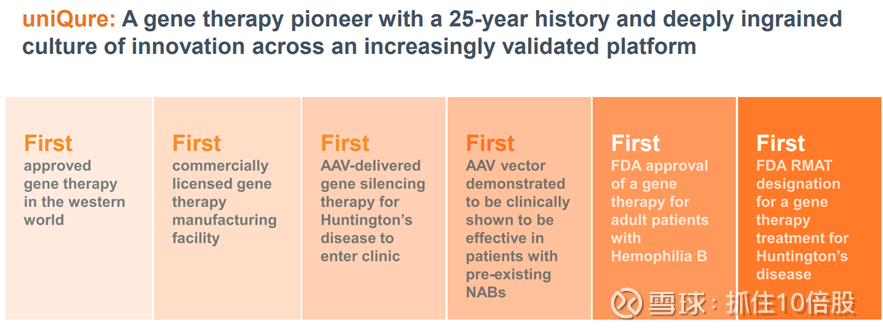
1998年:uniQure 成立,当时名为AmsterdamMolecularTherapeutics (AMT)Holding NV.
2008年:St. Jude在具有里程碑意义的首次人类血友病 B 临床试验中使用的许可野生型 FIX 基因盒
2012年:欧盟批准的西方世界首个基因疗法——Glybera

2014年:美国IPO,并在马萨诸塞州列克星敦建成符合 cGMP 标准的基因治疗生产设施。
2015年:启动了采用 AAV5/wtFIX 转基因的 AMT060 治疗 B 型血友病的 1-2 期临床试验
2017年:宣布在血友病 B 患者中转用携带Padua因子 IX 转基因的 AAV5 载体 AMT-061
2018年:启动了 AMT-061 的 2b 期剂量确认研究和 3 期 HOPE-B 关键研究。
2019年:启动了 AMT 130 治疗亨廷顿病的 1 - 2 期临床试验。
2020年:已完成 HOPE-B 三期关键性研究中 54 名患者的全部给药。宣布与 CSL Behring 达成许可协议,将商业化血友病 B 基因疗法。
2021年:在 HOPE-B 关键试验中公布了主要终点的顶线数据
2022年:美国食品药品监督管理局批准了全球首个用于治疗乙型血友病的基因疗法。
2023年:宣布了 AMT130 治疗亨廷顿病的 I/II 期临床试验的中期数据。美国食品药品监督管理局批准 AMT-260 用于治疗颞叶癫痫和 AMT-191 用于治疗法布雷病的研究性新药申请。
2024年:启动了针对法布里病的 AMT-191、针对 SOD1 型肌萎缩侧索硬化症的 AMT-162 以及针对颞叶癫痫的 AMT260 的临床试验。与美国食品药品监督管理局(FDA)就 AMT-130 在亨廷顿氏病治疗中的加速审批途径的关键要素达成一致。
02技术平台
1.一个专注于肝脏和中枢神经系统领域的行业领先平台
uniQure 构建了一个行业领先的基因治疗平台,专注于肝脏导向和中枢神经系统(CNS)疾病。
基因疗法为患有遗传性或获得性疾病的患者提供了长期治疗和潜在治愈的希望。研究显示,腺相关病毒(AAV)平台在单次给药后,能够恢复缺失蛋白质的表达或阻断基因的表达。
2.一个具有扩展潜力的模块化平台
uniQure 利用创新且模块化的技术平台开发其基因疗法,该平台采用专有的生产流程,具有扩展潜力。
该平台具有模块化的特点,即我们能够利用相同的组件(包括衣壳、启动子和生产方法)为多种疾病开发、制造和临床测试基因疗法。在很多情况下,只需更改针对特定疾病的基因盒,就能针对新的疾病进行治疗。公司认为,这将能够缩短开发治疗药物的时间、降低成本和风险,同时提供有效且便捷的替代疗法,以取代现有的标准治疗方案。
公司的基因治疗技术由三个关键要素组成:
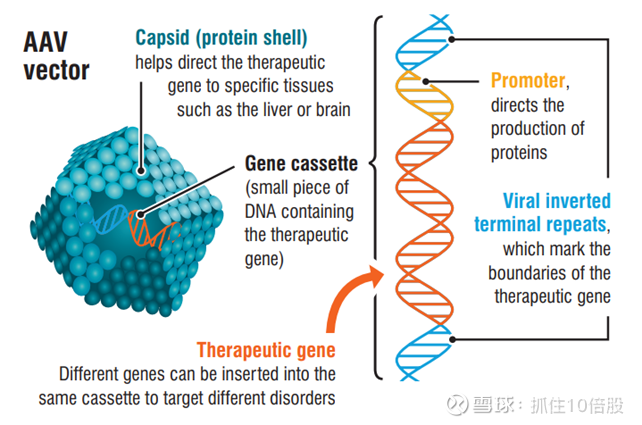
A.基于腺相关病毒的载体递送系统
一流的基于腺相关病毒(AAV)的载体递送系统
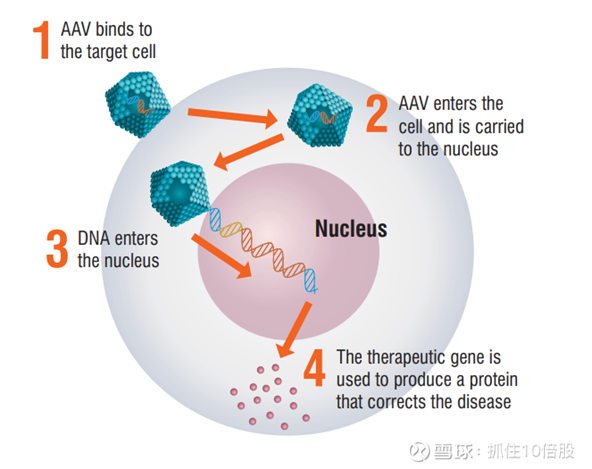
我们利用基于腺相关病毒(AAV)的工程化非复制型病毒载体递送系统将遗传物质递送至目标组织。研究人员已在临床前研究和一百多项临床试验中使用了基于 AAV 的载体,证明了其有效性和安全性。在临床前和临床研究中,AAV 还显示出单次给药后持续多年的持久治疗效果。
我们在治疗乙型血友病和亨廷顿舞蹈症的产品候选药物中使用 AAV5 型腺相关病毒(AAV),并且在全球范围内拥有将其用于向大脑或肝脏递送的治疗产品的独家权利。
AAV5 在许多临床试验中已被证明是安全且耐受性良好的,其中包括 uniQure 公司开展的五项试验,涉及超过 100 名患者。其中一些患者在 5 年多前就已接受给药,这表明其安全性和耐受性具有持久性。
基于腺相关病毒(AAV)的基因治疗面临的主要挑战之一是体内存在循环的抗 AAV 中和抗体,这些抗体源于对环境中天然存在的 AAV 的接触。这些中和抗体能够阻止 AAV 基因治疗的成功基因转移,并可能引发安全性问题。我们认为 AAV5 基因治疗能够克服这一局限性。我们的数据表明,AAV5 基因治疗有可能治疗几乎所有患者,无论其是否接触过 AAV5 或其他 AAV 血清型。
B.“基因盒”中的治疗基因
一种治疗性基因置于“基因盒”中,可提供缺失的蛋白质或沉默致病基因。我们利用专有的使能技术,包括强效的肝脏和大脑特异性启动子、微小 RNA 支架以及将转基因和生物制剂有效递送至肝脏和大脑的方法。
C.最先进的制造工艺
我们先进的制造工艺将基因治疗产品成功所需的所有关键要素整合在了一起。我们采用专有的生产流程制造基于腺相关病毒(AAV)的基因疗法,该流程使用昆虫细胞和杆状病毒(一种常见于无脊椎动物体内且无害的病毒家族),并运用了二十多年的基因疗法生产专业知识。
03研发管线
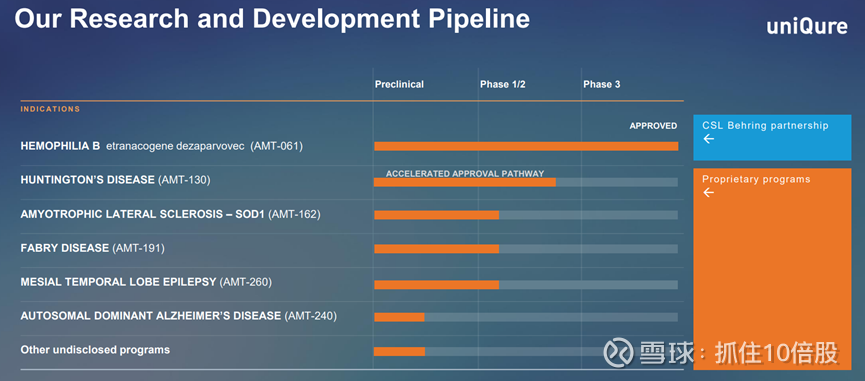
AMT-130:亨廷顿病潜在best- and first-in-class疗法
美国和欧盟区约有 7 万例确诊,还有数十万例处于高风险状态。AMT-130是一种由 AAV5 递送的实验性基因疗法,含有一种针对 HTT1a 的 miRNA。
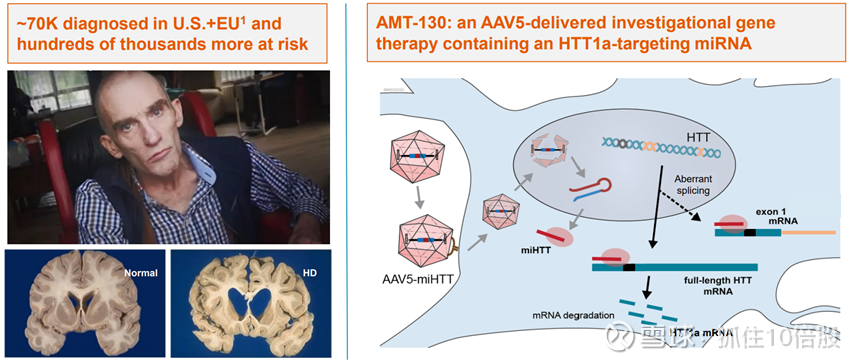
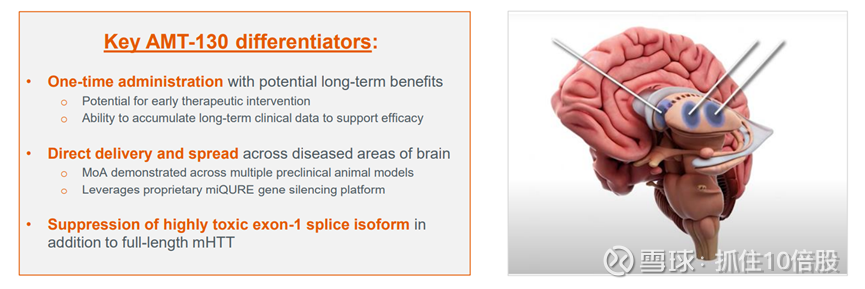
AMT-130 的关键差异点:单次给药,可能带来长期益处;早期治疗干预的潜力;能够积累长期临床数据以支持疗效;直接递送并扩散至大脑病变区域;在多个临床前动物模型中证明了作用机制;利用专有的 miQURE 基因沉默平台;除了全长的亨廷顿蛋白外,还能抑制毒性极高的外显子 1 剪接异构体。
2025年9月24日更新的I/II临床结果:
1.临床设计
主要终点为综合统一亨廷顿病评定量表(cUHDRS)。次要终点为总体功能能力(TFC)、 符号数字模式测试(SDMT)、 斯特鲁普词阅读测试(SWRT)、 总体运动评分(TMS)

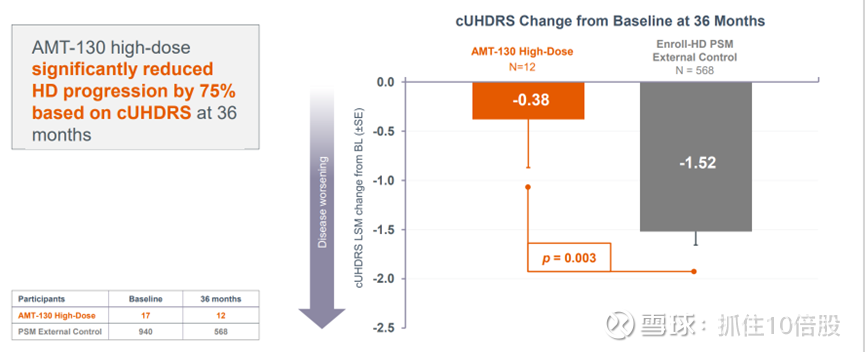
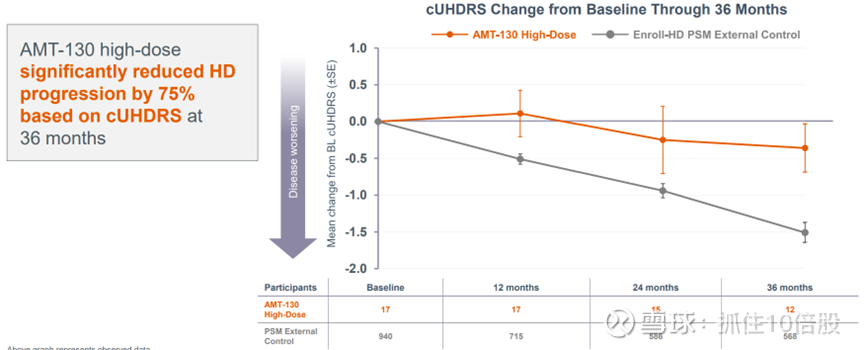
2. 研究在36个月时达到了 cUHDRS 的主要终点。
AMT-130 高剂量组在 36 个月时基于 cUHDRS 显著降低了亨廷顿舞蹈症的进展达 75%。
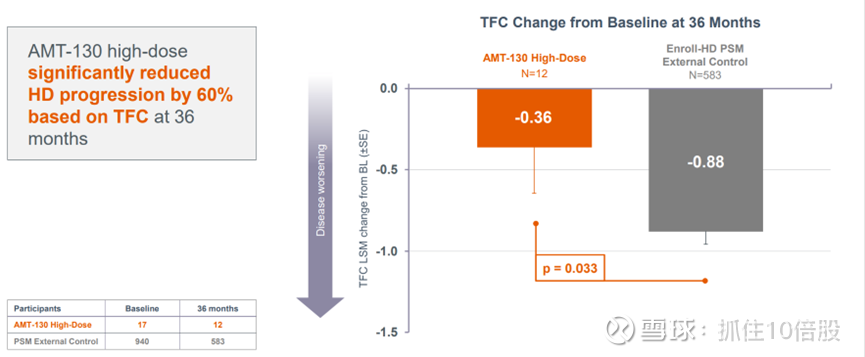
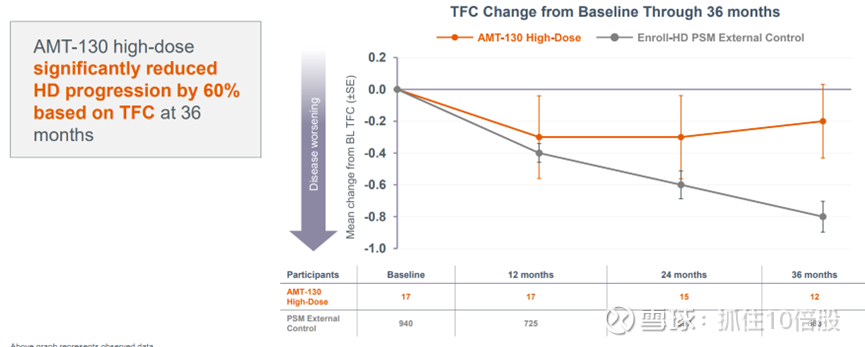
3. 研究在 36 个月时达到了关键次要终点 TFC
AMT-130 高剂量组在 36 个月时基于 TFC 显著降低了 60%的 HD 进展。
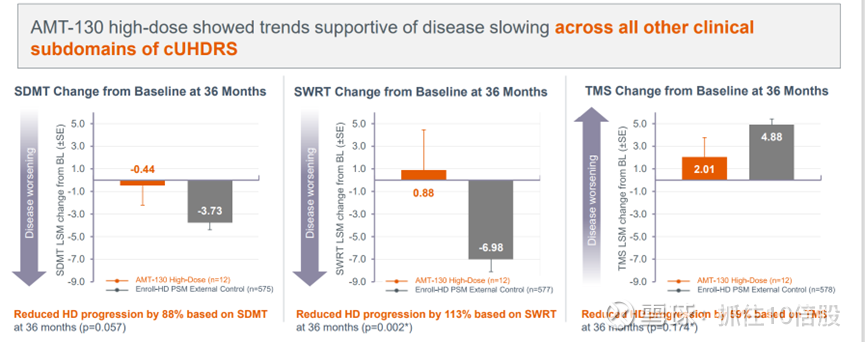
其他次要终点:高剂量 AMT-130 在其他关键临床亚领域显示出有利的趋势。
4.生物标志物显著改善
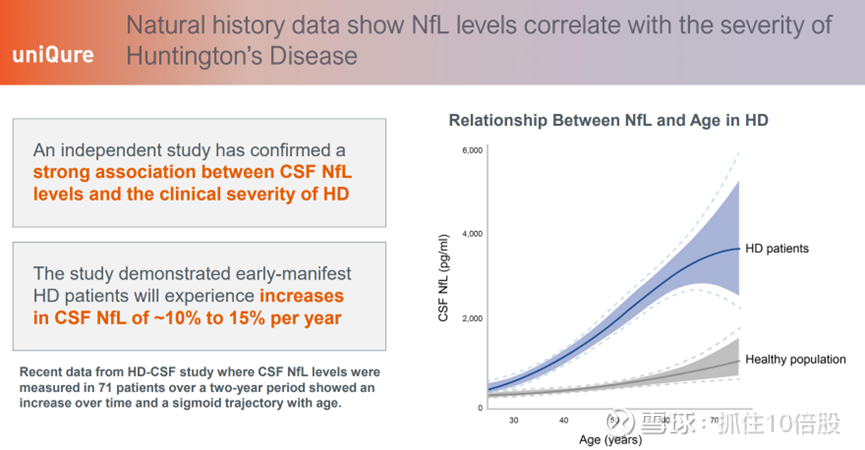
一项独立研究证实了脑脊液中神经丝轻链(CSF NfL)水平与亨廷顿舞蹈症(HD)临床严重程度之间存在很强的关联。该研究显示,早期显症的亨廷顿舞蹈症患者每年脑脊液中神经丝轻链水平将增加约 10% 至 15%。亨廷顿舞蹈症脑脊液研究(HD-CSF)近期数据表明,在两年期间对 71 名患者进行脑脊液中神经丝轻链水平测量,其水平随时间推移而上升,并且与年龄呈 S 形曲线关系。
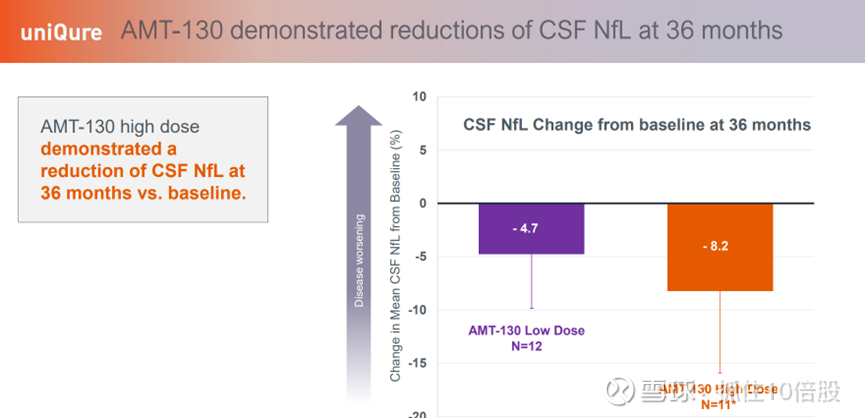
AMT-130 高剂量组在 36 个月时的脑脊液神经丝轻链(CSF NfL)水平较基线水平有所降低。
5.安全性
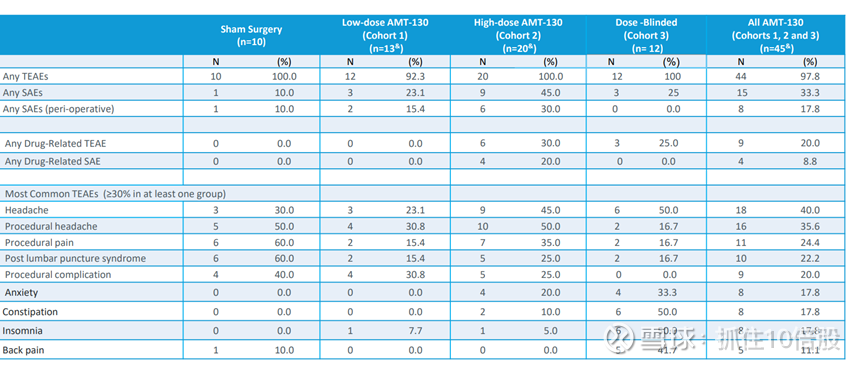
AMT-130 在两种剂量下总体耐受性良好,安全性可控。大多数与药物相关的严重不良事件发生在治疗后的最初几周内,并在使用类固醇或姑息治疗后完全缓解。自 2022 年 12 月以来,未观察到新的与药物相关的严重不良事件。
6.临床总结
基于 cUHDRS 的疾病进展显著减缓 75%,具有统计学意义;基于 TFC 的疾病进展显著减缓,具有统计学意义;在 cUHDRS 的所有其他临床子领域中均观察到疾病减缓的有利趋势;脑脊液 NfL 低于基线水平;敏感性分析的结果总体上与主要统计分析一致;总体上耐受性良好,安全性可控;未出现新的治疗相关严重不良事件。
AMT-260:难治性内侧颞叶癫痫(MTLE)
仍处于早期临床阶段。

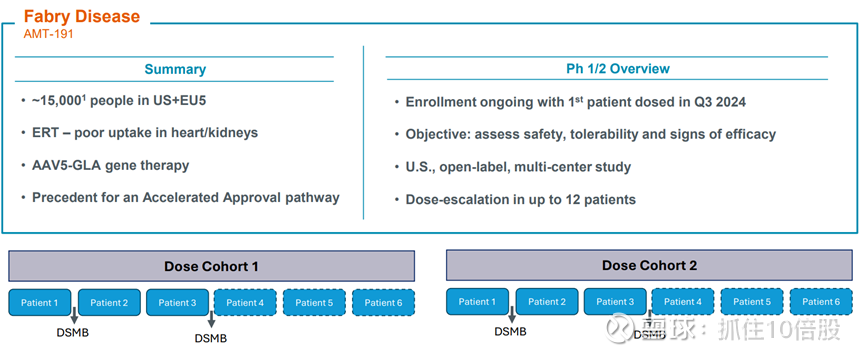
AMT-191:法布病
仍处于早期临床阶段。
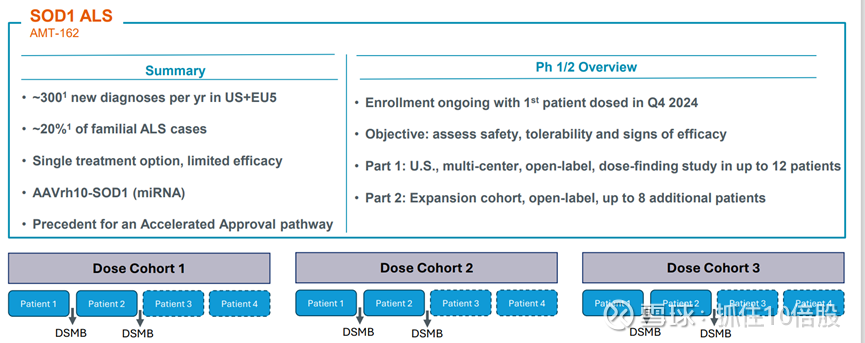
AMT-162:SOD1 型肌萎缩侧索硬化症(ALS)
仍处于早期临床阶段。
04 预期里程碑
亨廷顿病项目:
立即启动 BLA 准备工作,在 2025 年上半年与美国食品药品监督管理局(FDA)就主要统计计划和 CMC 要求达成一致。在 2025 年上半年提供 I/II 期临床试验更新,包括来自第 3 组的围手术期安全性数据,并在 2025 年年中提供 3 年随访结果。在 2025 年上半年与欧洲药品管理局(EMA)启动监管互动。提交 BLA 并为商业化做准备。
其他项目:
完成 MTLE、法布里病和 SOD1-ALS 的 I/II 期研究的全部入组工作。2025 年下半年公布法布里病研究的初步数据。2026 年上半年公布 MTLE 和 SOD1-ALS 研究的初步数据。