Praxis:Ulixacaltamide破局十亿美元原发性震颤市场
01公司简介
Praxis Precision Medicines(简称Praxis)是一家专注于中枢神经系统疾病的临床阶段生物制药公司,尤其在与神经元兴奋性失衡相关的癫痫治疗领域取得了显著进展。该公司通过将基因洞察转化为创新疗法,建立了多元化的研发管线。
2015年 公司于9月22日根据特拉华州法律成立。2023年初,其治疗原发性震颤的药物ulixacaltamide在一项关键研究中失败。同年11月,公司启动了该药物的两项后期临床试验。2025年2月。Ulixacaltamide 在“研究1”的中期分析中未达到预设终点,但公司决定继续进行研究。2025年5月公布研发与财务进展:宣布将在2025年年中启动两个针对发育性和癫痫性脑病(DEE)项目的关键研究。公布2025年第一季度财务业绩,现金储备为4.72亿美元,预计可支撑运营至2028年。
2025年10月。迎来重大成功:宣布ulixacaltamide 的两项后期临床试验均达到主要目标,计划在2026年初向美国FDA提交上市申请。受此利好消息影响,公司股价单日暴涨超过180%。
02技术平台
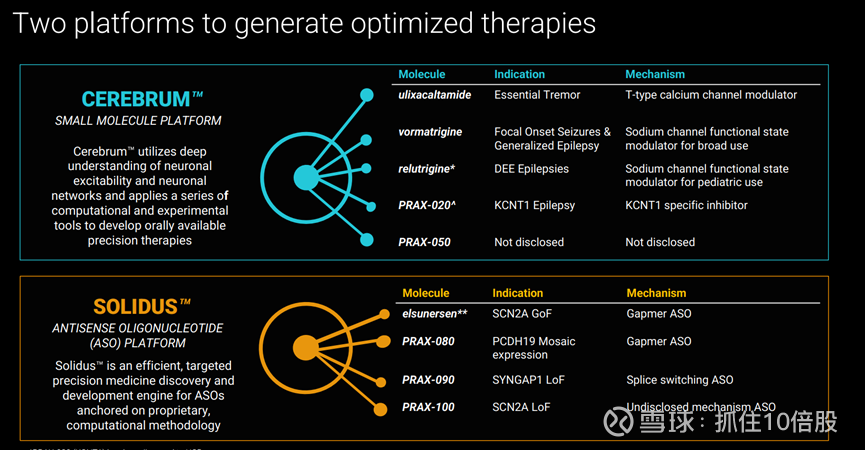
公司有两个技术平台,分别为小分子药物平台Cerebrum和小核酸ASO平台Solidus。
Cerebrum平台利用对神经元兴奋性和神经网络的深刻理解,并运用一系列计算和实验工具,开发出可口服的精准疗法。其代表性药物为ulixacaltamide,是一种T型钙离子通道调节剂。
Solidus 是一种高效的、针对反义寡核苷酸(ASO)的精准药物发现与开发引擎,基于专有的计算方法。
03研发管线
共有4个3期临床项目。聚焦癫痫(3个)和原发性震颤(1个)。

Praxis癫痫产品组合旨在满足常见及罕见癫痫领域中尚未得到充分满足的需求,并抓住市场机遇。
1. Vormatrigine(钠离子通道调节剂),普通癫痫350万患者,25亿+市场。
2. Relutrigine(钠离子通道调节剂),高发作负担的发育性癫痫20万患者,30亿市场
3. Elsunersen(间隔体ASO),遗传性典型发育性癫痫2000患者,5亿市场。

Vormatrigine(PRAX-628)
临床进展:
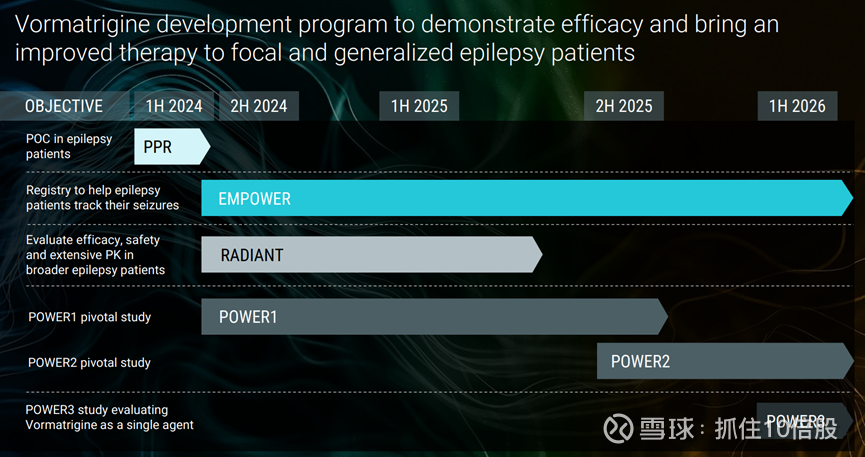
RADIANT是一项单臂、开放标签的Ⅱ期临床试验,旨在评估vormatrigine(PRAX-628)在局灶性或全面性癫痫患者中的安全性、耐受性和初步疗效。该试验患者每日接受30mg vormatrigine治疗,持续8周,此次公布的数据来自其中37名患者。
试验结果显示:癫痫发作频率较基线平均降低56.3%,接受vormatrigine治疗的患者表现出快速和持续的响应,治疗第八周,有60%的患者癫痫发作频率降低了50%。反应率达60%。
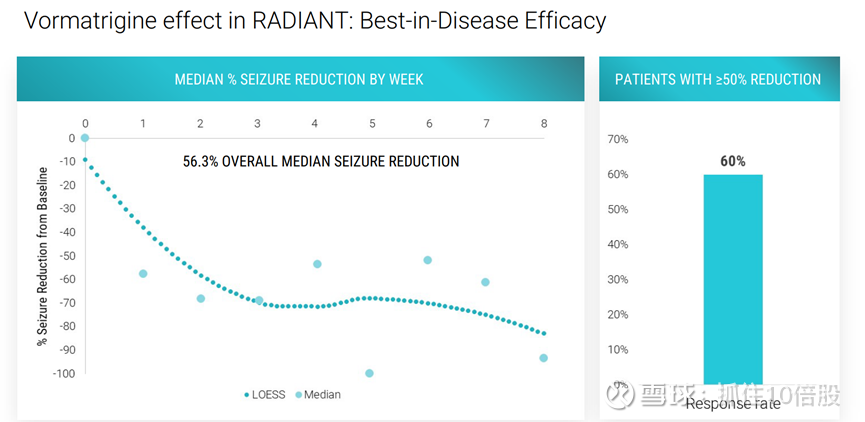
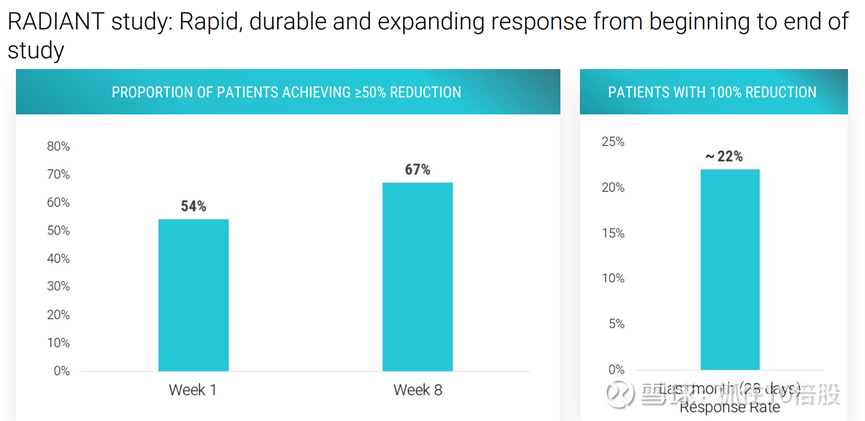
治疗第1周,有54%的患者的癫痫发作频率至少降低了50%,且响应程度随着时间延长而加深。治疗第8周,有67%的患者的癫痫发作频率至少降低了50%,
治疗最后1周,有22%的患者癫痫发作频率降低了100%,即完全无发作。
Praxis将该数据描述为“疾病最佳”。
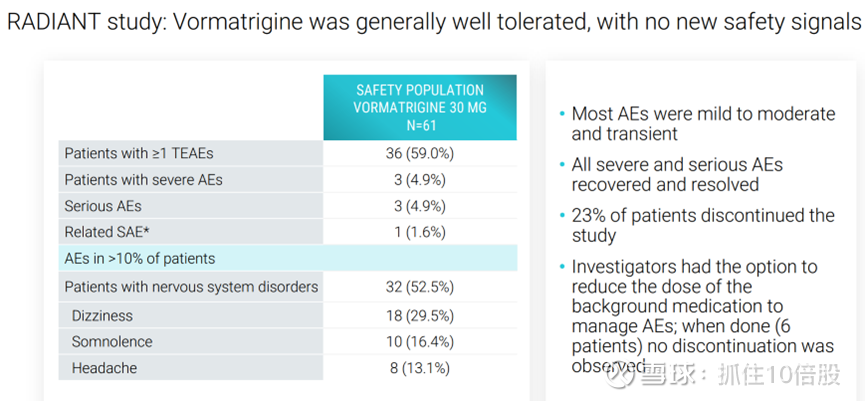
Vormatrigine的总体耐受性良好,继续显示出良好的安全性,报告的大多数不良事件是轻至中度和暂时的,所有严重不良事件均已恢复并得到解决。但是有23%的患者终止了研究。
关键的 POWER1 研究正在招募参与者,POWER2 研究将于 2025 年第三季度启动。

Relutrigine(PRAX-562)
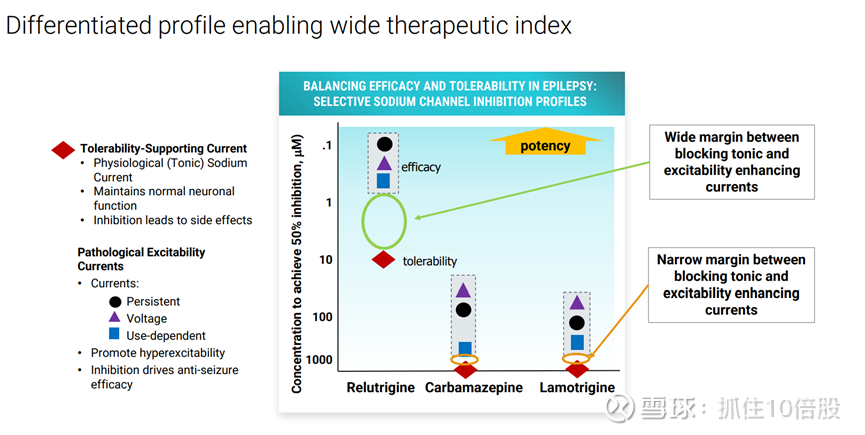
Relutrigine是一种具有口服活性的持久性钠通道抑制剂,主要用于癫痫治疗研究。其对Na离子通道具有极强的选择性。
已经获得针对 SCN1A(德拉韦综合征)、SCN2A DEE和 SCN8A DEE的三项罕见儿科药物认定。

Relutrigine相对于卡马西平和拉莫三嗪等传统抗癫痫药具有更宽的治疗指数。
临床结果:
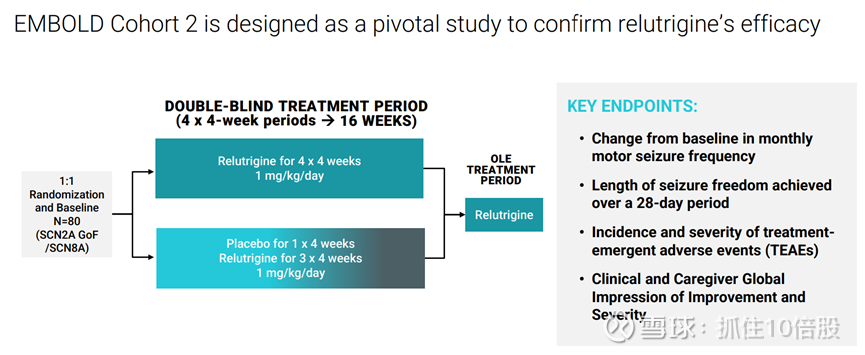
EMBOLD 队列 1 研究设计:针对接受标准抗癫痫药物治疗患者的难治性癫痫发作负担的对照试验
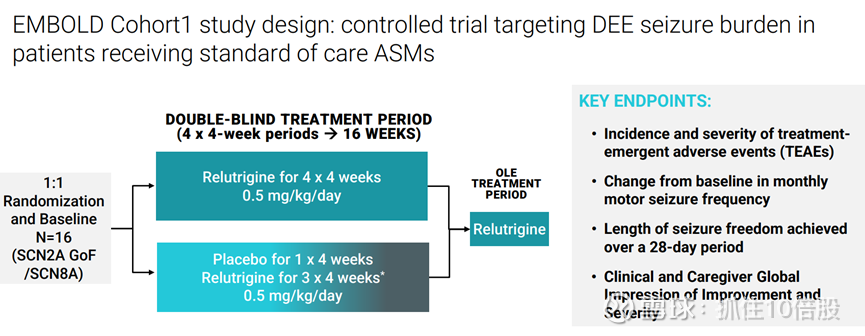
在标准治疗基础上持续用药可使癫痫发作持续减少。
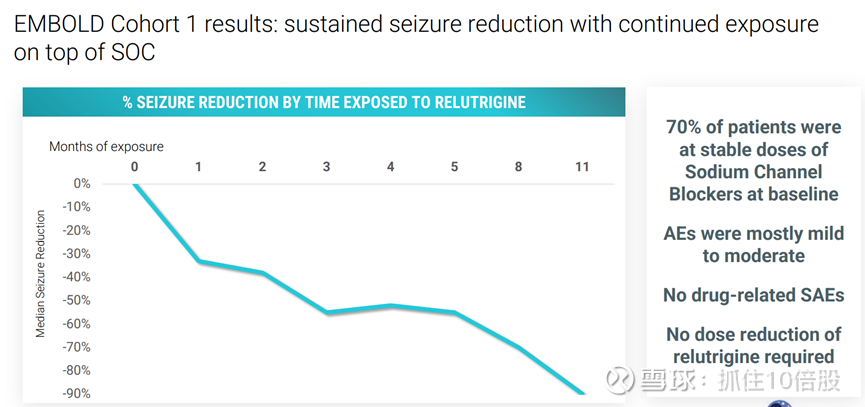
持续无发作期反映了临床和日常生活方面的改善
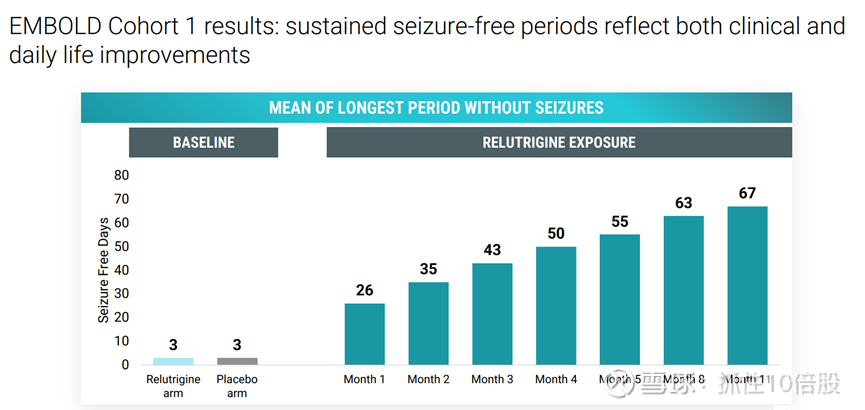
目前关键临床仍在推进中,计划于2026年上半年公布关键性研究结果并提交新药申请(NDA)。
Elsunersen
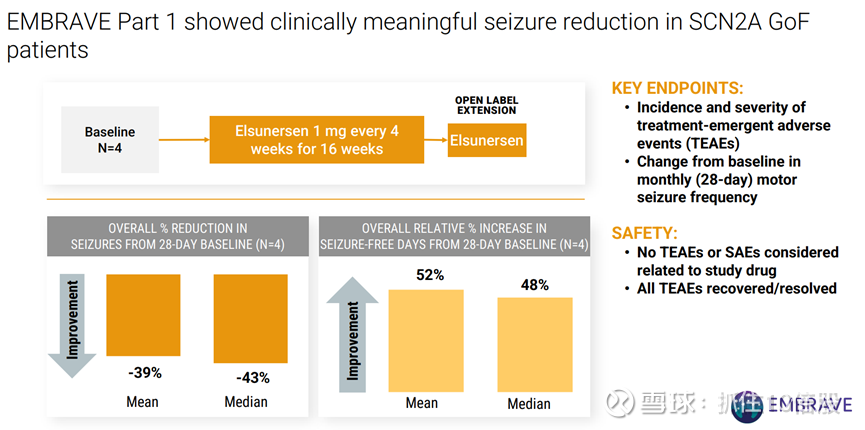
Elsunersen是首个针对 SCN2A 基因显性致病突变所致发育性癫痫性脑病(DEE)设计的药物。旨在选择性降低 SCN2A 基因表达。在 SCN2A 功能获得性患者中显著减少癫痫发作。未出现与研究相关的治疗新发或严重不良事件。获得美国食品药品监督管理局(FDA)的孤儿药认定(ODD)和罕见儿科疾病(RPD)认定,以及欧洲药品管理局(EMA)的孤儿药认定(ODD)和优先药物(PRIME)认定。

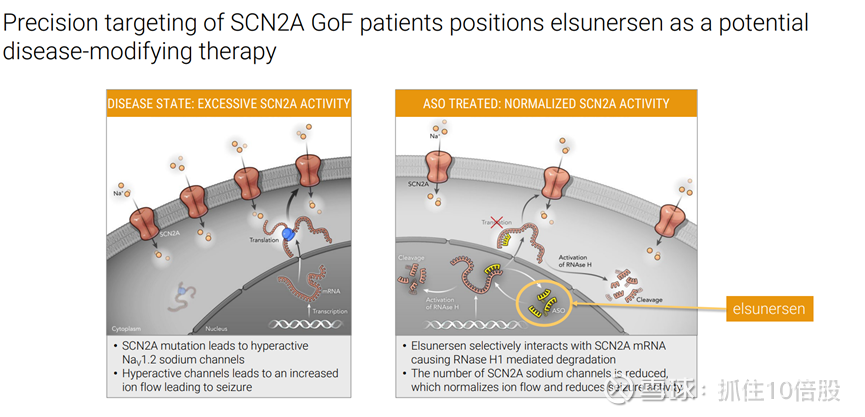
精准定位 SCN2A 基因增效型患者的治疗,使Elsunersen有望成为一种潜在的疾病修正疗法
SCN2A 基因突变会导致 Nav1.2 钠通道过度活跃。过度活跃的通道会导致离子流增加,从而引发癫痫发作。
Elsunersen选择性地与 SCN2A mRNA 相互作用,导致 RNase H1 介导的降解。SCN2A 钠通道的数量减少,这使离子流恢复正常,并降低了癫痫发作的活动
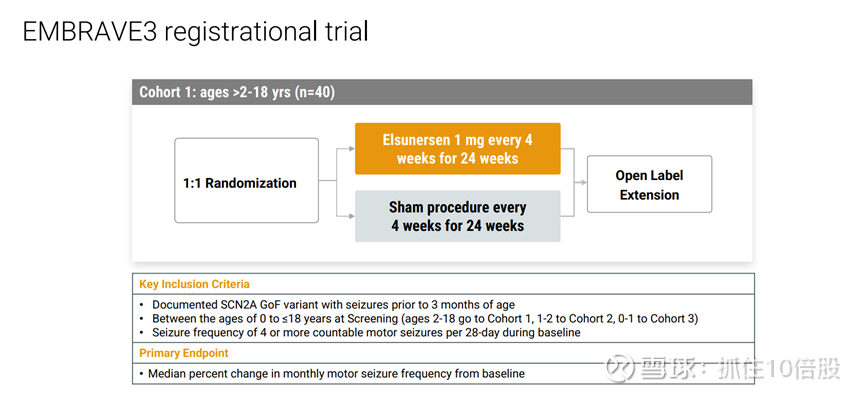
临床进展:
正在启动注册性临床。
Ulixacaltamide
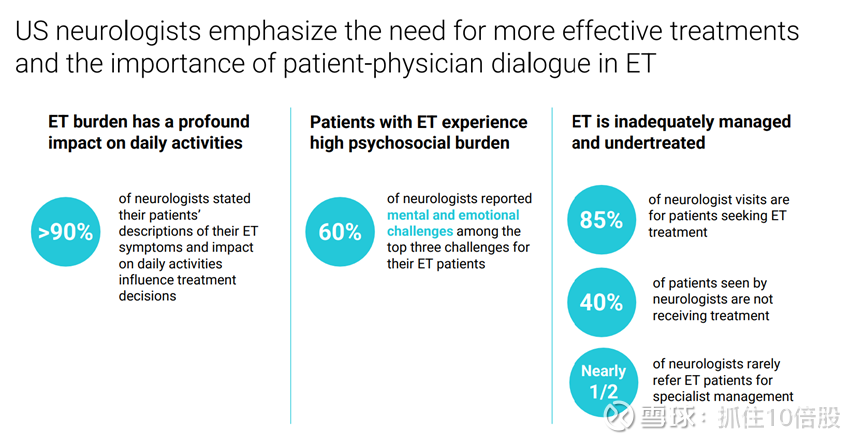
原发性震颤是最常见的运动障碍,仅在美国就影响约 700 万人,代表着数十亿美元的商业机会。原发性震颤的特征是上肢出现不自主的节律性震颤,有时还伴有头部、声带或腿部的震颤。这些震颤严重干扰日常生活,且具有进行性特点,随着病情的发展,震颤的严重程度和幅度通常会增加。普萘洛尔是一种β受体阻滞剂,是目前唯一获批用于治疗原发性震颤的药物,但疗效有限且耐受性差,对于患有原发性震颤的患者中相当一部分存在的合并症也是禁忌。其他β受体阻滞剂和抗惊厥药也常被用于治疗,但同样存在疗效有限和耐受性差的问题。绝大多数患者没有治疗选择,估计至少有 200 万患者寻求治疗。在一项患者调查中,多达 77% 的患者认为其原发性震颤控制不佳,多达 50% 的患者未接受治疗。事实上,接受调查的美国神经科医生表示,他们接诊的患者中有 85% 是为了寻求治疗,而 40% 的患者并未接受任何治疗。这些发现凸显了对特发性震颤(ET)更有效治疗方法的需求。

美国神经学家强调需要更有效的治疗方法,并指出在特发性震颤(ET)的治疗中,医患沟通的重要性。
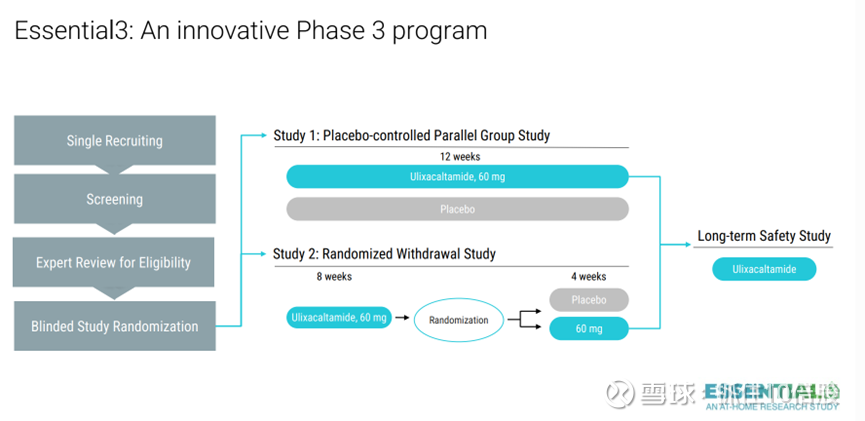
Essential3 第 3 阶段计划(NCT06087276)包含两项在美国同时开展的采用分散式设计的研究,参与者以 2:1 的比例进行盲法随机分配(研究 1:研究 2)。
研究 1 是一项双盲、平行设计、安慰剂对照研究,共纳入 473 名患者,按 1:1 比例随机分配接受乌利司他或安慰剂治疗 12 周。主要终点是第 8 周时简易日常生活活动能力量表(mADL11)评分相对于基线的变化。
研究 2 是一项稳定应答者随机撤药研究,共纳入 238 名患者接受ulixacaltamide 8 周治疗。在简易日常生活活动能力量表(mADL11)评分较基线改善 3 分的患者中,随机分配接受安慰剂或继续接受ulixacaltamide治疗 4 周。主要终点评估了维持应答的ulixacaltamide组与安慰剂组患者比例。
在研究 1 和研究 2 中,还有两个预先设定的假设,使用第 8 周时 mADL11 的变化来评估各组的组合情况。假设 3 比较了研究 1 和研究 2 中的ulixacaltamide组与研究 1 中的安慰剂组,假设 4 比较了研究 2 中的ulixacaltamide组与研究 1 中的安慰剂组。
在研究 1 和研究 2 中,关键的次要终点评估了疾病改善率(mADL11 变化的斜率)、患者总体印象改善量表(PGI-C)和临床总体印象严重程度量表(CGI-S)。
临床结果:
研究 1:安慰剂对照平行组研究总体疗效结果
在研究 1 中,第 8 周时简易日常生活活动能力量表(mADL11)评分平均提高了 4.3 分,具有统计学意义和临床意义(p<0.0001)。从第 2 周开始,这种效果一直持续到 12 周的给药期结束。所有关键次要终点均达到统计学显著水平。
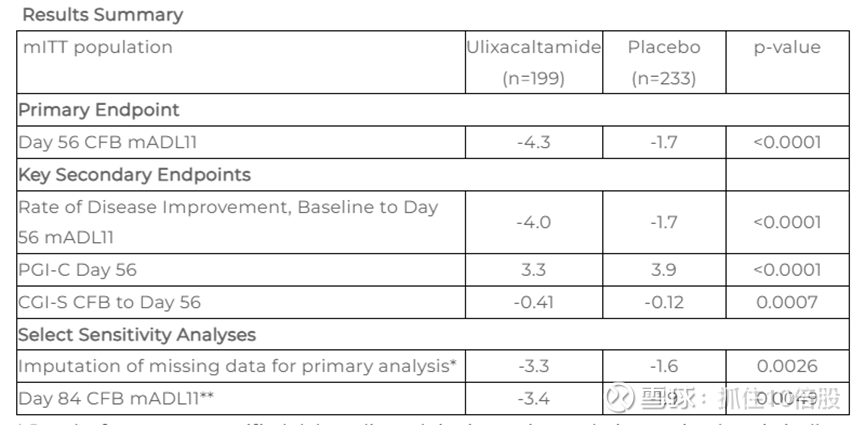
研究 2:ulixacaltamide随机撤药研究的初步疗效结果
在研究 2 中,患者接受为期 8 周的ulixacaltamide盲法治疗后,符合应答标准的患者(n = 80)被随机分配继续接受ulixacaltamide治疗或改用安慰剂治疗 4 周。ulixacaltamide组 55% 的患者维持应答,而安慰剂组为 33%(p = 0.0369,OR = 2.7,CI(1.06 - 6.92))。首要关键次要终点——疾病改善率——达到了统计学意义,其他次要终点(PGI-C、CGI-S)在数值上有利于ulixacaltamide,但未达到统计学意义。

综合研究 1 和研究 2 的假设
假设 3 和假设 4 进一步证实了ulixacaltamide与安慰剂相比的效果的精确性。
对于假设 3,联合研究 1 和 2 的ulixacaltamide组在第 8 周时的 mADL11 评分比研究 1 的安慰剂组提高了 4.3 分(p<0.0001)。
对于假设 4,研究 2 的ulixacaltamide组在第 8 周时的 mADL11 评分比研究 1 的安慰剂组提高了 4.2 分(p<0.0001)。
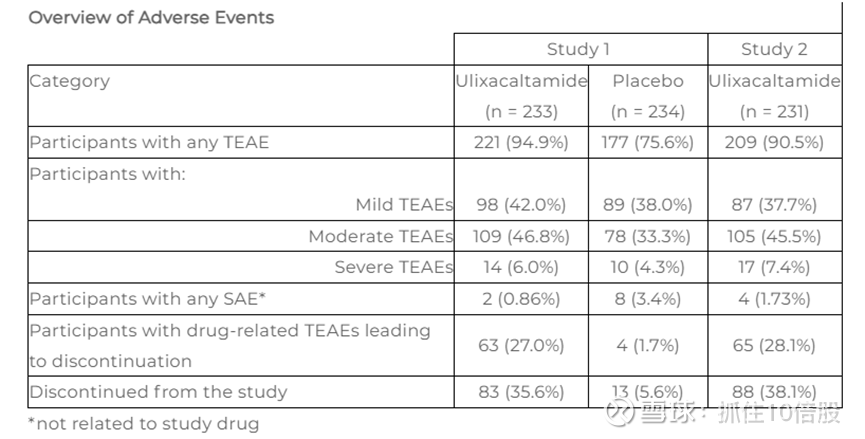
安全性
在为期 12 周的治疗期间,ulixacaltamide总体耐受性良好。最常见的(≥10% 患者)治疗期间出现的不良事件(TEAE)为便秘、头晕、欣快感、头脑不清醒、头痛、感觉异常和失眠。没有死亡病例,也没有与药物相关的严重不良事件。停药主要由于 TEAE,其中最常见的为头晕和头脑不清醒。