Protagonist therapeutics: 口服环肽技术如何颠覆生物制药

01公司简介
Protagonist是一家临床阶段的生物医药公司,专注于“基于多肽的新化学实体”的发现与开发。它的目标是利用其专有平台—设计和优化“结构受限(structurally constrained)”的多肽—将传统小分子与抗体/大分子生物药的优点结合起来,同时尽量克服传统多肽(和蛋白)药物存在的局限性(如稳定性、体内代谢、给药方式、选择性/特异性等)。Protagonist的总部在美国,但研发起源与其澳大利亚(Brisbane)的实验室也密切相关。
02技术平台
Protagonist的多肽药物设计平台由多种工具和方法组成—通过“de novo多肽生成+化学/结构/药理优化+给药方式考量”—具体包括:
技术/模块
功能/目的
大型虚拟库+结构受限骨架,合称Vectrix™
为多样化靶标(包括传统难以用小分子或抗体靶向者)—通过计算机匹配目标(结构/功能)与合适起点,从而“de novo”地选择天然或设计骨架作为候选。
随机/结构基础的多肽库+噬菌体展示
用于“发现”和“优化”多肽—可以是完全de novo,也可以是聚焦优化。
化学/结构/药理多肽化学
对初步hit/lead进行优化—包括增强亲和力、选择性、改善溶解性、代谢稳定性、可制备性等。
给药形式和给药途径优化
目标不仅限于传统注射,还包括口服、局部给药、以及其它给药形式—以满足不同疾病/患者需求。
体外/体内稳定性&吸收(ADME)评估
通过invitro、exvivo以及invivo模型,评估多肽在生物体内(或模拟环境)的稳定性、降解可能性、吸收与分布—这对于实现口服多肽至关重要。
通过上述结合—计算/药化/给药/ADME—Protagonist的平台可以“从零开始”发现并优化多肽分子,并使它们既具有小分子药物的便利性,也兼具大分子/生物药(抗体/蛋白)的高选择性/大分子交互能力。
适用靶标&疾病领域—为什么这个平台价值高?
Protagonist的平台设计原则,使其能够瞄准“传统小分子难以干预/抗体/生物药优劣兼顾但存在局限/传统蛋白药物不理想”的广泛靶点/疾病,如:细胞因子/其受体,整合素,转膜溶质转运蛋白,G-蛋白偶联受体,离子通道等等。
因此其适用疾病领域也很广,包括:
血液病/铁代谢/红细胞疾病,炎症/免疫调节疾病
为什么Protagonist的多肽平台对医药/生物医药领域具有意义?
兼顾小分子的优势(口服、成本、制造)与大分子/抗体的优势(高选择性、高靶向性、高亲和力)。多肽作为介于小分子与蛋白/抗体之间的“中间路径”—设计得当的时候,有望结合两者优点。Protagonist的结构受限多肽正是为此而生。
扩展“难以用经典小分子/抗体处理”的靶标/适应症。很多疾病/靶点(GPCR、离子通道、转运蛋白等)对于传统药物设计来说存在挑战—但多肽(尤其是结构优化后的多肽)能更灵活、更具结构/功能适应性。
给药方式多样—不局限于注射。通过化学修饰+稳定性优化+给药/配方开发,有可能实现口服多肽—这是过去生物/多肽药物领域长期以来的“圣杯”之一。Protagonist的平台正瞄准这一方向。
适应多种疾病领域—从罕见血液病到常见代谢/炎症/免疫病—提高治疗覆盖面与患者获益。
03研发管线
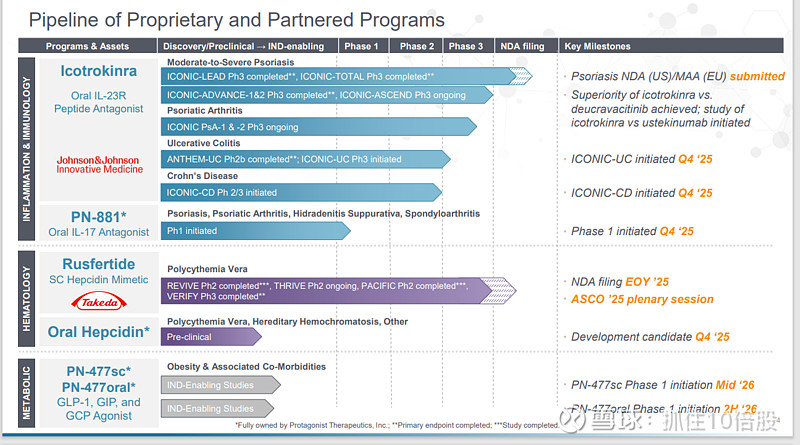
炎症和自免:
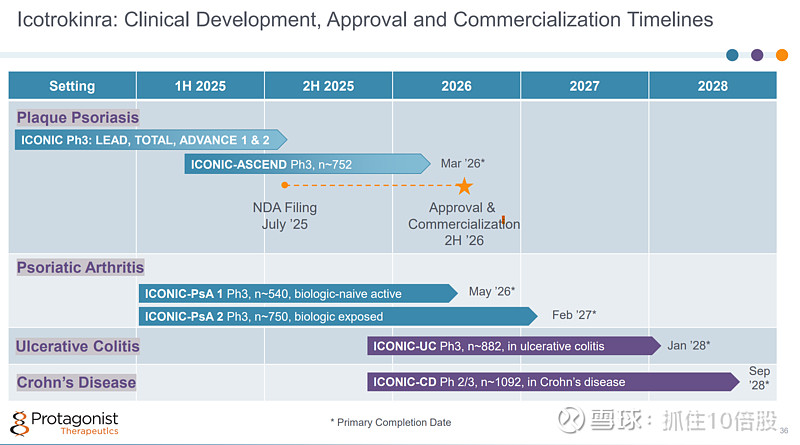
Icotrokinra是一种口服IL-23R多肽拮抗剂。中度至重度银屑病适应症处于NDA阶段;银屑病关节炎处于3期临床;溃疡性结肠炎(UC)3期临床启动;克罗恩病3期临床启动;
PN-881是一种口服IL-17多肽拮抗剂,目前处于一期临床。拟开发银屑病、银屑病关节炎、化脓性汗腺炎、脊柱关节炎等适应症。
血液:
Rusfertide是一种皮下注射(SC)铁调素(Hepcidin)类似物,用于治疗真性红细胞增多症已经处于NDA阶段。
口服铁调素治疗真性红细胞增多症、遗传性血色素沉着症等处于临床前阶段。
代谢:
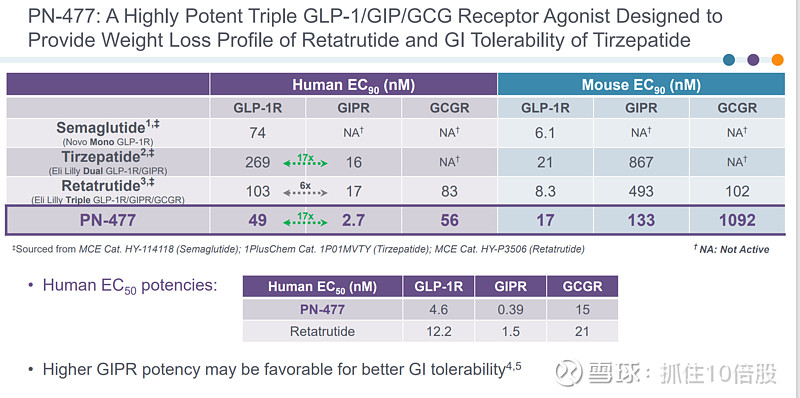
PN-477(皮下注射)是一种GLP-1,GIP和GCP三靶点激动剂。用于肥胖治疗。此外公司还开发了PN-477口服版。目前这两个分子还处于IND阶段。
Icotrokinra (JNJ-2113):First-in-Class口服IL-23受体拮抗剂
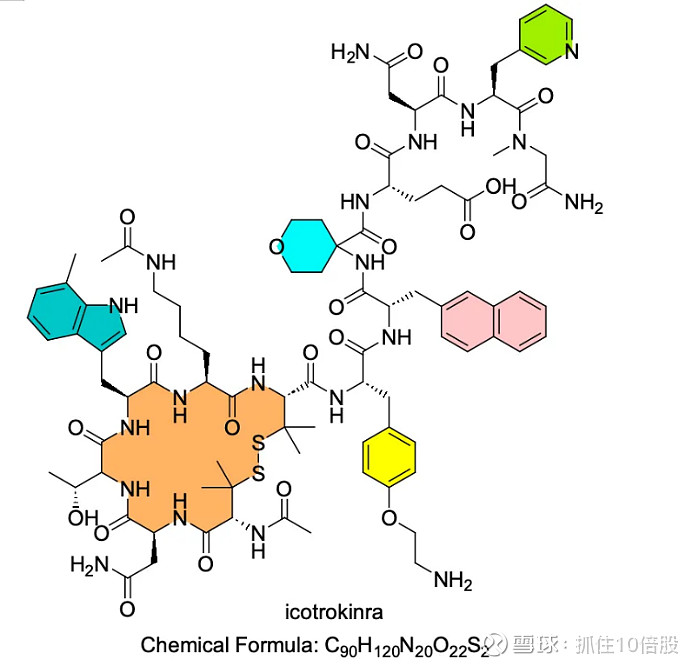
在多肽药物的结构设计中,二硫键的引入是增强分子构象稳定性、提升靶点亲和力与酶解耐受性的常规策略。然而,传统的二硫键主要由两个半胱氨酸(Cys)残基形成,其抗胃肠酶解能力有限,不足以满足口服制剂的严苛需求。
Icotrokinra 的突破点之一,便在于其环肽结构中采用了两个 L-penicillamine(Pen,青霉胺)残基,构建出一个高度刚性与立体阻碍性更强的非典型二硫键结构,实现了对稳定性与口服适应性的双重突破。
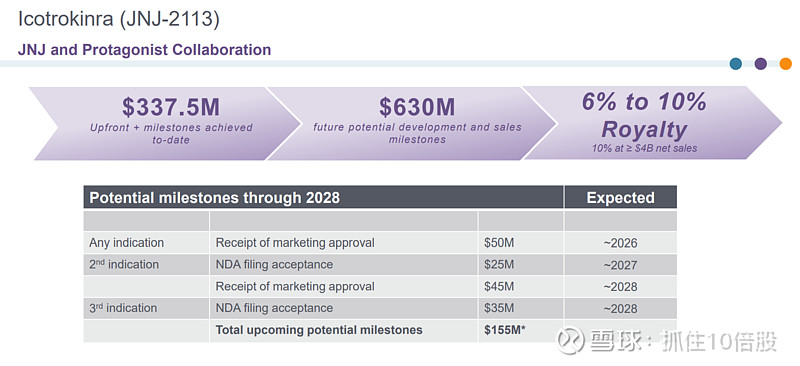
Icotrokinra的临床与商业化由强生主导,目前收到首付及里程碑共计3.37亿美元。未来潜在里程碑6.3亿美元。此外公司有权收到6-10%的销售收入分成,在≥40亿时为10%。公司预计销售峰值为50亿美元。
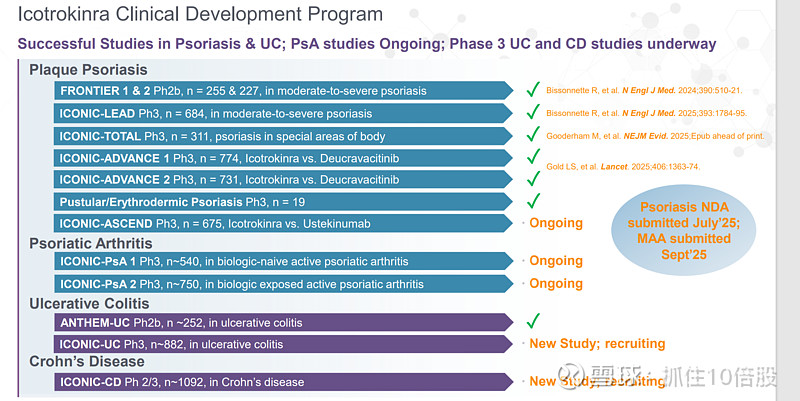
Icotrokinra进行了多个临床研究,包含多个适应症。
斑块状银屑病:ICONIC-LEAD Ph3, ICONIC-TOTAL Ph3,ICONIC-ADVANCE 1 Ph3,ICONIC-ADVANCE 2 Ph3,脓疱型/红皮病型银屑病 Ph3,ICONIC-ASCEND Ph3(正在进行)。
银屑病关节炎:ICONIC-PsA 1 Ph3(正在进行), ICONIC-PsA 2 Ph3(正在进行)
溃疡性结肠炎:ICONIC-UC Ph3(招募)
克罗恩病:ICONIC-CD Ph 2/3(招募)
3期临床ICONIC LEAD研究:Icotrokinra治疗成人及青少年中重度银屑病。
主要终点:16周IGA 0/1和PASI 90评分。
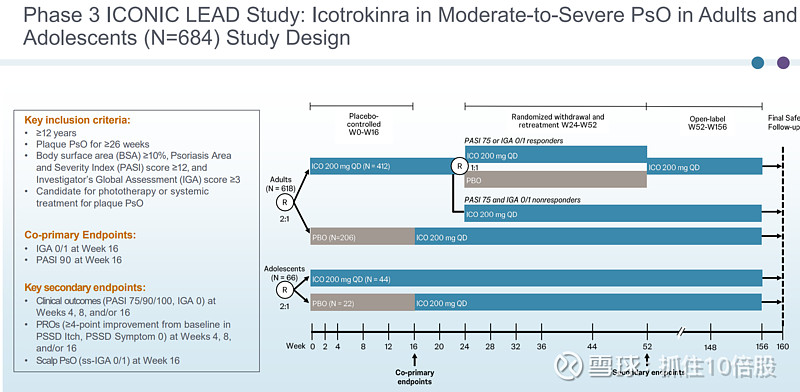
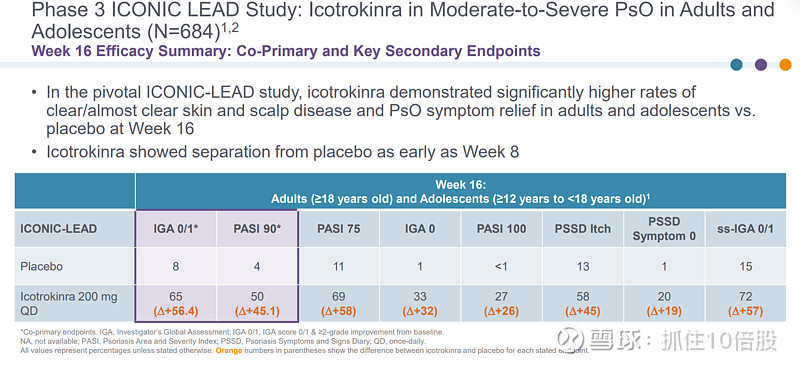
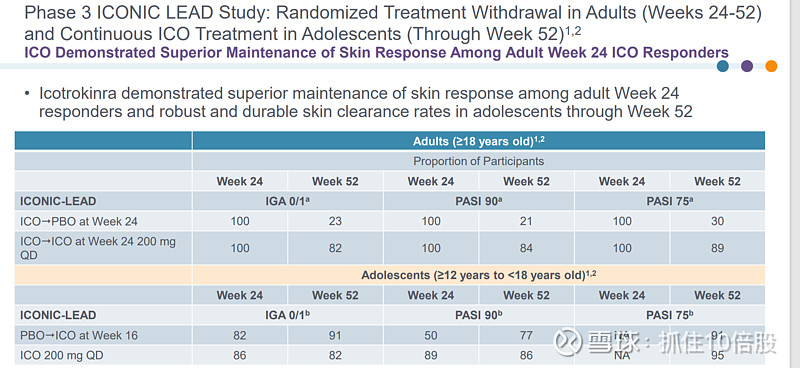
与安慰剂相比,Icotrokinra在第 16 周时显著提高了成人和青少年患者皮肤和头皮疾病完全/几乎完全清除率以及银屑病症状缓解率。Icotrokinra在第 8 周时就已显示出与安慰剂的显著差异。在第 24 周时,对于成年患者的皮肤反应维持情况,Icotrokinra表现出了更佳的效果;而对于青少年患者,其在第 52 周时仍能保持强劲且持久的皮肤清除率。
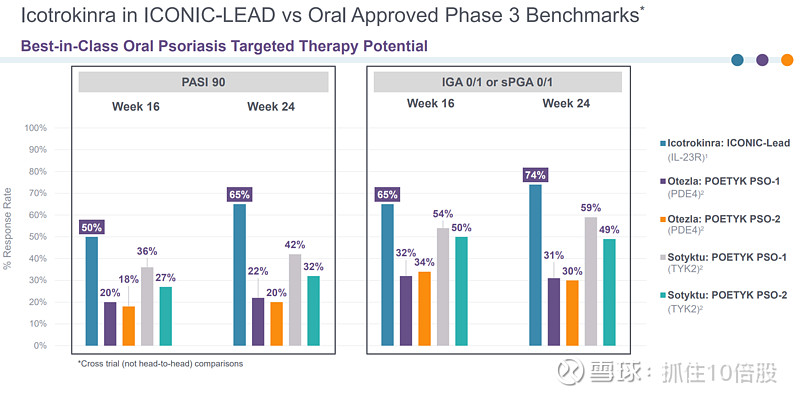
相比于获批的口服药Otezla和Sotyktu,Icotrokinra药效更优。
Ph3 ICONIC-TOTAL:斑块状银屑病及难治性高影响部位(N=311)研究。
主要终点:Icotrokinra对比安慰剂(PBO):IGA 评分为 0(完全清除)/1(几乎清除)且较基线改善 2 级(IGA 0/1)。
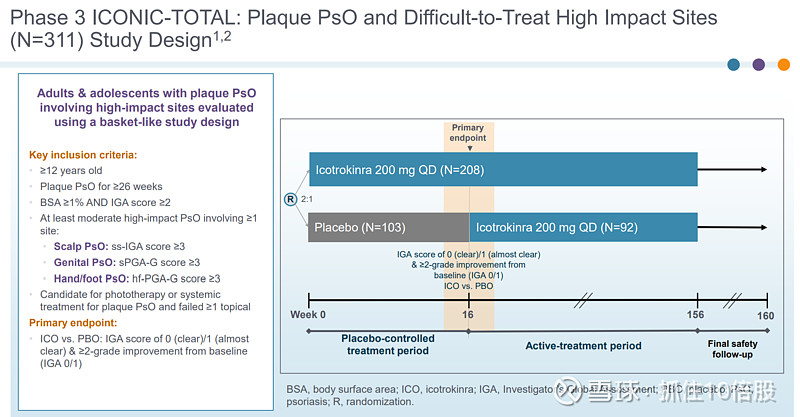
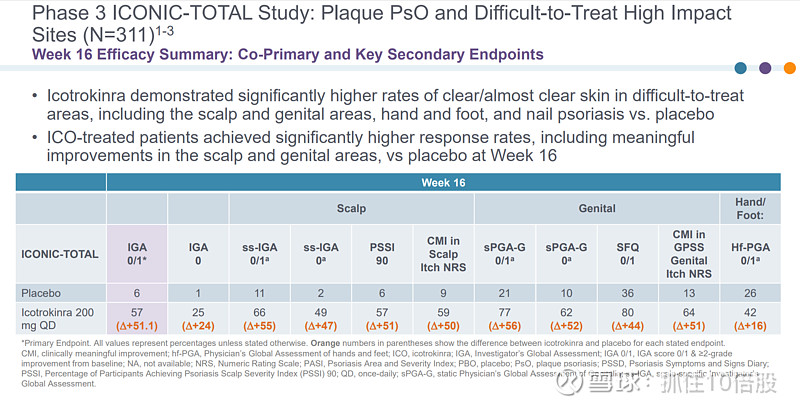
Icotrokinra在包括头皮、生殖器区域、手足以及指甲银屑病等难以治疗的部位,展现出显著高于安慰剂的皮肤完全或几乎完全清创率。在第 16 周时,接受Icotrokinra治疗的患者取得了显著更高的应答率,包括头皮和生殖器区域的显著改善,优于安慰剂组。
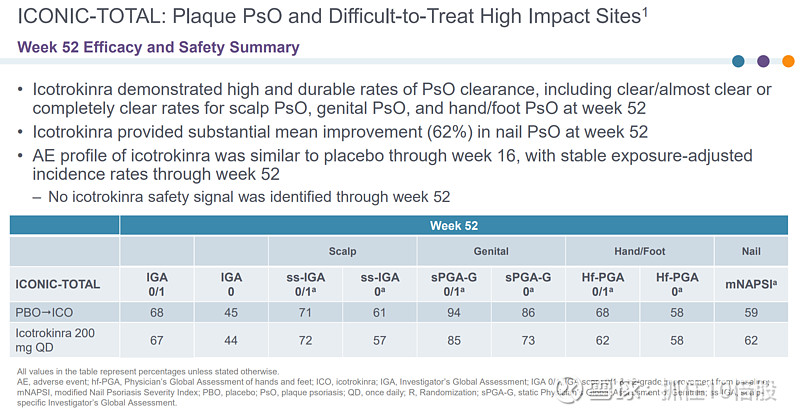
在第 52 周时,Icotrokinra显示出高且持久的银屑病清除率,包括头皮银屑病、生殖器银屑病和手/足银屑病的清除率(几乎完全清除或完全清除)。在第 52 周时,Icotrokinra使指甲银屑病的平均改善率达到了 62%。在第 16 周时,Icotrokinra的不良事件概况与安慰剂相似,且在第 52 周时调整后的暴露发生率保持稳定。在第 52 周时,未发现Icotrokinra的安全信号。
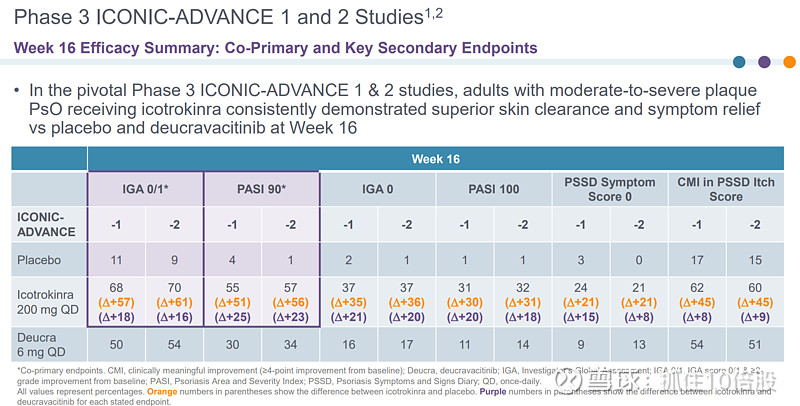
ICONIC-ADVANCE 1 和2研究
主要终点:16周时,IGA 评分 0/1并且相对于基线≥2级提升。PASI90评分。
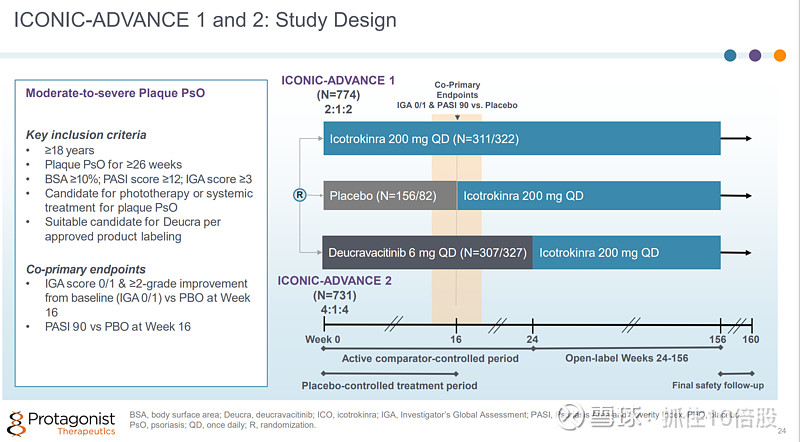
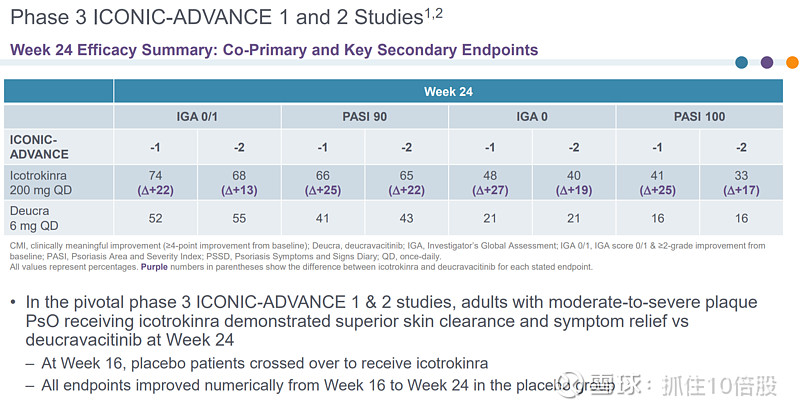
在关键的 3 期 ICONIC-ADVANCE 1 和 2 研究中,中重度斑块状银屑病成年患者在第 16 周时接受Icotrokinra治疗,其皮肤清除率和症状缓解情况始终优于安慰剂和TYK2抑制剂氘可来昔替尼。在第 24 周时使用Icotrokinra治疗显示出比氘可来昔替尼更优的皮肤清除率和症状缓解效果。
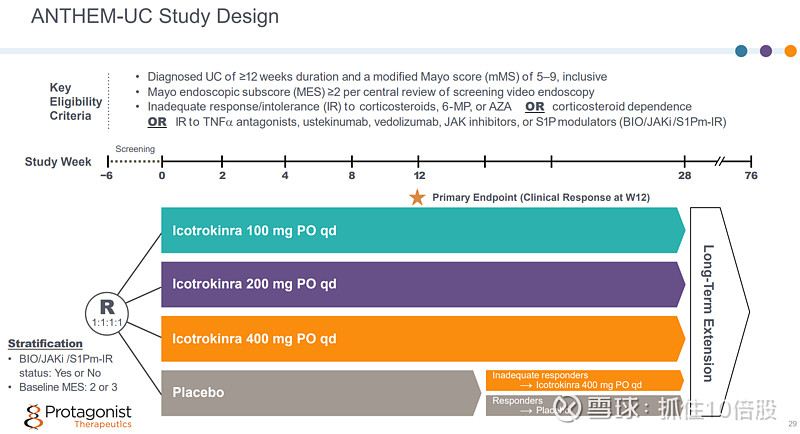
ANTHEM-UC 2期临床研究已经完成。主要终点:12周时临床响应率。
2b期临床结果:
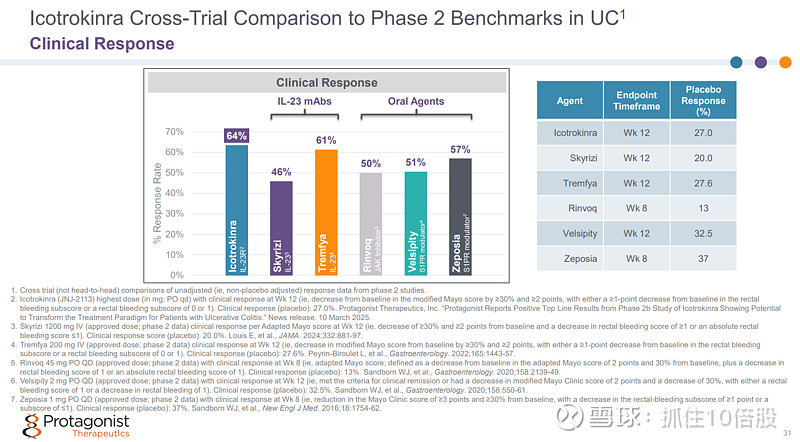
与安慰剂相比,Icotrokinra(每日 400 毫克)在第 12 周和第 28 周时均显示出持续且具有临床意义的效果。

不同临床试验的数据对比表明,Icotrokinra临床响应率(400mg)达到64%,高于IL-23单抗(Skyrizi,Tremfya)以及口服小分子(Rinvoq,Velsipity,Zeposia)。
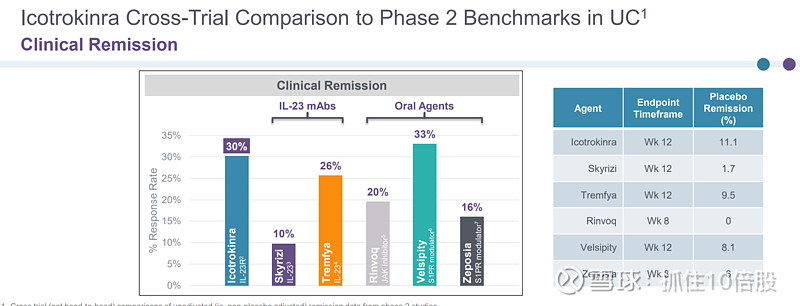
Icotrokinra各适应症临床总结:
1.斑块状银屑病(PsO):NDA于2025年7月提交
4 项针对中重度斑块型银屑病(PsO)患者的 III 期 ICONIC 试验。
在第 24 周时,约 65%的患者达到了 PASI 90 的标准,约 75%的患者达到了 IGA 0/1 的标准。
在第 24 周时,近 50%的患者皮肤完全清亮(IGA 0)。
在第 16 周和第 24 周时,Icotrokinra与氘代来可昔替尼相比,在达到 PASI 75、90、100、IGA 0/1 和 IGA 0 以及通过 PSSD 0 评估无症状方面的表现均更优。
在针对患有斑块型银屑病且病情难以控制、病灶部位严重且难以治疗的患者的研究中,3期ICONIC-TOTAL研究取得了成果。该研究的结果拓展了正在进行的3期 ICONIC-LEAD 研究的成果,该研究旨在评估Icotrokinra在成年及青少年患有中重度斑块型银屑病患者中的疗效。
2.银屑病关节炎(PsA) :
针对中重度银屑病关节炎的第三阶段试验已启动:针对未接受过生物制剂治疗的患者的 ICONIC-PsA 1 试验,以及针对已接受过生物制剂治疗的患者的 ICONIC-PsA 2 试验。
3.溃疡性结肠炎(UC) :
2b 期 ANTHEM-UC 研究(针对中重度活动性溃疡性结肠炎患者):Icotrokinra在所有剂量组中均达到了临床缓解的主要指标 。
在 2b 期 ANTHEM UC 研究中,12 周时的临床缓解率高达 30.2%,临床有效率最高可达 63.5%,且安全性表现良好。 在第 28 周期间,临床治疗效果和缓解率持续得到改善。 “ICONIC-UC”三期临床试验已启动。
4.克罗恩病(CD)
“ICONIC-CD”二期/三期临床试验已启动
Rusfertide:天然激素铁调素的合成模拟物
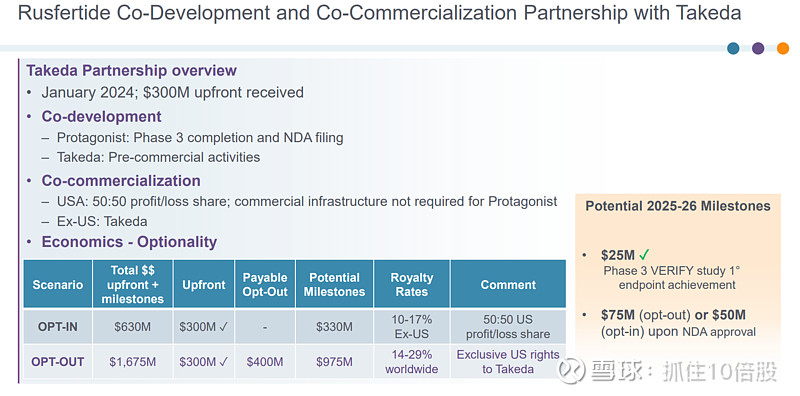
Rusfertide是一种铁调素(hepcidin)模拟肽类药物,由武田制药与Protagonist Therapeutics联合开发。首付为3亿美元,公司可以选择14-29%销售收入分成,或者美国50%利润分成+美国以外地区10-17%销售收入分成。公司预计其销售峰值为10-20亿美元。
真性红细胞增多症(PV) 是一种罕见的骨髓增殖性肿瘤,其特征为红细胞(RBC)过度生成。 红细胞压积(Hct)升高超过 45% 。严重的、慢性疾病会增加血栓形成和心血管方面的风险。美国约有 155000 名 PV 患者,其平均生存期为 14 年。
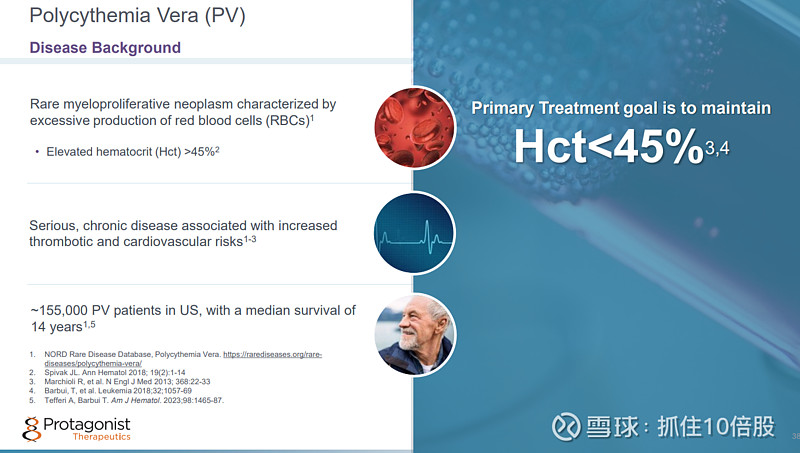
Rusfertide已获得针对真性红细胞增多症的孤儿药资格、快速通道资格以及突破性疗法认定。

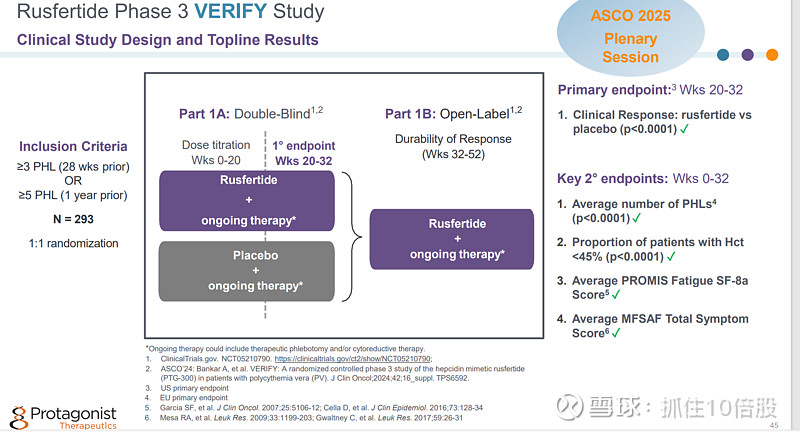
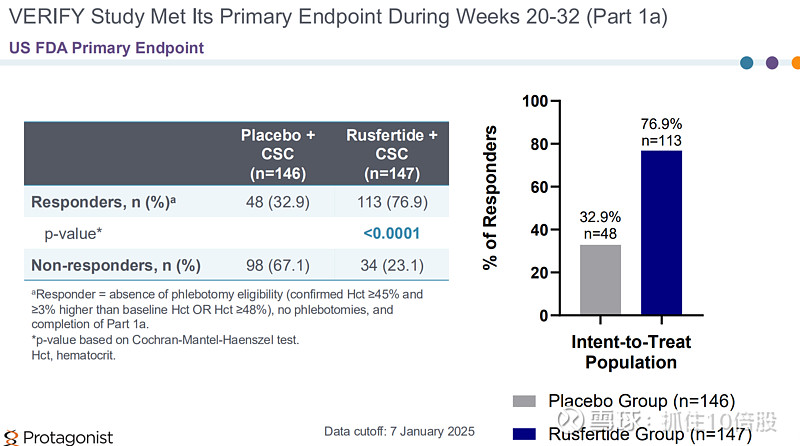
2025年6月公司展示了Rusfertide 3期临床 VERIFY研究的结果。结果显示安慰剂+标准疗法的响应率为32.9%,Rusfertide+标准疗法的响应率为76.9%(P<0.0001)。研究达到了主要终点和所有次要终点。公司已经提交了NDA申请,预计2026年获批。

其他早期项目
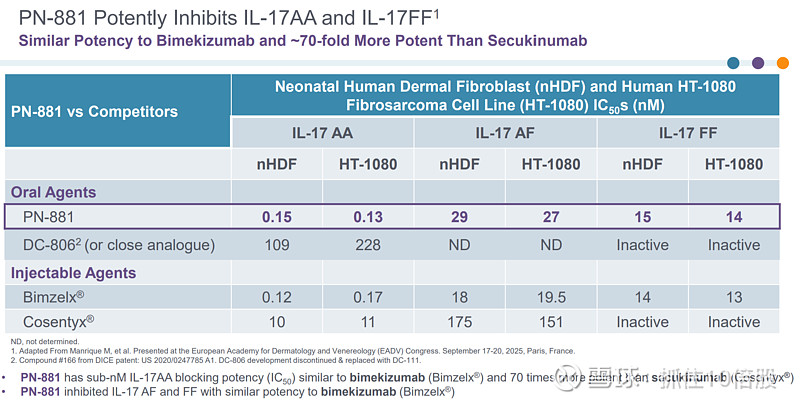
PN-881:口服IL-17多肽拮抗剂,1期临床
PN-477:新型GLP-1R/GIPR/GCGR 三重激动剂肽
04总结
Protagonist Therapeutics(PTGX)作为一家成功的生物科技公司,其核心发展策略可以概括为:专注于一项有潜力的颠覆性技术平台,并以此为基础,通过深度绑定大型药企的战略合作来推进管线、分散风险并实现价值最大化。
1.专注颠覆性技术平台
开发口服环肽技术,用于靶向IL-23R等传统上由注射型抗体药物主导的领域。其核心药物Icotrokinra在银屑病、溃疡性结肠炎的临床研究中,疗效优于或媲美现有注射疗法,提供了口服便利性。
2.设计与巨头的深度合作模式
与强生合作开发Icotrokinra:获得高额预付款及里程碑付款(总计约10亿美元),并享有6-10%的销售额分成。这种模式既获得了巨额研发资金,又保留了长期的“产品权益”。
3. 精准的商业化与资本运作
其核心管线精准瞄准了合作方(强生)的重大未满足需求——应对其王牌药物Stelara(乌司奴单抗)的专利到期。这使得公司不仅获得强生全力支持,自身也成为极具吸引力的并购标的
4. 构建聚焦且高潜力的产品管线
管线高度聚焦于血液疾病和免疫疾病两大领域。主力产品Icotrokinra和Rusfertide分别针对百亿级美元市场,且均获得FDA突破性疗法认定,临床数据优异
