Rhythm 制药公布2期探索性试验初步数据,Setmelanotide在普拉德-威利综合征治疗中显示积极疗效信号
2025年12月11日
-接受Setmelanotide治疗的普拉德-威利综合征(PWS)患者在治疗第3个月(n=8)和第6个月(n=5)时,体重指数(BMI)和食欲亢进症状均出现下降;18名入组患者中,17人仍在持续接受治疗。
-该积极结果为Setmelanotide用于普拉德-威利综合征的3期注册试验提供支持。
-公司启动1期D部分研究,评估每周一次的黑皮质素4受体(MC4R)激动剂RM-718在普拉德-威利综合征患者中的疗效。
波士顿,2025年12月11日(环球新闻社)——Rhythm Pharmaceuticals公司(纳斯达克股票代码:RYTM)是一家全球性商业化阶段生物制药企业,专注于改善罕见神经内分泌疾病患者的生活质量。该公司今日宣布,其针对Setmelanotide治疗普拉德-威利综合征的2期探索性试验取得积极初步结果。
该公司同时宣布,在2期试验顺利完成后,计划推进Setmelanotide进入针对普拉德-威利综合征的3期注册试验。此外,Rhythm Pharmaceuticals还宣布,已在MC4R激动剂RM-718的1期试验中新增D部分研究,该部分将纳入至多20名普拉德-威利综合征患者。公司预计于2025年12月启动RM-718为期26周的开放标签试验,并对首位患者进行筛查。
“普拉德-威利综合征患者群体仍存在巨大的未被满足的医疗需求,”该2期试验的主要研究者、佛罗里达大学医学院儿科内分泌科Jennifer Miller医学博士表示,“普拉德-威利综合征相关的食欲亢进和重度肥胖给患者带来了严峻挑战,长期来看往往会导致严重的健康并发症。这些中期数据为未来潜在治疗方案提供了重要参考,该方案或有助于满足普拉德-威利综合征患者独特且关键的治疗需求。”
Rhythm Pharmaceuticals共入组18名年龄在6-65岁的普拉德-威利综合征患者,其中18岁及以上患者的BMI≥30 kg/m²,18岁以下患者的BMI≥同年龄、同性别人群的第95百分位。这项为期52周的试验目前仍在进行中。
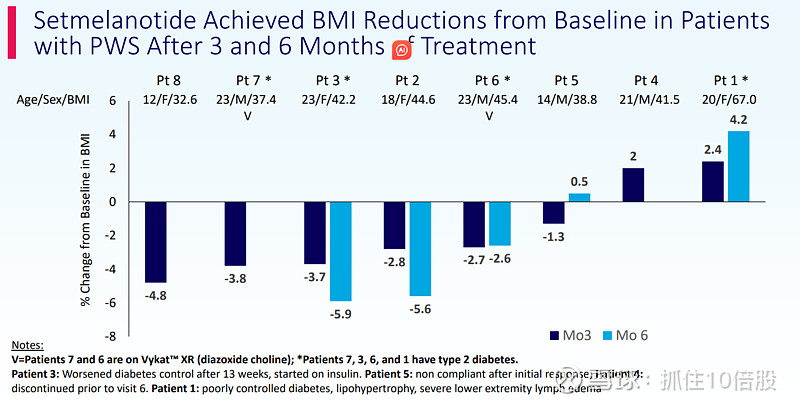
截至11月14日(数据截止日),Setmelanotide治疗在普拉德-威利综合征患者中显示出潜在治疗益处,患者在治疗第3个月(n=8)和第6个月(n=5)时BMI和食欲亢进症状均有所下降;初步结果的核心亮点包括:
- 8名完成3个月Setmelanotide治疗的患者中,6人实现BMI较基线下降;
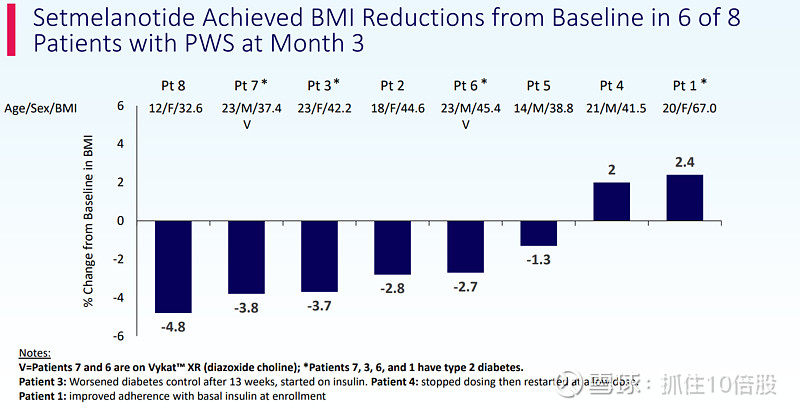
- 5名完成6个月Setmelanotide治疗的患者中,3人实现BMI下降,其中2人的BMI降幅较第3个月进一步扩大,1人BMI与第3个月持平;
- 在7名可评估的、完成3个月Setmelanotide治疗的患者中,6人实现临床试验食欲亢进问卷(HQ-CT)评分的显著下降;另有1名患者的基线HQ-CT评分与第3个月评分均为0,故不纳入可评估范围;

- 18名入组患者中,17人仍在接受Setmelanotide积极治疗;
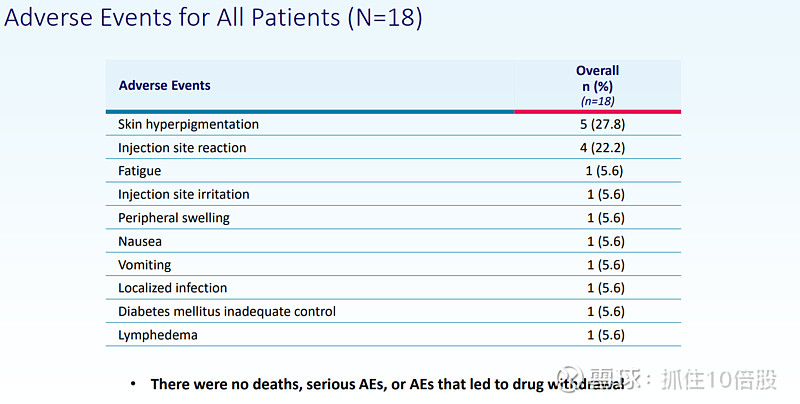
- 安全性和耐受性结果与Setmelanotide已确立的临床特征一致。
“这些初步结果令我们备受鼓舞,也让我们有信心推进Setmelanotide进入针对普拉德-威利综合征的3期注册试验,”Rhythm Pharmaceuticals董事长、首席执行官兼总裁David Meeker医学博士表示,“我们期待在2026年上半年获得更多数据,并将继续探索MC4R激动剂对这一患者群体的治疗潜力——目前该群体可选择的治疗方案非常有限。同时,我们也期待评估每周一次的MC4R激动剂RM-718在普拉德-威利综合征中的疗效,预计将于12月启动该研究的首位普拉德-威利综合征患者筛查工作。”
关于普拉德-威利综合征2期试验
该试验是一项单中心、开放标签的2期研究,旨在评估Setmelanotide治疗普拉德-威利综合征的疗效。试验最初设计为期26周,后延长至52周,以便早期入组患者能继续接受治疗。
试验共入组18名年龄在6-65岁、患有普拉德-威利综合征且合并肥胖的患者。患者在耐受范围内逐步将Setmelanotide剂量递增至5mg/天。试验的主要终点为安全性和耐受性,关键次要终点包括体重、食欲亢进症状、行为及药代动力学评估。截至目前,安全性和耐受性结果与Setmelanotide已确立的临床特征一致。
关于普拉德-威利综合征(PWS)
普拉德-威利综合征是一种罕见的遗传性疾病,可导致多种身体、精神及行为问题。该疾病的核心特征之一是患者从约2岁开始出现持续的饥饿感。据估计,全球约有40万人患有普拉德-威利综合征,美国约有2万人患病。目前,针对普拉德-威利综合征相关的严重食欲亢进及静息能量消耗降低,有效的治疗方案十分有限。

关于Rhythm Pharmaceuticals公司
Rhythm Pharmaceuticals是一家商业化阶段的生物制药公司,致力于改善罕见神经内分泌疾病患者及其家庭的生活。公司的核心产品IMCIVREE®(Setmelanotide)是一种MC4R激动剂,用于治疗食欲亢进和重度肥胖,已获美国食品药品监督管理局(FDA)批准,用于在2岁及以上成人和儿童患者中,治疗由巴德-毕德氏综合征(BBS)、经基因确认的阿黑皮素原(POMC)缺乏症(包括前蛋白转化酶枯草溶菌素/kexin 1型(PCSK1)缺乏症)或瘦素受体(LEPR)缺乏症引起的综合征性或单基因肥胖,以减少多余体重并长期维持体重下降效果。
此外,欧洲委员会(EC)和英国药品和医疗产品监管局(MHRA)也已批准Setmelanotide,用于治疗2岁及以上成人和儿童中经基因确认的巴德-毕德氏综合征,或经基因确认的双等位基因POMC功能缺失性缺乏症(包括PCSK1缺乏症)、双等位基因LEPR缺乏症相关的肥胖,并控制相关饥饿感。
同时,Rhythm Pharmaceuticals正推进Setmelanotide在其他罕见疾病中的广泛临床开发项目,还在研发 investigational MC4R激动剂bivamelagon和RM-718,以及用于治疗先天性高胰岛素血症的一系列临床前小分子药物。公司总部位于美国马萨诸塞州波士顿市。
Setmelanotide适应症
美国
Setmelanotide适用于在2岁及以上成人和儿童患者中,治疗由巴德-毕德氏综合征(BBS)、阿黑皮素原(POMC)缺乏症、前蛋白转化酶枯草溶菌素/kexin 1型(PCSK1)缺乏症或瘦素受体(LEPR)缺乏症引起的综合征性或单基因肥胖,以减少多余体重并长期维持体重下降效果。上述适应症需经FDA批准的检测确认,即患者POMC、PCSK1或LEPR基因存在被判定为致病性、可能致病性或意义未明(VUS)的变异。
欧盟及英国
Setmelanotide适用于治疗2岁及以上成人和儿童中经基因确认的巴德-毕德氏综合征,或经基因确认的双等位基因POMC功能缺失性缺乏症(包括PCSK1缺乏症)、双等位基因LEPR缺乏症相关的肥胖,并控制相关饥饿感。在欧洲,Setmelanotide需由具备遗传性肥胖诊疗经验的医师开具处方并监督使用。
用法限制
Setmelanotide不适用于以下情况的患者,因预计无法产生疗效:
- 疑似由POMC、PCSK1或LEPR缺乏症引起的肥胖,但患者POMC、PCSK1或LEPR基因变异被判定为良性或可能良性;
- 与POMC、PCSK1、LEPR缺乏症或巴德-毕德氏综合征无关的其他类型肥胖,包括与其他遗传综合征相关的肥胖及普通(多基因)肥胖。
禁忌症
对Setmelanotide或IMCIVREE®中任何辅料存在严重过敏史的患者禁用。已有严重过敏反应(如过敏性休克)的报告。
警告与注意事项
1. 皮肤色素沉着、原有色素痣变黑及新发黑素细胞痣:由于Setmelanotide的药理作用,可能出现全身性皮肤色素沉着增加及原有色素痣变黑。治疗开始前及治疗期间应定期进行全身皮肤检查,监测原有及新发色素性病变。
2. 性唤起障碍:已有男性患者出现自发性阴茎勃起、女性患者出现性不良反应的报告。应告知患者可能发生此类事件,若男性患者勃起持续超过4小时,需立即寻求急诊医疗救助。
3. 抑郁与自杀意念:已有抑郁、自杀意念及情绪低落的报告。需监测患者是否出现新发或加重的抑郁症状,或自杀想法/行为。若患者出现自杀想法/行为,或发生具有临床意义的持续性抑郁症状,应考虑停用IMCIVREE®。
4. 过敏反应:已有严重过敏反应(如过敏性休克)的报告。若怀疑发生过敏反应,应建议患者立即寻求医疗救助并停用IMCIVREE®。
5. 儿科人群:处方医师应定期评估Setmelanotide治疗的疗效。对于生长发育期儿童,需评估体重下降对生长发育的影响。在欧洲,处方医师应使用适合年龄和性别的生长曲线监测儿童的生长(身高和体重)。
6. 含苯甲醇防腐剂对新生儿及低出生体重婴儿的严重不良反应风险:IMCIVREE®未获批用于新生儿或婴儿。新生儿及低出生体重婴儿使用含苯甲醇防腐剂的药物可能发生严重甚至致命的不良反应,包括“喘息综合征”。
不良反应
最常见的不良反应(发生率≥20%)包括皮肤色素沉着、注射部位反应、恶心、头痛、腹泻、腹痛、呕吐、抑郁及自发性阴茎勃起。