Nuvalent therapeutics:从克服耐药到穿越血脑屏障,环化TKI如何重塑NSCLC治疗格局

Nuvalent therapeutics是一家临床阶段的生物技术公司。正在研发精准靶向疗法,旨在克服现有疗法在临床验证的激酶靶点治疗癌症患者方面的局限性。凭借在基于结构的设计方面的深厚专业知识,公司开发出具有卓越靶点选择性的创新小分子药物,以克服耐药性、减少不良事件,并推动更持久的治疗反应。
01 技术特色
自2001年第一个激酶抑制剂伊马替尼获批,至今FDA已经批准了近百个激酶抑制剂。激酶抑制剂推动了肿瘤学中的靶向治疗革命,并始终处于精准医疗的前沿。然而,目前获批激酶抑制剂的临床效用受两个关键挑战限制:耐药性和选择性。
1.激酶耐药性问题
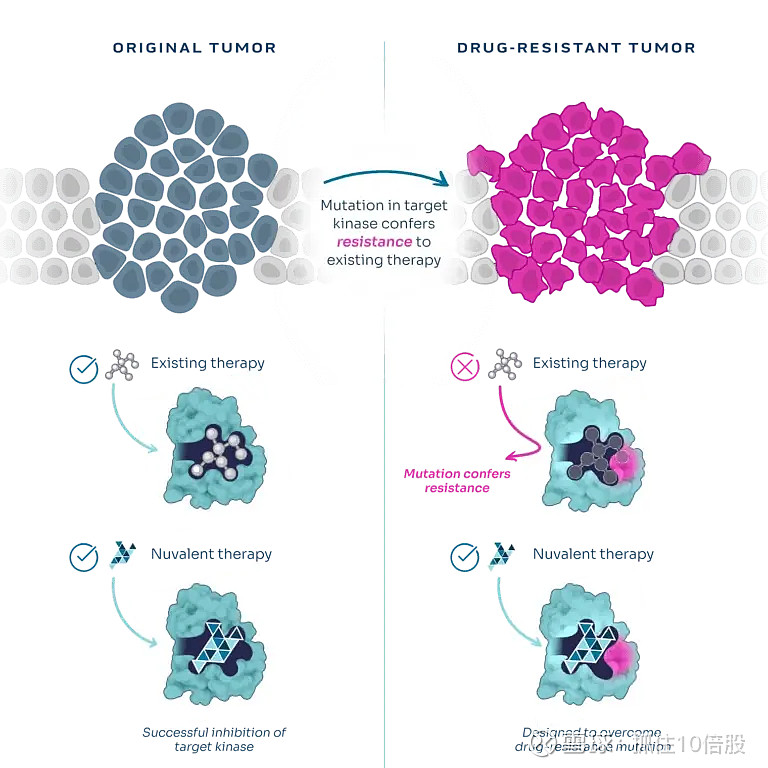
癌细胞不断发生突变。使用现有的激酶抑制剂进行治疗往往会导致出现携带新突变的癌细胞。这些突变可能会使现有疗法失效。Nuvalent设计创新的分子结构,能够精准作用于原发性癌症中的靶激酶以及耐药性癌症中的突变靶激酶。这使得公司的疗法能够同时治疗原发性肿瘤以及出现耐药性突变的肿瘤。
2.激酶选择性
不同激酶的药物结合位点在结构上往往非常相似,这使得设计能够特异性抑制单一靶点的分子变得十分困难。在某些情况下,激酶之间的相似性能够使一种分子被重新用于治疗多种不同的肿瘤类型。 然而,这种妥协方案意味着会允许抑制非靶点激酶,这可能会导致严重的不良反应以及靶点抑制效果不佳,从而缩短临床治疗的疗效持续时间。Nuvalent致力于开发新型药物候选物,其重点在于提高激酶选择性,以最大程度减少不良反应并促进持久疗效。公司凭借在基于结构设计方面的深厚专业知识来应对选择性难题,从而设计出针对特定患者群体的精准靶向疗法。

3.环化策略
激酶溶剂前沿突变发生在激酶ATP结合口袋“溶剂前沿”区域的氨基酸突变。其会改变空间位阻或关键相互作用,导致药物无法有效结合,从而产生耐药。抑制剂的大环化是将激酶抑制剂的线性结构通过化学连接形成环状大分子的药物化学策略。环化策略对抗溶剂前沿突变的核心在于构象约束和优化相互作用。1.构象预组织与紧密结合:大环结构能将抑制剂的关键药效团预先固定在最佳位置,使其能更紧密地“拥抱”因突变而变形的结合口袋,部分克服突变带来的空间位阻。2.拓展相互作用界面:大环的连接链可以探索并接触到激酶表面突变位点周围的新区域,形成额外的相互作用(如氢键、疏水作用),从而补偿因突变失去的结合力。此外环化还可以减小分子的极性表面积,有助于分子的跨膜。
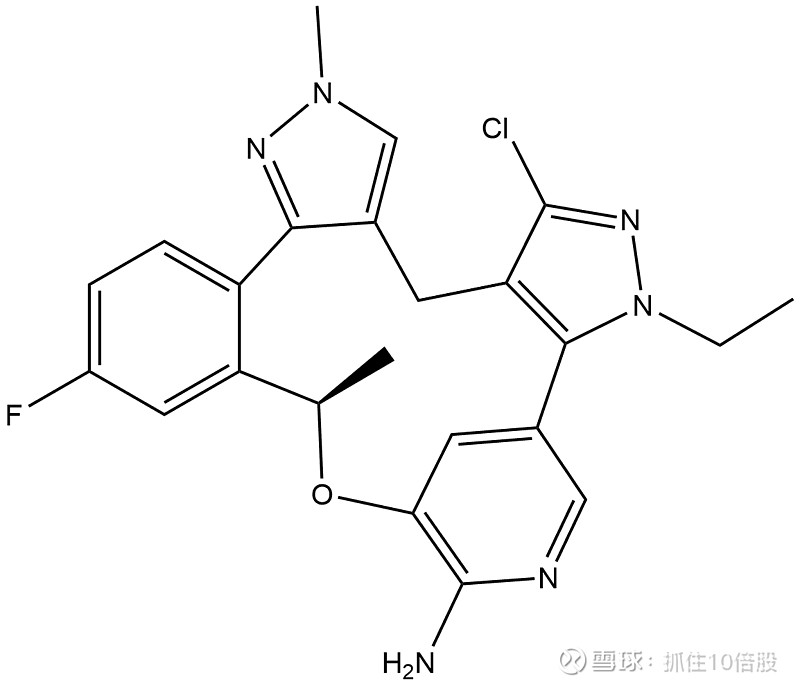
Nuvalent公司,其核心产品Zidesamtinib和Neladalkib正是运用了这一药物化学手段。它们都利用了大环化策略来有效对抗ALK、ROS1等激酶的溶剂前沿突变及其他耐药突变。
02研发管线
非小细胞肺癌(NSCLC)是肺癌中最主要的类型,约占所有肺癌病例的85%。
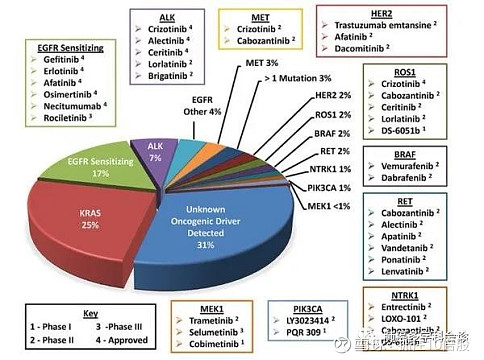
NSCLC患者中存在最多的突变是KRAS,占25%的比例,其次是EGFR常见突变,占有17%的比例,EGFR其他突变占有4%的比例,ALK突变占有7%的比例,其他的突变包括ROS1、BRAF、MET、HER2、RET、NTRK等基因。2024年NSCLC全球市场规模接近3000亿人民币。公司的管线全部围绕NSCLC展开,但是专注于竞争不太激烈的突变领域。具体包括:ROS1抑制剂Zidesamtinib (NVL-520),ALK抑制剂Neladalkib (NVL-655),HER2抑制剂NVL-330。
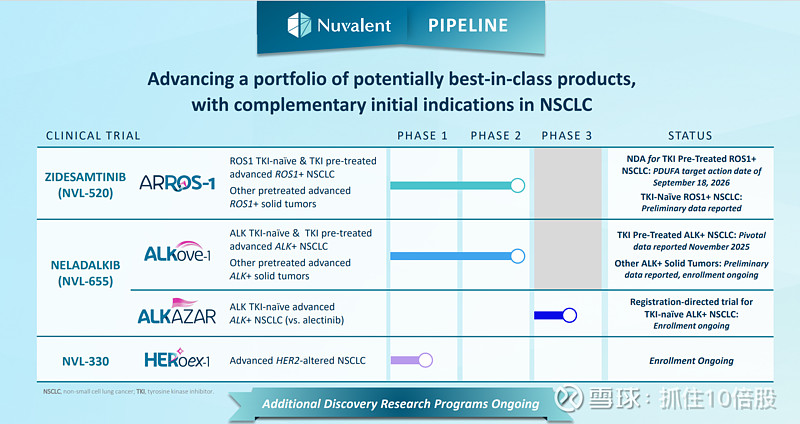
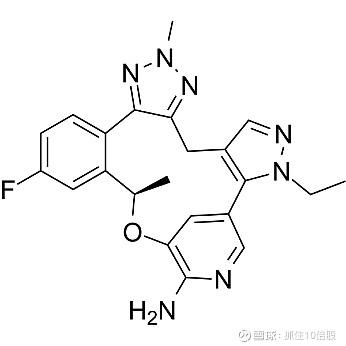
Zidesamtinib (NVL-520)
ROS1 融合是发生在非小细胞肺癌(NSCLC)患者中的一种致癌驱动基因改变,其发生率高达 3%。获批用于治疗由 ROS1 驱动的 NSCLC 的疗法的临床应用受到新出现的耐药突变以及中枢神经系统(CNS)疾病的影响。
Zidesamtinib是一种新型的可穿透大脑的针对 ROS1 的选择性抑制剂,其研发旨在满足以下综合医疗需求:针对由 ROS1 引发且对现有 ROS1抑制剂已产生抗药性的肿瘤,包括具有普遍存在的 G2032R“溶剂前沿”耐药性突变的肿瘤进行治疗;避免抑制结构上相关的肌动蛋白丝结合蛋白激酶(TRK)家族;治疗脑部转移。
ROS1 的选择性被强调,旨在最大程度减少与 TRK 的非靶向抑制相关的中枢神经系统不良反应,并有可能为携带 ROS1 突变的患者带来持久的治疗效果。此外,Zidesamtinib已被优化以增强其对大脑的渗透性,从而有可能为患有脑转移的患者提供更好的治疗选择。
Zidesamtinib获得突破性疗法认定和孤儿药认定。
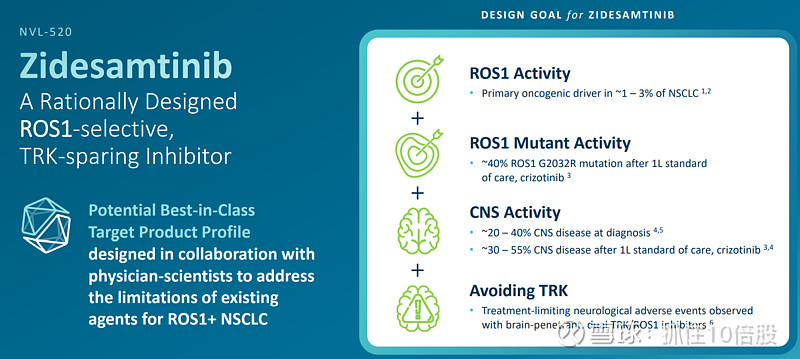
临床开发现状:
ARROS-1(2期临床): 2L TKI经治ROS1+的NSCLC患者。目前已经提交NDA申请,预计26年获批。
ARROS-1(2期临床):1L,未曾使用过ROS1抑制剂,且之前接受过化疗或免疫治疗的总次数不超过 1 次的。
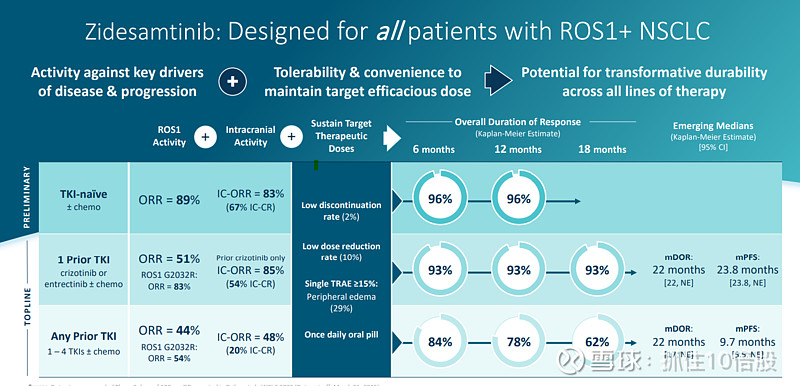
公司的临床试验从TKI经治患者切入,寻求加速批准;同时开发TKI初治患者,拓展适应症至全线治疗。

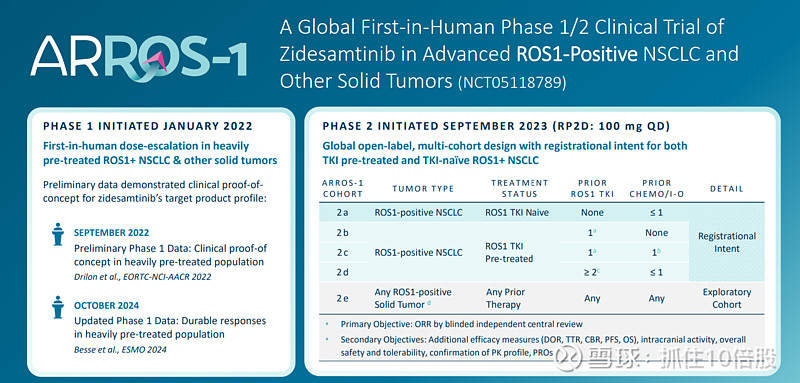
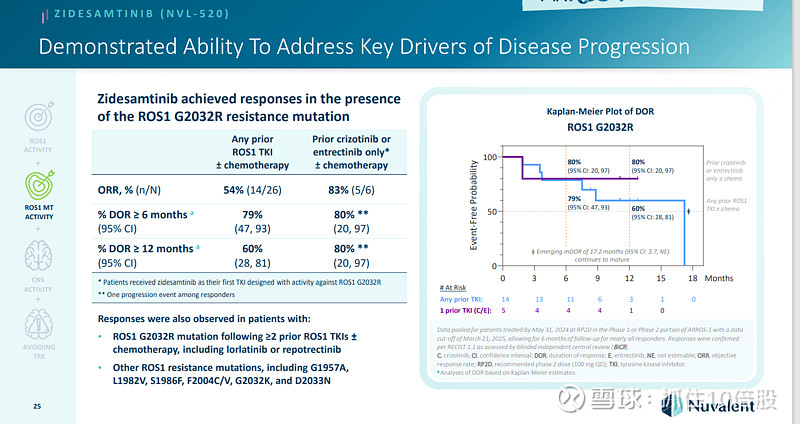
在已接受靶向药物治疗的ROS1阳性非小细胞肺癌患者群体中,促进了整体治疗效果的提升(ORR44%),并且在使用最常见的一线ROS1靶向药物后,也展现了二线治疗的效果(ORR51%)。
对于之前仅使用克唑替尼治疗的患者,所有反应者均未出现病情进展(DOR范围:7.3 至 23.2 个月)。6 个月、12 个月和 18 个月的PFS分别为 89%,且中位生存期尚未达到。
在那些此前接受过≥2 次 ROS1 酪氨酸激酶抑制剂治疗(并辅以化疗)的患者中,6 个月时的疾病缓解率(DOR)为 71%,12 个月时为 56%。
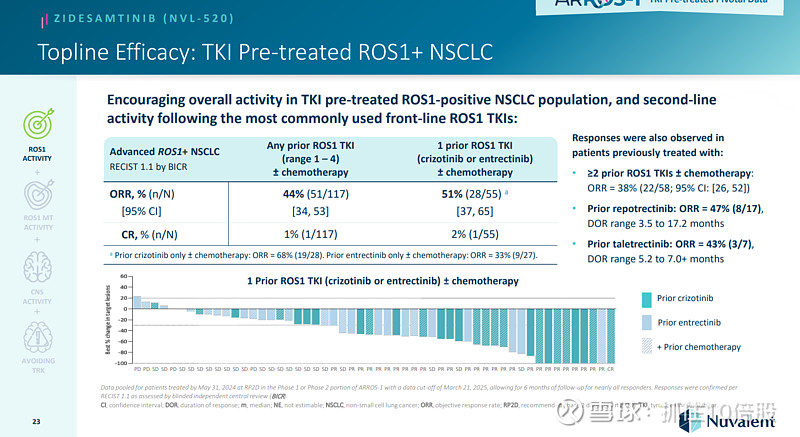
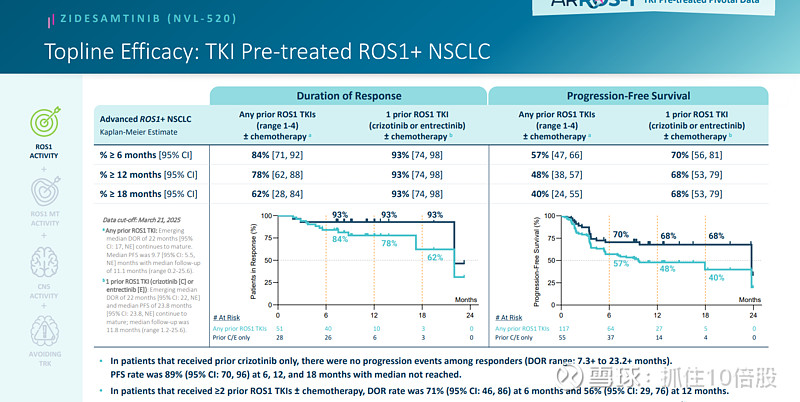
Zidesamtinib在存在ROS1基因的 G2032R 耐药突变的情况下也取得了治疗效果。
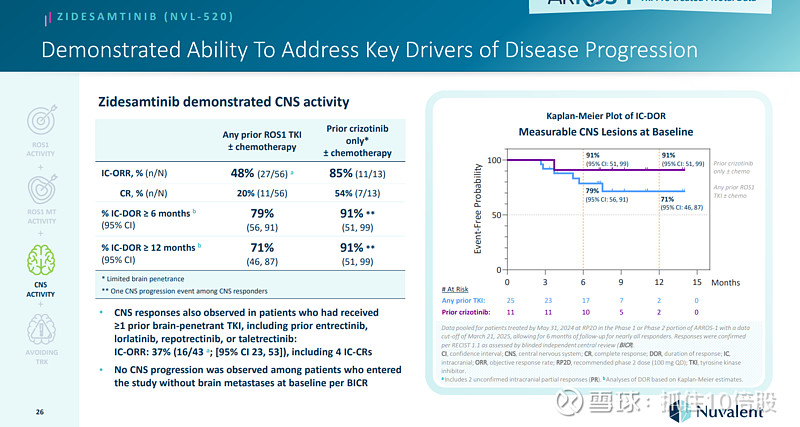
Zidesamtinib具有CNS活性,在基线时没有脑转移的患者中没有观察到CNS进展。Zidesamtinib的安全性总体良好。
对未使用过酪氨酸激酶抑制剂的患者的初步ORR高达89%。

Neladalkib (NVL-655)
ALK 融合是一种在多达 5%的非小细胞肺癌(NSCLC)患者中发现的致癌驱动性变异。由于出现新的耐药突变以及中枢神经系统(CNS)疾病,已获批的针对 ALK 驱动型 NSCLC 的治疗方法的临床应用受到了限制。
Neladalkib是一种新型的能够穿透大脑的、专针对 ALK 的抑制剂,其研发旨在满足以下综合医疗需求: 针对由 ALK 引发的肿瘤,这些肿瘤已对第一代、第二代和第三代 ALK 抑制剂产生耐药性,包括那些存在单一或复合治疗过程中出现的 ALK 突变(如涉及 G1202R“溶剂前沿”突变的肿瘤)的情况。 避免抑制结构相关的TRK蛋白激酶家族,并用于治疗脑转移。
强调 ALK 选择性,以最大程度减少与 TRK 非靶点抑制相关的 CNS 不良反应,并有望为携带 ALK 突变变异的患者带来更持久的治疗效果。此外,Neladalkib已针对脑渗透性进行了优化,以改善脑转移患者的治疗选择。

临床进展:
ALKOVE-1(2期):TKI经治的ALK+ NSCLC患者(2L)
ALKAZAR(3期):未经TKI治疗的ALK+ NSCLC患者(1L)
公司同样采取“先二线后一线”路径。在经治患者中推进注册的同时,已启动针对初治患者的全球3期头对头临床试验。

TKI经治患者ORR=31%,G1202R突变患者ORR=68%。
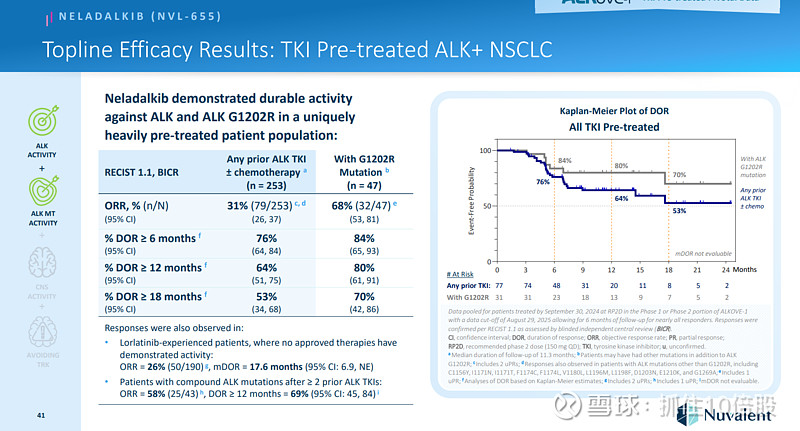

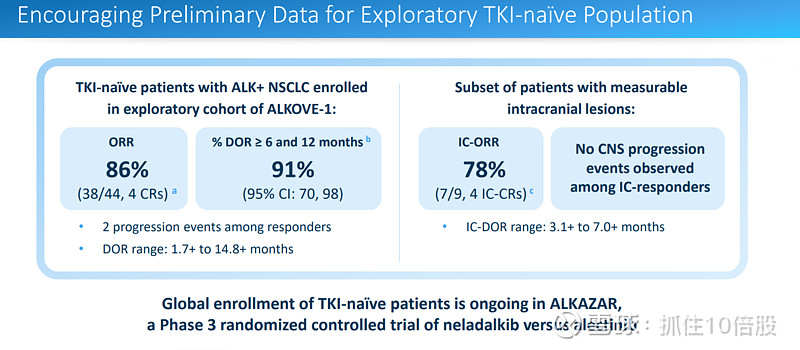
未使用过酪氨酸激酶抑制剂患者的ORR为86%。在 ALKAZAR 试验中,针对未曾使用过靶向药物治疗的患者的大规模入组工作正在进行中。该试验是针对neladalkib与阿来替尼的 3 期随机对照研究。
NVL-330
HER2 改变是 NSCLC 中一类重要的致癌驱动因素,包括 HER2 扩增(约占 NSCLC 的 1% - 5%)和 HER2 突变(约占 NSCLC 的 2% - 4%)。最常见的 HER2 突变是 HER2 外显子 20 突变,约 20% 的 HER2 突变型 NSCLC 患者会出现脑转移,且在治疗后这一比例还会增加。目前尚无获批用于 HER2 改变型 NSCLC 患者的 TKI 药物。
NVL-330 是一种新型的、可穿透血脑屏障的 HER2 选择性酪氨酸激酶抑制剂,其设计旨在满足以下综合医疗需求:治疗 HER2 突变肿瘤,包括具有 HER2 外显子 20 突变的肿瘤;避免因脱靶抑制野生型 EGFR 而导致的限制治疗的不良事件;以及治疗脑转移瘤。强调 HER2 选择性以尽量减少与抑制结构相关的野生型 EGFR 激酶相关的潜在剂量限制性不良事件,例如皮疹和胃肠道毒性。此外,NVL-330 已针对脑渗透性进行了优化,以潜在地改善脑转移患者治疗方案。

正在进行一期临床。

03总结
Nuvalent的研发策略有以下几个突出特点:
“未满足需求优先”的开发顺序:对于ROS1和ALK这两个主要项目,均优先开发针对现有酪氨酸激酶抑制剂治疗失败患者的疗法,这类患者存在明确的未满足临床需求,药物若能成功则更容易获得监管机构的加速批准。
构建“同类最优”潜力的产品特性:其药物设计不仅旨在克服常见的耐药突变,还特别强调脑渗透性以治疗脑转移,并力求避免因抑制相关靶点(如TRK)而产生的中枢神经系统副作用,从而追求更优的疗效和安全性。
多家投资机构对Nuvalent的产品管线给予了很高的商业价值评估。预计其销售峰值超30亿美元。

