超越“基因剪刀”:CRISPR Therapeutics的下一代疗法与广阔疾病蓝图

01创立背景与技术基石
CRISPR Therapeutics是基因编辑领域的一家领军公司,他的创立根植于一项诺贝尔奖级别的科学发现。公司的联合创始人之一是法国微生物学家Emmanuelle Charpentier。2012年,她与加州大学伯克利分校的Jennifer A. Doudna教授合作,在《科学》杂志上发表了里程碑式论文,首次在体外证明了CRISPR/Cas9系统可以被编程为高效的基因编辑工具。这项突破性研究为她们赢得了2020年的诺贝尔化学奖。基于这项革命性技术,Emmanuelle Charpentier与 Rodger Novak 和 Shaun Foy 于2013年联合创立了CRISPR Therapeutics。公司致力于将CRISPR/Cas9技术转化为治疗严重疾病的变革性疗法。
公司于2016年在美国纳斯达克交易所上市。2023年,公司与福泰制药(Vertex Pharmaceuticals)合作开发的基因编辑疗法Casgevy(exa-cel)先后在英国和美国获得监管批准上市,定价220万美元。这成为全球首款获批上市的CRISPR基因编辑疗法,标志着该技术从实验室走向临床应用的巨大成功。
在取得历史性突破的同时,公司也在动态调整战略。2023年底,公司宣布重新调整研发管线优先级,暂停了第一代“现货型”CAR-T产品(CTX110和CTX130)的进一步开发,将资源集中于效力更强的下一代产品(如CTX112和CTX131),并计划探索这些产品在自身免疫性疾病(如系统性红斑狼疮) 中的应用。同时,公司也进行了约10%的裁员以优化运营。

02 CRISPR/Cas9
CRISPR是簇状规律间隔短回文重复”(clustered regularly interspaced short palindromic repeat)的缩写。理解CRISPR功能的重要一步是识别CRISPR相关(cas)基因,这是一组仅存在于含有CRISPR的原核生物中并始终位于CRISPR旁边的基因。
CRISPR/Cas9是一项革命性的基因编辑技术,它让科学家能够以前所未有的精度、效率和灵活性,对生物体的DNA序列进行定向的“查找、剪切和修改”,因此常被形象地称为“分子剪刀”。
CRISPR:“某些细菌体内的一种排列有序、间隔均匀且呈回文结构的基因信息片段” 将其用作抗病毒系统的一部分,并且Emmanuelle Charpentier等人还发现了如何将其用作基因编辑工具的方法。
Cas9:一种与 CRISPR 相关联的(Cas)核酸内切酶,它充当“分子剪刀”的角色,能够对 DNA 进行切割操作。 由guide RNA 指定的位置。
guide RNA(gRNA):一种核糖核酸(RNA)分子,它与 Cas9 结合,并根据 gRNA 的序列确定 Cas9 切割 DNA 的位置。
CRISPR/Cas9可以通过离体及在体的方式对体细胞进行基因编辑。
详情可参考公众号文章-图文解析:CRISPR-Cas9 基因编辑的原理与应用全景
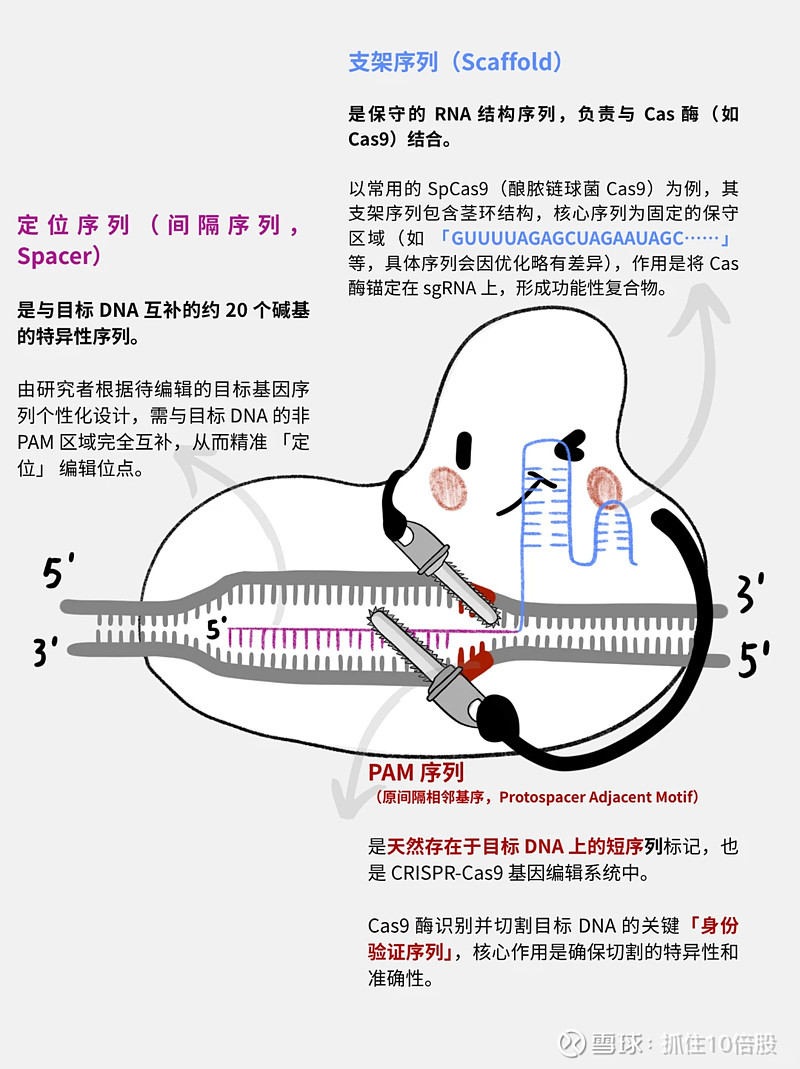
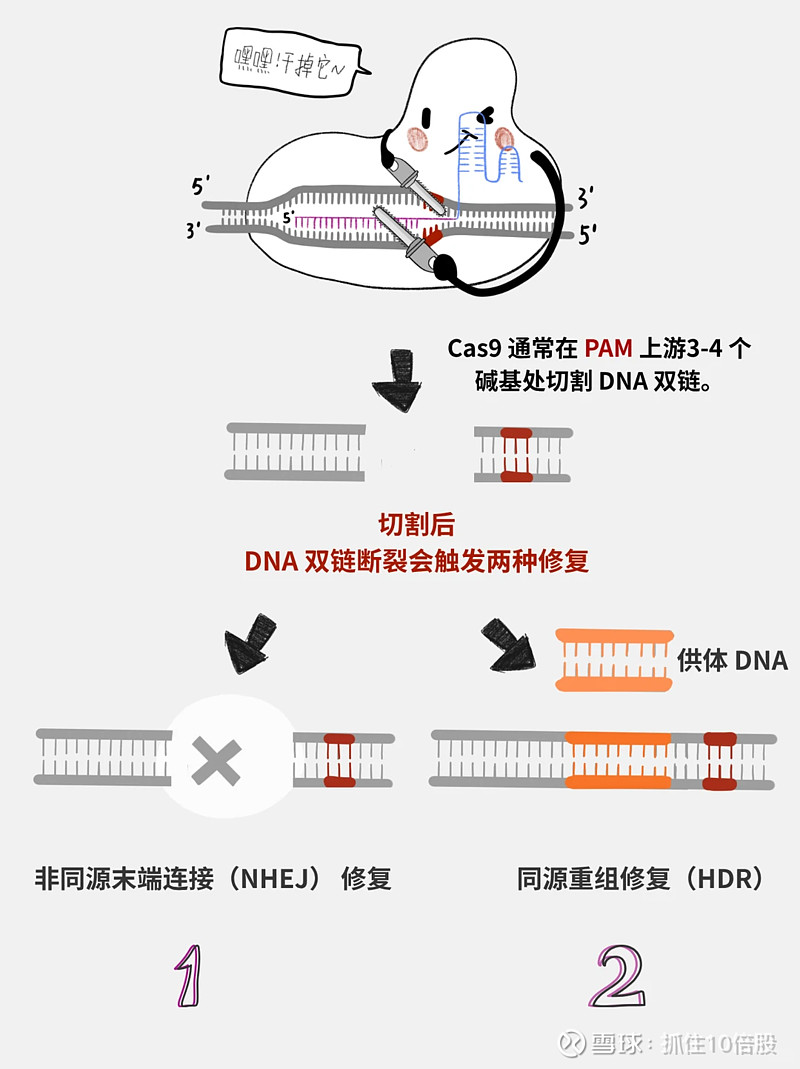
CRISPR-Cas9 基因编辑系统示意图(来源:小红书丁香大师姐)
03研发管线
血液:
与Vertex合作全球推出CASGEVY,同类最佳的商业化体外CRISPR-Cas9治疗镰状细胞病和地中海贫血。持续聚焦创新以拓展 CASGEVY 的潜在市场,推进利用脂质纳米颗粒(LNP)递送技术的体内研究方法。
CAR T(肿瘤免疫/自免):
具有创新效力编辑技术的顶级同种异体细胞疗法。CTX112 在系统性红斑狼疮/系统性硬化症/免疫介导性肌炎等疾病中的临床试验正在进行中;在自身免疫性疾病领域具有较强的竞争力。 CTX112在肿瘤治疗领域展现出了令人鼓舞的疗效和安全性特征。 体内嵌合抗原受体 T 细胞疗法在针对暂时性和永久性整合型嵌合抗原受体 T 细胞的研究中的应用。
In vivo(心血管和罕见病):
建立一个具有差异化的 LNP mRNA 平台,最初侧重于肝脏领域。两项针对心血管疾病的 I 期研究项目(CTX310 和 CTX320),旨在为该平台降低风险。 CTX310 作用于 ANGPTL3 的研究具有潜在受益人数超过4000万,覆盖美国人群。新一代的 SyNTase 编辑技术能够实现基因修正的方法。
T1D
多靶点小干扰 RNA 技术由Sirius Therapeutics公司主导,其中包括其主要产品 SRSD107,这是一种针对因子 XI 的潜在两年期小干扰 RNA,目前正处于二期临床试验阶段。

Casgevy:首个批准的基于CRISPR的基因疗法
镰状细胞病(SCD)是全世界最常见的遗传性血红蛋白病,每年的新出生的患儿数量高达300000人。β 地中海贫血(TDT)是指β珠蛋白的合成受部分或完全抑制的一种血红蛋白病。患儿出生时无症状,多于婴儿期发病,出生后3~6 个月内发病者占50%。发病年龄愈早,病情愈重。严重的慢性进行性贫血,需依靠输血维持生命。
Casgevy是一款精准靶向BCL11A基因的红细胞特异性增强子的基因编辑疗法,其核心机制并非直接修复致病基因,而是通过一种“解除抑制”的策略来重启保护性蛋白(胎儿血红蛋白)的生产。
具体操作流程如下:
提取与编辑:先从患者体内提取造血干细胞,在体外利用CRISPR/Cas9系统,精准地切割BCL11A基因的红细胞特异性增强子区域(GATA1位点)。利用非同源重组(NHEJ)产生indel,破坏该增强子,降低BCL11A在红细胞中的表达水平,从而特异性提高HbF在红细胞中的表达。
解除抑制:这个被破坏的增强子无法再驱动BCL11A蛋白在红细胞中的有效表达。BCL11A蛋白是一种抑制γ-珠蛋白表达的转录因子,而γ-珠蛋白是胎儿血红蛋白(HbF)的核心组成部分。因此,BCL11A水平的下降,就解除了对γ-珠蛋白的抑制。
产生疗效:γ-珠蛋白被重新激活表达,与α-珠蛋白结合形成大量胎儿血红蛋白。HbF不具有导致镰变的特性,能有效替代功能异常的成人血红蛋白,从而减轻或消除患者的症状。
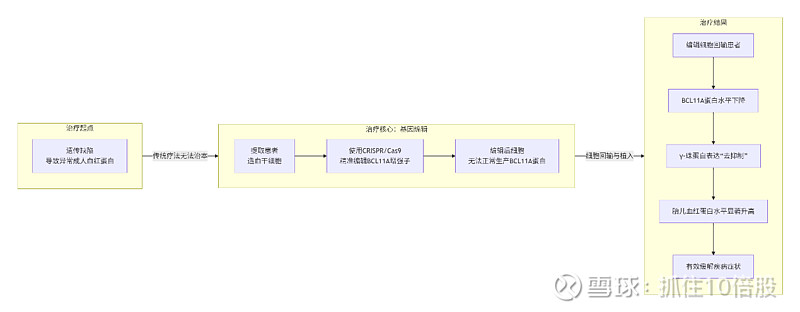
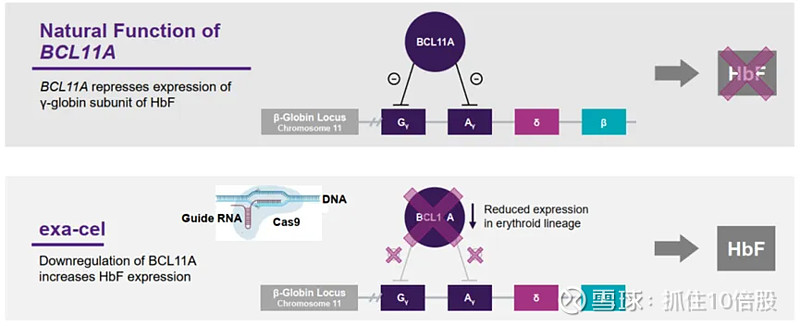
详情可参考公众号文章- Exa-cel:深度了解全球首款CRISPR/Cas9基因编辑疗法
CTX310
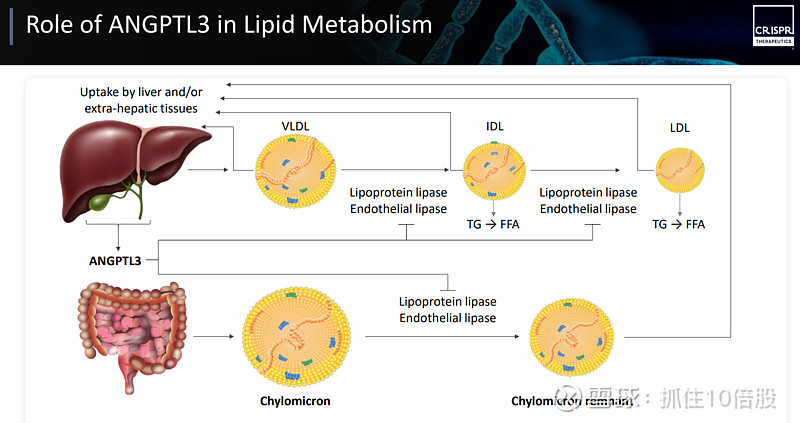
ANGPTL3(血管生成素样蛋白3)是一个主要在肝脏表达的分泌型蛋白,其核心功能是扮演“血脂刹车”的角色,它通过抑制两个关键酶来调节血脂:
抑制脂蛋白脂酶:这是降低甘油三酯的限速酶。ANGPTL3抑制其活性,会阻碍富含甘油三酯的脂蛋白(如VLDL)被分解和清除,导致血液中甘油三酯和低密度脂蛋白胆固醇水平升高。
抑制内皮脂酶:该酶负责水解高密度脂蛋白胆固醇。ANGPTL3抑制其活性,会减少高密度脂蛋白胆固醇的降解。
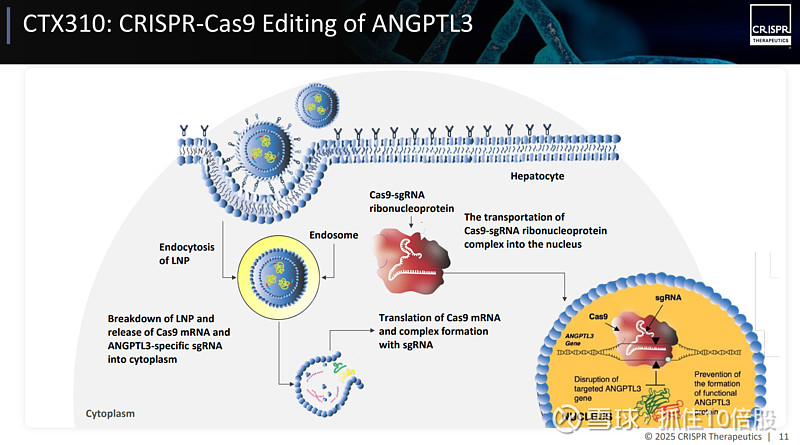
CTX310是一种在研的体内CRISPR/Cas9基因编辑疗法,旨在通过单次静脉注射永久性编辑肝细胞中的ANGPTL3基因,以治疗高脂血症等脂质代谢紊乱疾病。采用脂质纳米颗粒(LNP)技术,将CRISPR/Cas9组件靶向递送至肝细胞,实现精准编辑。
一期临床:
开放性、多中心、Ⅰ/Ⅱ期研究,旨在评估 CTX310 在纯合子家族性高胆固醇血症(HofH)、杂合子家族性高胆固醇血症(HeFH)、严重高甘油三酯血症(sHTG)或混合型血脂异常患者中的安全性和有效性。

这15名患者分别患有家族或非家族性高胆固醇血症(LDL-C升高)、高甘油三酯血症(TG升高)和混合型高脂血症(同时升高),他们此前已尝试过各类降脂疗法,但仍未得到有效控制,其中6人已发展为ASCVD。
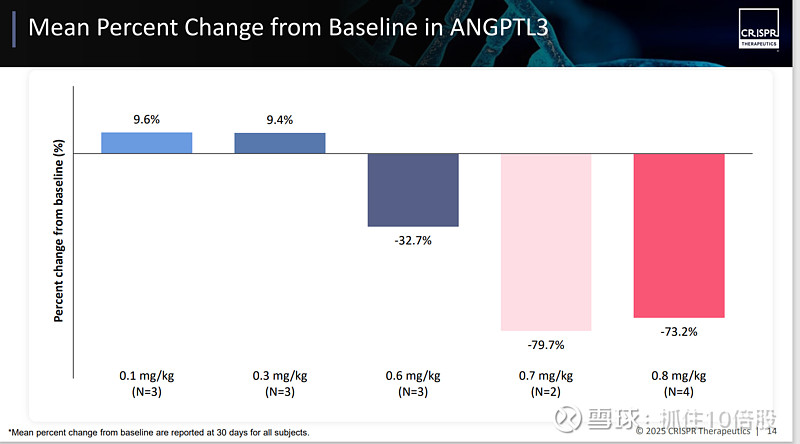
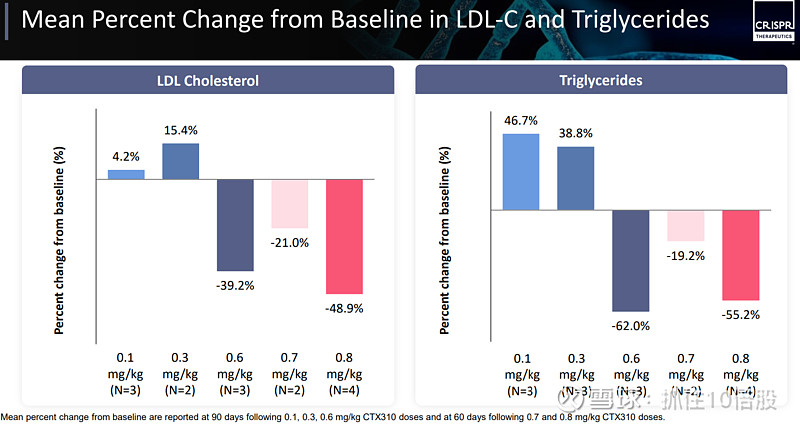
结果显示,患者的ANGPTL3、非高密度脂蛋白胆固醇(非HDL-C)、载脂蛋白B(ApoB)、载脂蛋白CⅢ(Apo CIII)展现出显著的下降趋势。尽管这项研究规模较小,但低密度脂蛋白胆固醇(LDL-C)的降低幅度约为 50%,甘油三酯的降低幅度约为 55%。
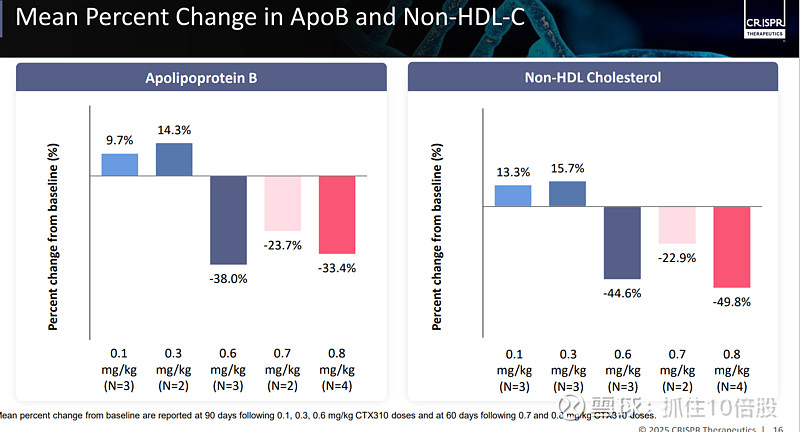
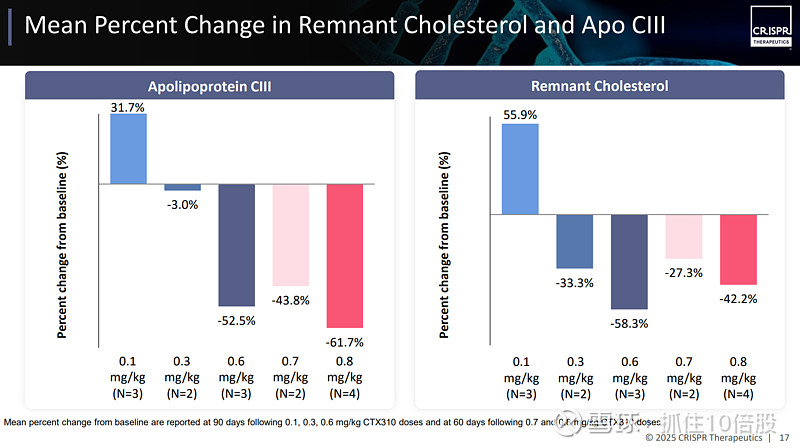
CTX320
Lp(a) 是一种类似于低密度脂蛋白的脂蛋白,由肝细胞合成并分泌出来。 流行病学研究、孟德尔随机化研究以及全基因组关联研究均表明,血浆脂蛋白(a)水平升高会增加动脉粥样硬化性心血管疾病的风险。血液中脂蛋白(a)水平升高所带来的遗传风险会在一个人的一生中逐渐累积,而且这种风险无法通过生活方式的改变或目前已批准的治疗方法得到有效降低。
从单个颗粒的角度来看,Lp(a) 的致动脉硬化作用是 LDL 的 6 倍之多,这凸显了 Lp(a) 是药物干预治疗的关键靶点。礼来也针对该靶点开发了小分子抑制剂Muvalaplin。
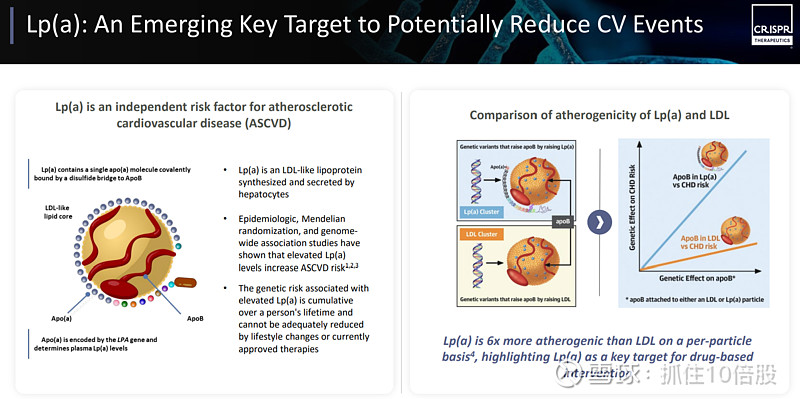
CTX320是一款处于临床阶段的体内基因编辑疗法,旨在通过单次给药,持久降低 Lp(a)水平,以预防心血管疾病。CTX320利用脂质纳米颗粒递送。单次使用 CTX320 药物剂量便能显著降低Lp(a)水平(非人灵长类动物实验)
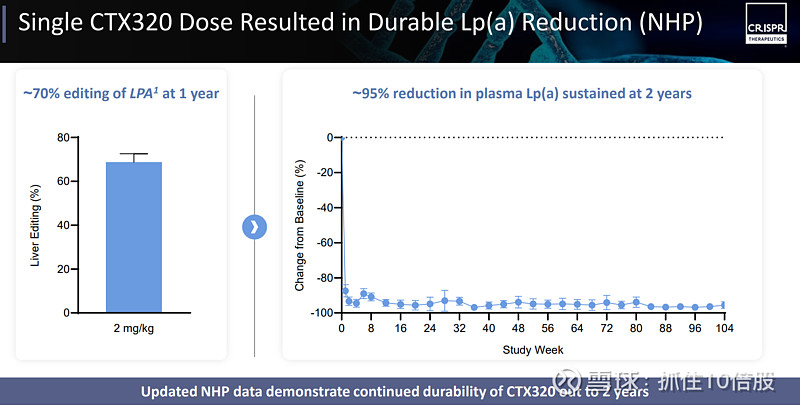
一期临床:
2025年6月公司宣布将数据更新推迟至2026年上半年。

CTX112
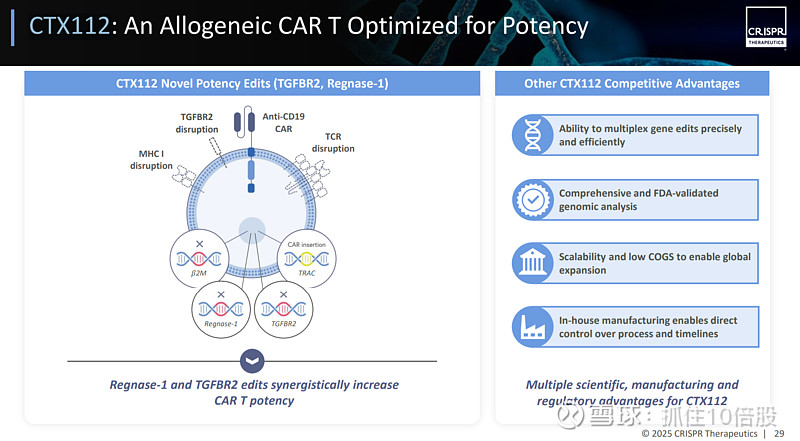
CTX112是公司研发的一款新一代“现货型”(同种异体)CAR-T细胞疗法,其核心设计是通过多重CRISPR-Cas9基因编辑来增强T细胞的抗肿瘤活性与持久性,目前正针对血液肿瘤和自身免疫性疾病进行临床试验。其主要针对以下四个基因进行细胞的工程化。
1.TRAC (T细胞受体α链)
a.敲除内源性TCR,防止移植物抗宿主病(GvHD)。
b.作为“安全港位点”,通过腺相关病毒(AAV)载体在此精准插入靶向CD19的CAR基因,实现稳定、均一的表达。
2. B2M (β2-微球蛋白)
敲除后移除细胞表面的MHC I类分子,降低CAR-T细胞被患者自身T细胞识别和清除的风险,有助于延长存活时间。
3. TGFBR2 (转化生长因子β受体2)
敲除后使CAR-T细胞抵抗肿瘤微环境中抑制性TGF-β信号的影响,维持其杀伤功能。
4.Regnase-1 (ZC3H12A)
敲除这一重要的RNA降解酶,可显著增强CAR-T细胞的扩增能力和功能持久性,防止耗竭,这是提升疗效的关键编辑之一。
通过创新性的多重基因编辑(特别是敲除Regnase-1和TGFBR2),旨在解决同种异体CAR-T细胞持久性不足和易受肿瘤微环境抑制的核心挑战。CTX112早期临床数据显示出有前景的疗效和可控的安全性。
CTX112目前正在两项独立的临床试验中推进:
1.血液肿瘤(r/r B细胞恶性肿瘤)
临床阶段:1/2期(剂量递增与扩展)。
目标疾病:包括大B细胞淋巴瘤(LBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)等。
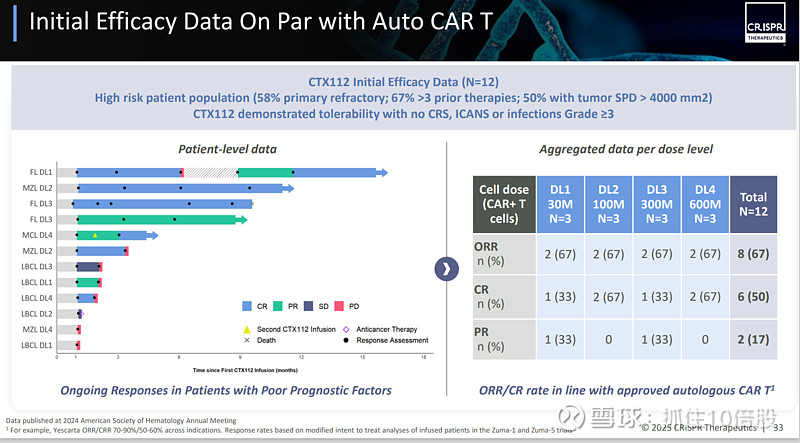
关键数据(2024 ASH年会):在已报道的9-12例重度经治患者中,客观缓解率(ORR)为67%,完全缓解率(CRR)为50%,且在各剂量水平和亚型中均观察到应答。其中1例患者在接受最低剂量输注一年后仍保持完全缓解。
监管进展:2024年12月,FDA授予CTX112用于治疗r/r FL和MZL的 “再生医学先进疗法”(RMAT)资格,以加速其开发和审评。
2.自身免疫性疾病
临床阶段:1期(剂量评估)。
目标疾病:包括难治性系统性红斑狼疮(SLE)、系统性硬化症(SSC)和特发性炎性肌病(IIM)。
研究状态:试验已于2025年3月开始,正在招募患者,预计主要完成时间为2031年底。

CTX211、CTX213等针对一型糖尿病患者的创新细胞疗法也在开发当中。

04总结
公司的核心竞争力可以概括为:以首创的基因编辑平台为基石,构建了覆盖多个重大疾病领域且持续创新的产品管线,并已成功迈入商业化阶段。
核心技术优势
公司的技术护城河主要体现在两个层面:
基因编辑平台的临床验证:其开发的CASGEVY是全球首款获得监管批准(包括美国FDA)的CRISPR/Cas9基因编辑疗法,用于治疗镰状细胞病和β地中海贫血。这不仅是科学上的里程碑,更是对公司技术平台安全性、有效性的最高级别验证,为后续管线的开发扫清了监管和科学认知上的障碍。
差异化递送技术与持续创新:公司同时布局并优化了两种递送路径。在体外(ex vivo)编辑方面,拥有成熟的非病毒细胞工程技术。在更具挑战性的体内(in vivo)编辑领域,公司正积极开发其专有的脂质纳米颗粒(LNP)递送技术,以靶向肝脏等器官。这种对核心递送工具的掌控,是其拓展治疗领域的关键。
管线布局与商业前景
公司的管线策略明确,具有清晰的梯度:
商业化引擎(CASGEVY):作为当前唯一的收入来源,其商业化正在全球加速。截至2025年第三季度,已有近300名患者被转诊,超过165名患者完成细胞采集。公司预计2025年新患者数量将显著增长。针对5-11岁儿童的研究也已完成入组。
临近商业化的潜力支柱:下一代“现货型”CAR-T细胞疗法是管线重点。特别是靶向CD19的CTX112,已在针对复发难治性B细胞恶性肿瘤和自身免疫性疾病(如系统性红斑狼疮)的临床试验中显示出积极数据,并获得FDA授予的再生医学先进疗法(RMAT)认定。公司已与印度公司建立合作,共同开发CTX112,以拓展新兴市场。
中长期增长驱动力:体内基因编辑疗法瞄准了受众更广的心血管代谢疾病。靶向ANGPTL3的CTX310和靶向Lp(a)的CTX320均已进入1期临床。这部分管线如果成功,将把公司带入一个市场规模巨大的全新领域。
总而言之,CRISPR Therapeutics已成功从一家前沿技术公司,转型为拥有已验证平台、多元化管线、明确商业路径和强大财务支撑的综合型生物制药公司。其未来发展,短期看CASGEVY的商业化放量,中期看CTX112等下一代细胞疗法的临床突破与上市,长期则取决于体内基因编辑技术能否在常见病治疗中复制成功。