破壁者Denali:穿越血脑屏障,引领神经疗法新时代

核心摘要
Denali Therapeutics是一家专注于利用其专有的Transport Vehicle™平台开发可穿越血脑屏障疗法的生物制药公司。公司正处在从研发向商业化转型的关键节点:其核心产品tividenofusp alfa(DNL310,用于治疗亨特综合征)的上市申请已获FDA优先审评,PDUFA目标日期为2026年4月5日,有望成为首个获批的转铁蛋白受体介导的穿越血脑屏障疗法。凭借已验证的平台技术、超过10亿美元市场潜力的近在咫尺的管线,以及可持续至2028年的充足现金储备,Denali正致力于解决神经退行性疾病和溶酶体贮积症领域巨大的未满足临床需求。
1. 公司概况
1.1 公司定位与愿景
Denali Therapeutics成立于2015年,总部位于美国加利福尼亚州南旧金山。公司以其创始人Ryan Watts博士(前基因泰克神经科学负责人)为首,汇聚了顶尖的科研与商业团队。公司的核心使命是:“将生物疗法的力量传递至全身,包括大脑,从而改变罹患严重疾病患者的生活。” 其战略是通过攻克药物递送的最大障碍之一——血脑屏障,在神经科学这一高风险高回报的领域建立长期护城河。
1.2 核心投资亮点
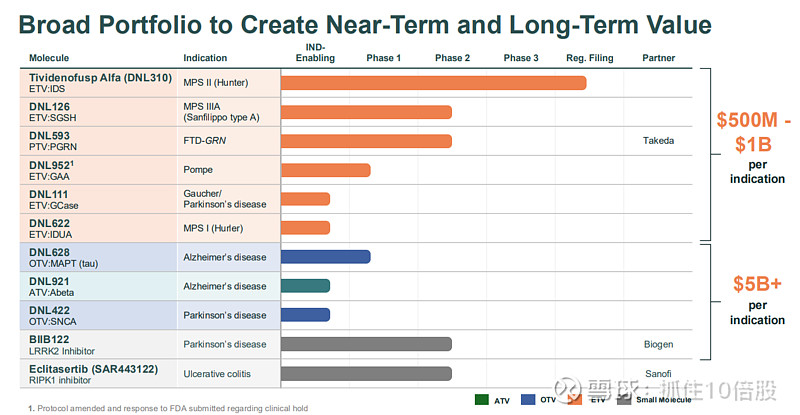
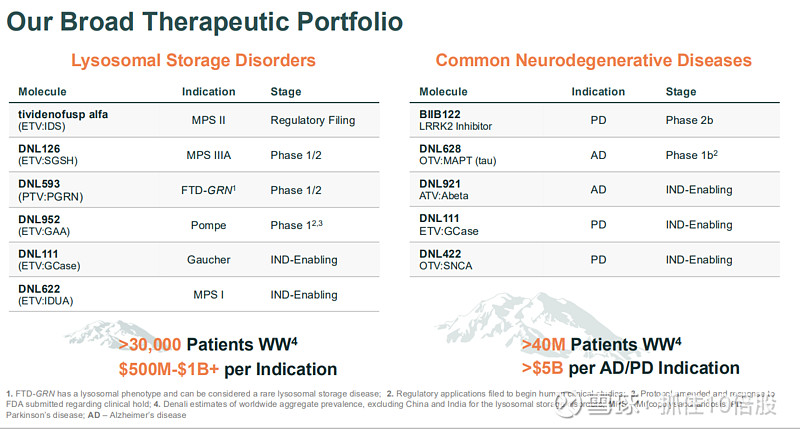
临近商业化拐点:首个产品tividenofusp alfa预计2026年获批上市,第二个产品DNL126(MPS IIIA)预计2027年获批,两者合计市场机会超过10亿美元。
平台技术经过临床验证:TransportVehicle™是行业内临床验证最充分、数据最丰富的BBB递送技术,已在超200名受试者中施用超11,000剂,积累了超过5年的长期给药经验。
深具潜力的管线组合:管线覆盖溶酶体贮积症(LSDs)和常见神经退行性疾病(如阿尔茨海默病、帕金森病),多个项目已进入临床中后期,具备持续产生催化剂的潜力。
稳健的财务状况与执行力:截至2025年9月30日,现金储备约8.73亿美元,加上与Royalty Pharma达成的2.75亿美元特许权融资,预计现金可支撑运营至2028年。公司通过建立内部GMP生产基地(盐湖城)显著提升了开发效率和成本控制能力。
2. 核心技术:Transport Vehicle™平台分析
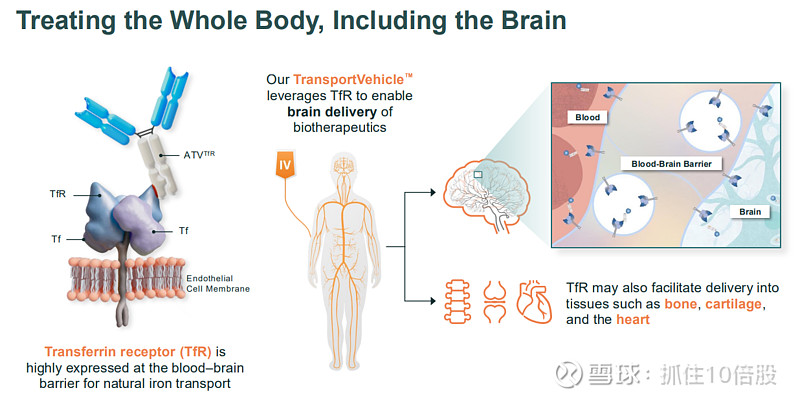
血脑屏障是保护大脑的关键结构,但也阻碍了超过98%的小分子药物和几乎所有大分子药物进入大脑,这是神经疾病药物开发失败率极高的重要原因。Denali的解决方案是其工程化的Transport Vehicle™平台。
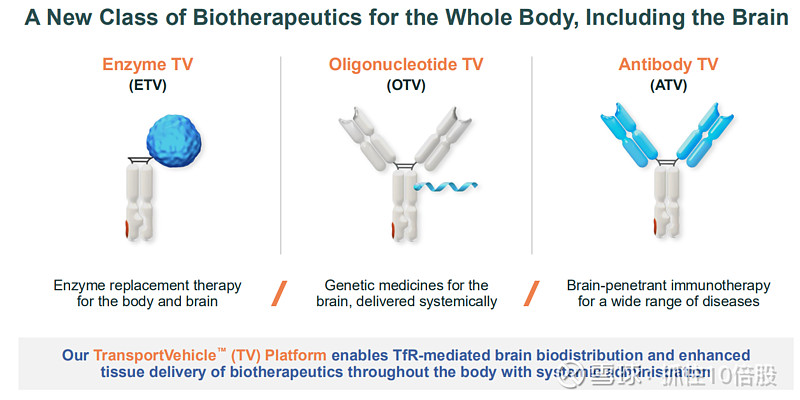
作用机制:该平台巧妙地利用了大脑内皮细胞上高表达的转铁蛋白受体。TfR在人体内负责运输铁,其介导的内吞作用是将物质从血液运入大脑的天然途径。TV技术将治疗性“货物”(酶、抗体、寡核苷酸)与经过工程化改造的、能结合TfR的抗体Fc片段融合,从而“搭乘”这一自然运输系统进入大脑和全身其他难以到达的组织(如骨骼、软骨)。
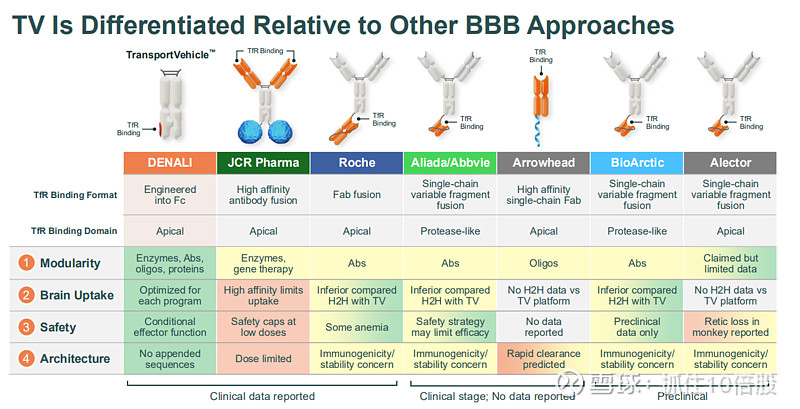
传统Fab工程化脑递送方法,有以下缺点:连接剂化学性质会严重影响稳定性 ;完全发挥效应会增加贫血的风险;高亲和力、双价结合会导致大脑生物分布不佳;对天然蛋白质的低效模拟会增加免疫原性风险。
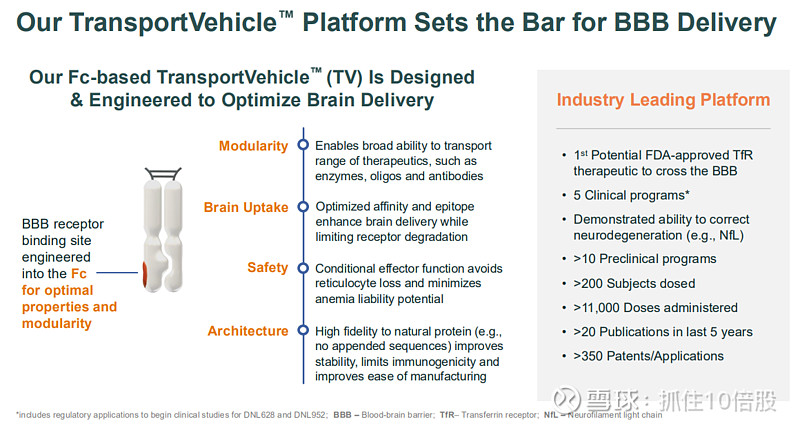
平台优势:Denali强调其TV平台在多个维度上的差异化设计
1.模块化:可递送酶(ETV)、抗体(ATV)、寡核苷酸(OTV)和蛋白质(PTV)等多种治疗模式。
2.优化的脑摄取:通过对TfR结合亲和力和表位的精细调控,实现最大化脑内分布,同时限制受体降解。
3.独特的安全性设计:采用“条件性效应功能”架构,在保留部分疗效所需功能的同时,避免了靶向TfR可能导致的严重贫血风险。
4. 稳定的架构:TfR结合域被工程化到抗体的Fc片段中,而非简单附加,这提高了分子的稳定性、降低了免疫原性风险,并简化了生产工艺。
3. 产品管线与研发进展
Denali的管线战略清晰:以经过临床验证的酶替代疗法在溶酶体贮积症领域建立商业基础和市场信誉,同时以更具潜力的抗体和寡核苷酸疗法向阿尔茨海默病、帕金森病等常见神经退行性疾病市场进军。
3.1 溶酶体贮积症管线:ETV平台的核心验证
溶酶体贮积症是一组超过50种的遗传性代谢疾病,由不同溶酶体酶或转运蛋白缺陷引起,通常以常染色体隐性或X连锁方式遗传,临床表现高度异质。细胞通过吞噬作用摄入外界颗粒,通过自噬清除受损细胞器,通过受体介导的胞吞作用摄取大分子物质,这些物质最终在溶酶体中被降解。早期内体与高尔基体来源的囊泡融合形成晚期内体,再与溶酶体融合完成降解过程。此机制对维持细胞稳态至关重要,其功能障碍会导致代谢废物积累,引发疾病。
溶酶体贮积症由特定溶酶体酶缺陷引起,导致底物在全身(包括大脑)积累。传统酶替代疗法(ERT)无法入脑,而约2/3的溶酶体贮积症(LSDs)伴有中枢神经系统症状。
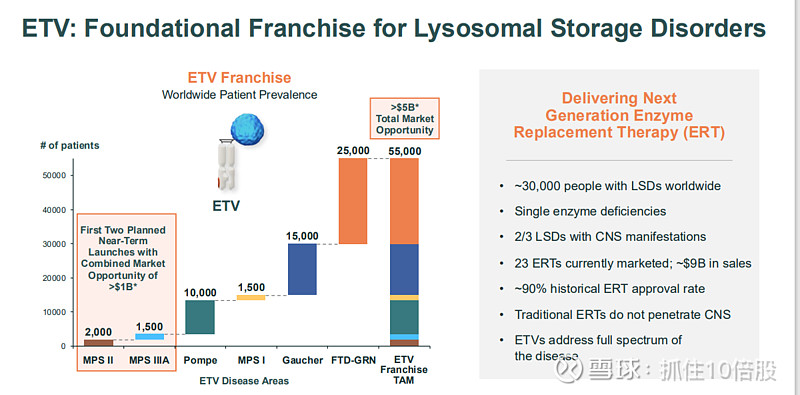
1. Tividenofusp alfa (DNL310, ETV:IDS) - 亨特综合征
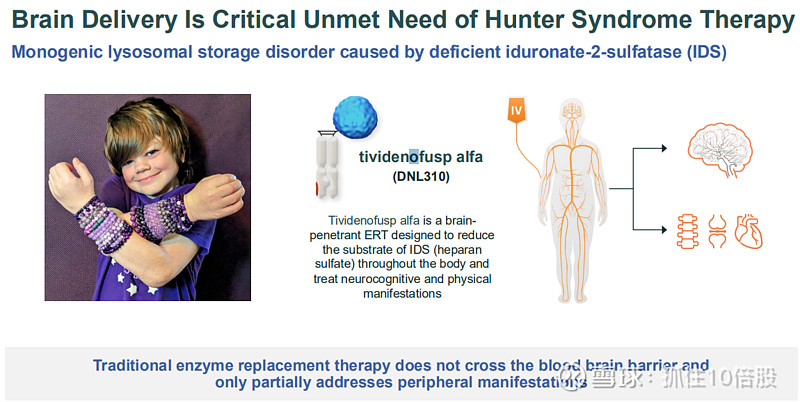
亨特综合征,即黏多糖贮积症II型(MPS II),是一种罕见的溶酶体贮积病,属于遗传性代谢障碍疾病。它由X染色体上的IDS基因突变引起,导致体内缺乏艾杜糖醛酸-2-硫酸酯酶,进而无法分解肝素(glycosaminoglycans heparan)和硫酸皮肤素(dermatan sulfate)等糖胺聚糖(glycosaminoglycans,GAGs),造成其在细胞内不断累积。
该病为X连锁隐性遗传,因此主要影响男性,发病率约为每10万名男婴中有1例。患者通常表现为进行性身体发育迟缓、面容粗陋、关节僵硬等症状,目前尚无根治方法,但可通过酶替代疗法(如Elaprase®)延缓病情进展。该病仍有大量未满足的临床需求。例如现有药物不会大量穿过血脑屏障,因此不会改变神经退行性病变的发展进程。
Tividenofusp alfa (DNL310)是一种能够穿透大脑的酶替代疗法,旨在降低体内所有部位的 IDS(硫酸乙酰肝素)含量,并治疗神经认知及身体方面的症状。
作用机制:将患者缺失的艾杜糖醛酸-2-硫酸酯酶与Transport Vehicle™融合。通过TV与BBB上的TfR结合,将酶递送至大脑和全身组织,清除累积的糖胺聚糖。
关键临床结果(基于1/2期开放标签研究,N=47):
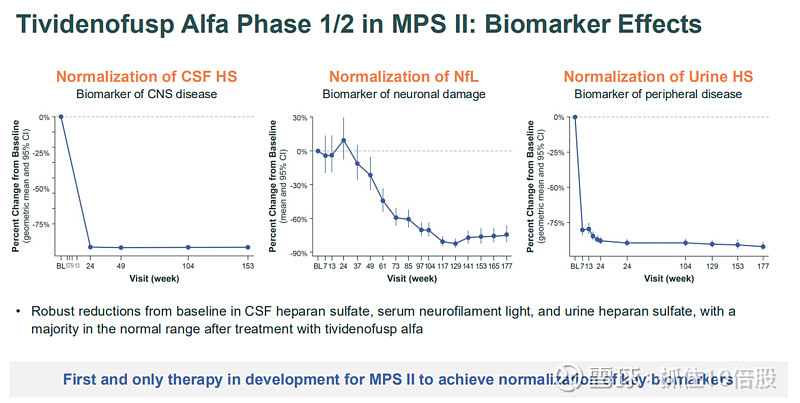
生物标志物正常化:治疗显著降低了疾病的关键生物标志物。
1.脑脊液硫酸乙酰肝素:降低>90%,绝大多数患者达到正常范围。
2.血清神经丝轻链:显著降低并趋于正常,提示神经轴突损伤减少。
3.尿液硫酸乙酰肝素:显著降低。
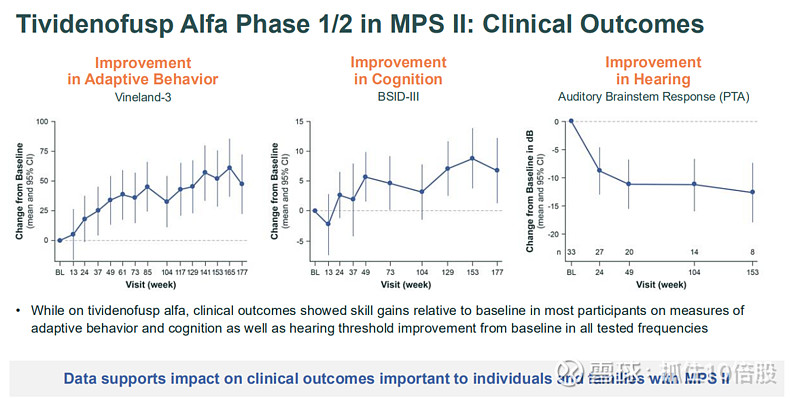
临床终点改善:在探索性临床终点中观察到积极趋势。
适应性行为:Vineland-3综合评分在治疗期间保持稳定或显示改善。
认知功能:在年轻患者中,Bayley-III认知评分相对于基线有所提高。
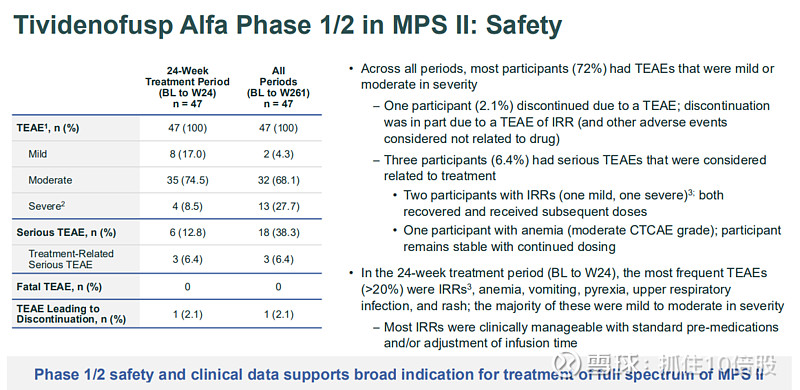
安全性:最常见不良事件为输注相关反应和贫血,大多数为轻中度且可临床管理。这是支持其加速上市申请(BLA)的核心数据集。
2/3期临床正在进行,以支持全球审批。

2. DNL126 (ETV:SGSH) - MPS IIIA
MPS IIIA - Sanfilippo综合征,A 型
这是一种常染色体隐性遗传疾病,由 N-硫酸葡糖胺硫酸水解酶(SGSH)缺乏所致,该酶也被称为磺胺酶或肝素硫酸酯酶。这会导致硫酸肝素的逐渐积累。 在四种类型的MPS IIIA中最为常见,约占病例总数的 70%。总体发病率估计为每125,000 例新生儿中出现 1 例。目前尚无获批疗法。
DNL126将缺失的N-磺基葡糖胺磺基水解酶通过TV递送至大脑,以清除中枢神经系统中积累的硫酸乙酰肝素。
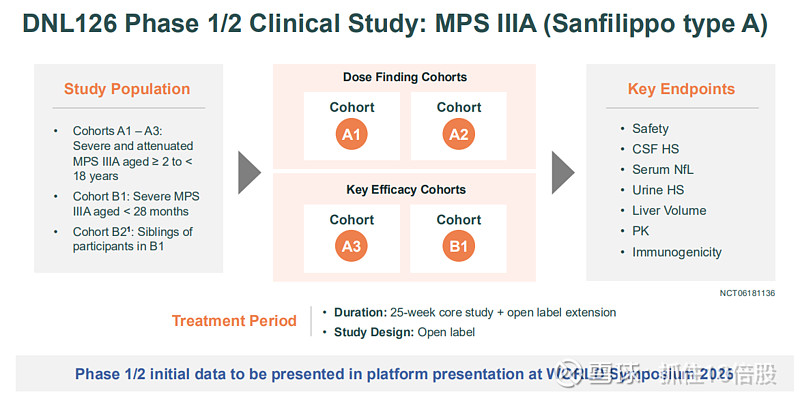
关键临床进展:1/2期研究已完成入组。公司已披露初步概念验证数据,显示脑脊液HS显著降低并达到正常化。基于此生物标志物数据,FDA已同意其通过加速批准路径申报,预计2027年提交BLA。

3. DNL952 (ETV:GAA) - 庞贝病
庞贝病(Pompe Disease)是一种渐进性、遗传决定的罕见病,以常染色体隐性方式遗传。其病因是GAA基因双等位突变,导致溶酶体中α-葡萄糖苷酶缺乏,进而引起细胞内糖原在溶酶体中不断累积。过去该病也被称为酸性麦芽糖酶缺乏症或糖原贮积病II型。
庞贝病属于溶酶体贮积症的一种,主要影响肌肉组织,尤其是心肌和骨骼肌。患者常表现为肌无力、呼吸困难和心脏肥大等症状,严重者可危及生命。根据发病年龄不同,可分为婴儿型、儿童型和晚发型。目前治疗手段包括酶替代疗法(ERT),可显著改善部分患者的症状。
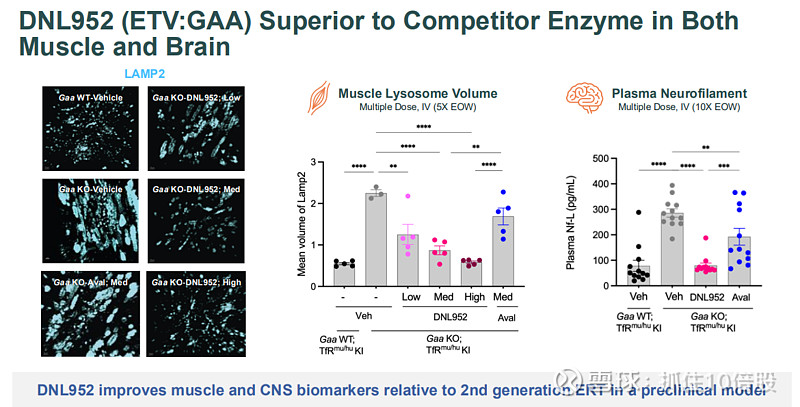
DNL952将酸性α-葡萄糖苷酶通过TV递送,旨在增强酶向肌肉(传统ERT难以充分递送的组织)和大脑的递送。
临床前证据:在庞贝病小鼠模型中,DNL952在降低肌肉溶酶体体积和血浆神经丝轻链(神经损伤标志物)方面,效果优于第二代标准疗法avalglucosidase alfa。已提交IND申请。
3.2 神经退行性疾病管线:ATV/OTV平台的未来潜力
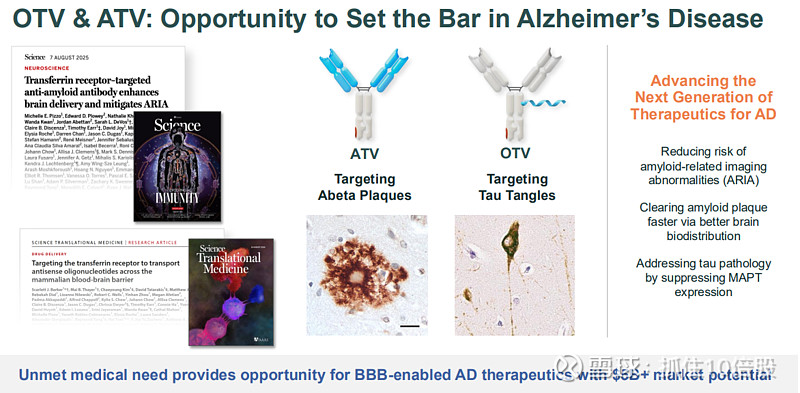
1. 阿尔茨海默病组合:双重靶向策略
Denali采取同时靶向Aβ(淀粉样蛋白斑块)和Tau(神经纤维缠结)的策略,两者是AD病理的核心。
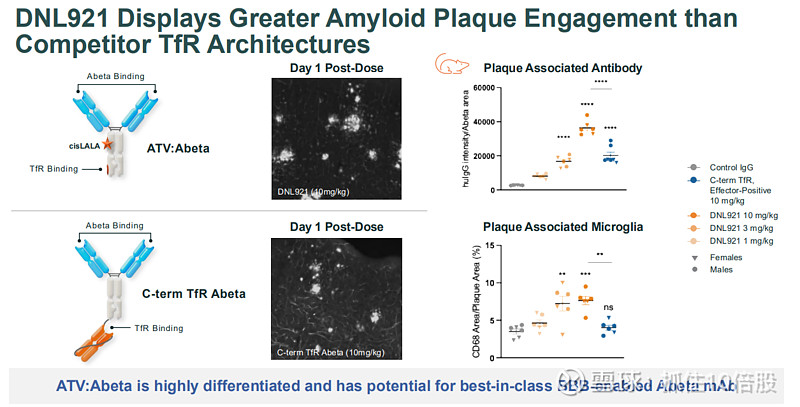
DNL921 (ATV:Abeta) - 靶向淀粉样蛋白,将抗Aβ抗体与TV融合,通过TfR介导高效入脑,旨在更快速、更安全地清除斑块。

关键差异化(临床前数据):
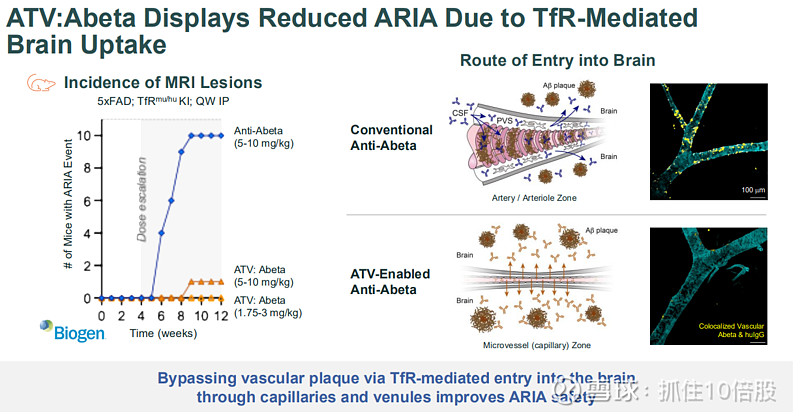
安全性潜力(降低ARIA风险):发表于《科学》的研究表明,TV介导的抗体通过毛细血管路径均匀入脑,避免了传统抗体在血管周聚集剥离斑块引发的淀粉样蛋白相关性影像异常(ARIA)。在动物模型中,ATV:Abeta的ARIA发生率显著低于传统抗Aβ抗体。
高效脑渗透与斑块结合:临床前成像显示,DNL921在大脑皮层和海马体等深部区域的分布和斑块结合能力优于第一代抗Aβ抗体。
DNL628 (OTV:MAPT) - 靶向Tau蛋白
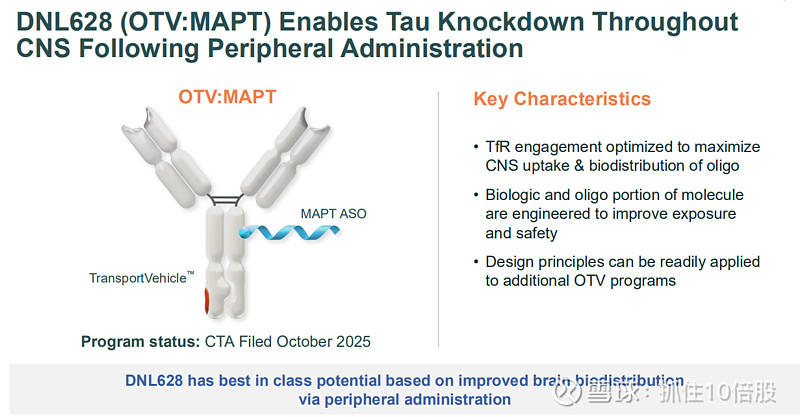
DNL628将靶向MAPT(编码Tau蛋白的基因)的反义寡核苷酸与TV融合,通过静脉给药抑制大脑中所有Tau蛋白的生成。
关键差异化(临床前数据):
给药途径与分布优势:与传统需要侵入性鞘内注射的ASO疗法相比,静脉给药的OTV能在全脑(包括皮层、小脑、脊髓)实现更均匀的分布,避免了鞘内注射造成的浓度梯度。
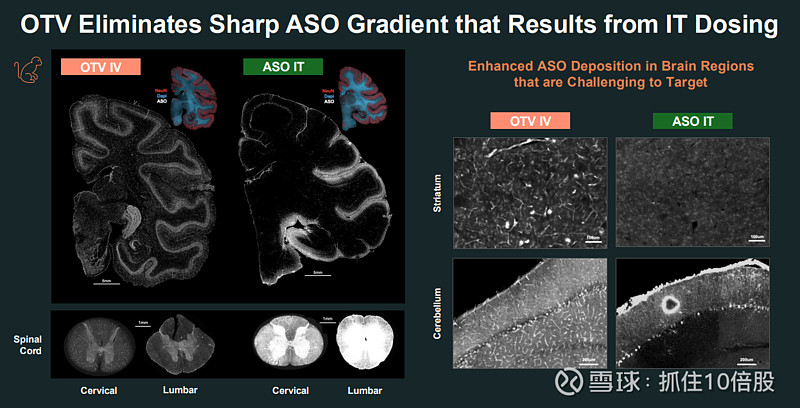
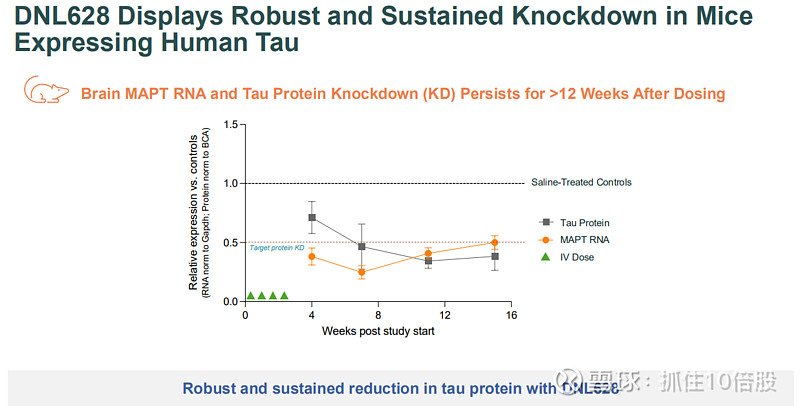
强效且持久的敲降:在表达人Tau的小鼠模型中,单次给药可实现超过12周的、大于50%的脑内Tau蛋白持续敲降。
2. 帕金森病及其它项目
BIIB122/DNL151:口服小分子LRRK2激酶抑制剂,与Biogen合作开发。作用机制为调节溶酶体功能,2b期LUMA研究数据预计2026年读出。
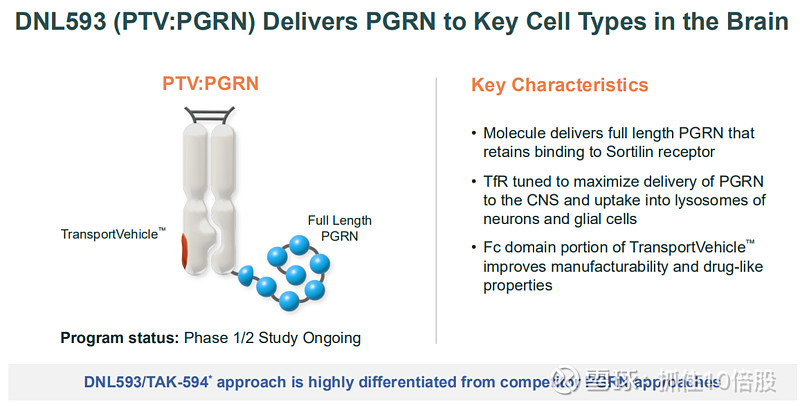
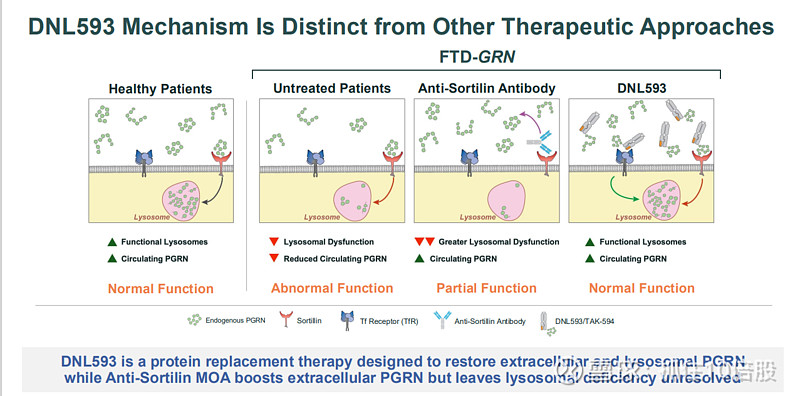
DNL593 (PTV:PGRN):与武田合作,通过TV递送全长颗粒蛋白酶前体(PGRN),用于治疗GRN基因突变导致的额颞叶痴呆。机制为补充大脑中缺失的功能性颗粒体蛋白,修复溶酶体功能。1/2期研究正在进行中。
管线总结与展望
Denali的管线呈现出清晰的“技术验证-商业落地-领域拓展”逻辑。其TV平台的作用机制已在ETV上得到人体临床验证,为ATV和OTV项目的推进奠定了坚实基础。未来1-2年,DNL310的商业化表现、DNL126的审批以及AD管线的临床概念验证数据,将是驱动公司价值演变的关键里程碑。
4. 财务与战略分析
4.1 财务状况
现金储备:截至2025年Q3,现金、现金等价物及有价证券约8.729亿美元。
额外融资:2025年12月4日,与Royalty Pharma达成2.75亿美元的特许权融资协议,将在DNL310获批后分批获得。
支出与亏损:2025年Q3净亏损1.269亿美元。研发费用因新生产基地运营而增加;管理费用因商业化准备而大幅提升。
现金跑道:管理层预计,结合现有现金、潜在的特许权融资以及未来的产品收入,资金可支持运营至2028年。
4.2 战略合作伙伴
合作是Denali战略的核心,有助于分摊成本、降低风险并借助巨头力量。
Takeda:共同开发DNL593 (PTV:PGRN) 用于治疗FTD-GRN。
Biogen:共同开发BIIB122用于帕金森病。
Sanofi:曾合作开发RIPK1抑制剂(已终止)。
5. 结论与展望
Denali Therapeutics是一家拥有突破性平台技术、清晰商业路径和强大执行能力的生物科技公司。其TV平台不仅在科学上得到同行评审和临床数据的验证,更在商业上找到了从罕见病切入、逐步进军大众市场的务实路径。
近期催化剂明确:2026年4月DNL310的获批决定是公司价值重估的最重要节点。随后,DNL126在2027年的进展、阿尔茨海默病项目DNL628和DNL921的临床数据读出,都将构成持续的催化剂流。
长期想象空间巨大:如果其TV平台在阿尔茨海默病、帕金森病等常见病中获得成功,公司的市场天花板将被极大打开。公司“由点到面”的战略——从单一酶替代到多模态递送,从罕见病到常见病——为其长期增长描绘了蓝图。
总而言之,Denali正处于一个“平台价值释放”的关键阶段。对于能够承受生物科技股高波动性的投资者而言,Denali提供了一个参与下一代神经疾病疗法创新的机会,其风险与回报均值得重点关注。