靶向递送的力量:Dyne Therapeutics的FORCE平台与下一代神经肌肉疾病疗法

1. 公司核心概览:使命与愿景
Dyne Therapeutics Inc. 是一家临床阶段的生物技术公司,其核心使命是成为全球领先的神经肌肉疾病治疗公司,通过靶向递送技术,为遗传性神经肌肉疾病患者提供可测量的、有意义的功能改善。
战略聚焦:公司专注于解决生物技术领域最重大的挑战之一——如何高效、广泛地将治疗性载荷递送至目标组织(尤其是肌肉和中枢神经系统),从而实现功能性疗效。
发展历程:自2019年成立以来,Dyne已从研究阶段快速推进至临床后期,其针对1型强直性肌营养不良(DM1)和杜氏肌营养不良症(DMD)的两个主要项目已进入注册性临床试验阶段。

2. 核心技术引擎:FORCE™ 平台
FORCE™平台是Dyne Therapeutics赖以生存和发展的核心驱动力,它是一个模块化、可编程的寡核苷酸靶向递送系统,旨在系统性解决生物制药领域的一大核心挑战:如何将治疗性大分子(如寡核苷酸)高效、选择性地递送至目标组织(特别是肌肉和中枢神经系统),同时最大程度减少全身暴露带来的脱靶效应和毒性。
2.1 平台设计原理与工程学逻辑
FORCE平台的构建基于对细胞生物学和受体介导内吞作用的深刻理解,其设计遵循精密的工程学逻辑,由三个核心模块协同工作:
1. 靶向模块:抗TfR1抗原结合片段(Fab)
靶点选择:平台靶向转铁蛋白受体1(Transferrin Receptor 1, TfR1/CD71)。该受体在快速分裂的细胞和具有高代谢需求的细胞上高表达,包括骨骼肌、心肌、平滑肌细胞,以及血脑屏障(BBB)的内皮细胞。这使其成为递送至肌肉和中枢神经系统的理想门户。
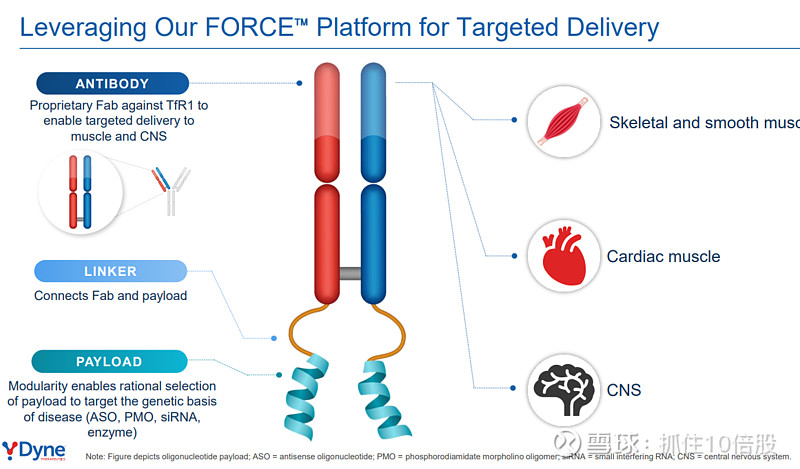
分子形式选择:与使用全长抗体的竞争技术不同,FORCE平台采用抗原结合片段(Fab),。这一设计具有多重优势:
降低免疫原性:Fab分子量小,缺乏抗体的Fc段,可能减少不必要的免疫反应。
改善组织渗透:较小的尺寸有利于在目标组织间质中更有效地扩散。
最小化受体功能干扰:经过工程化设计的Fab旨在以高亲和力结合TfR1,但最大限度地减少对TfR1天然铁转运生理功能的阻断,从而避免潜在的、由铁稳态紊乱引起的贫血等副作用。这是其安全性设计的核心考量。
2. 连接模块:可调控的化学连接子
连接子稳定连接Fab与治疗载荷,其化学性质经过精心设计,以确保复合物在血液循环中的稳定性。
更关键的是,连接子需要在细胞内吞后,在特定的胞内环境(如内体/溶酶体的酸性环境)中能够高效裂解或释放治疗载荷,这是决定“有效递送”最后一步成败的关键。平台数据显示的高效组织积累,暗示其连接子设计成功实现了载荷的胞内释放。
3. 治疗模块:可理性选择的治疗性载荷
平台的核心优势在于其“载荷无关性”。它可作为“特洛伊木马”,搭载多种作用机制的寡核苷酸:
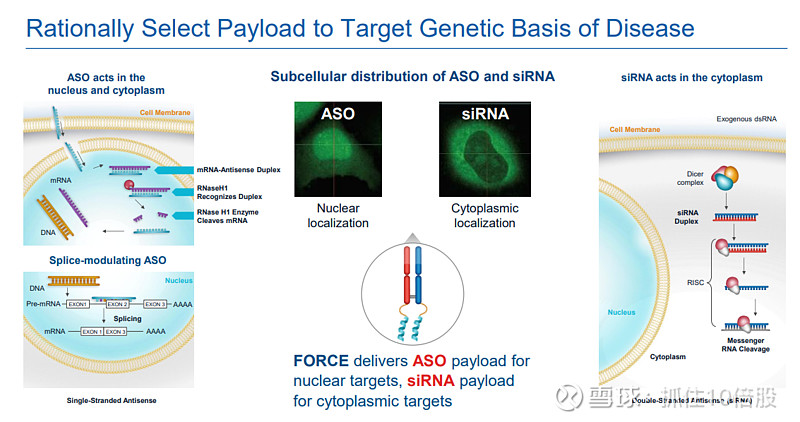
反义寡核苷酸(ASO):用于核内靶点(如DYNE-101靶向核内DMPK RNA),通过RNase H1机制降解RNA或通过空间位阻调控剪接。
吗啉代寡核苷酸(PMO):用于外显子跳跃(如DYNE-251),通过空间位阻作用改变pre-mRNA剪接。
小干扰RNA(siRNA):用于细胞质内靶点(如DYNE-302靶向DUX4 mRNA),通过RNAi机制沉默基因表达。
其他:理论上可扩展至mRNA、基因编辑工具或酶替代疗法中的功能酶。
2.2 作用机制与药代动力学/药效学(PK/PD)优势
FORCE平台的作用机制是一个多步骤的生物学过程,其每一步都经过优化以创造差异化优势:
1. 高效靶向与内化:静脉给药后,FORCE复合物通过Fab与广泛分布于肌肉和BBB毛细血管内皮细胞上的TfR1结合,启动受体介导的内吞作用,被快速内化进入细胞。
2. 细胞内运输与载荷释放:复合物进入内体运输途径。工程化的连接子在酸性内体环境中被激活,释放出治疗性寡核苷酸载荷,使其能够逃逸至细胞质或进一步进入细胞核(针对ASO)。
3. 组织选择性积累与长效性:由于TfR1在目标组织的高表达和持续循环,以及可能涉及的组织滞留机制,FORCE递送的寡核苷酸在肌肉和中枢神经系统中的暴露量(AUC)和滞留时间显著延长。这直接转化为两个关键临床优势:
更强的疗效:更高的组织药物浓度带来更深刻的靶点 engagement(如DMPK敲减>33%,抗肌萎缩蛋白表达>5%)。
更便利的给药方案:延长的组织半衰期支持每4周(DMD)或每8周(DM1)给药一次,相较于竞品(每周或每两周)大幅提升患者依从性和生活质量。
2.3 临床前与临床验证数据
平台的效力已通过头对头对比研究得到充分验证:
递送效率的量化提升:在非人灵长类动物研究中,FORCE递送系统与“裸”寡核苷酸相比,在关键组织的药物浓度实现数十至上百倍的提升。例如,在心脏组织中,DYNE-251(FORCE-PMO)的浓度是裸PMO的35倍;在深部脑区,FORCE递送的ASO浓度可达裸药的25倍。
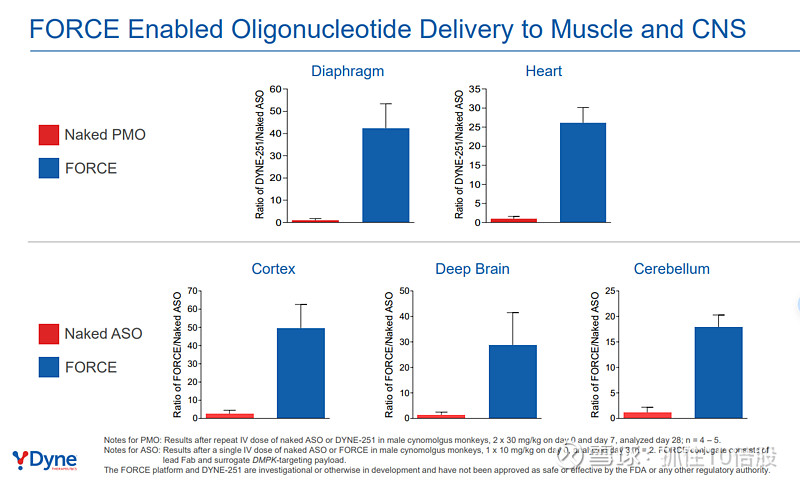
临床转化的直接印证:DYNE-251在DMD患者中实现5.46%正常水平的抗肌萎缩蛋白表达,这一定量结果远超现有非靶向递送技术(通常<1%),从临床层面直接证实了FORCE平台在递送效率上的颠覆性突破。
2.4 平台扩展性与竞争壁垒
FORCE平台的战略价值不仅在于当前管线,更在于其强大的可扩展性所构建的长期竞争壁垒:
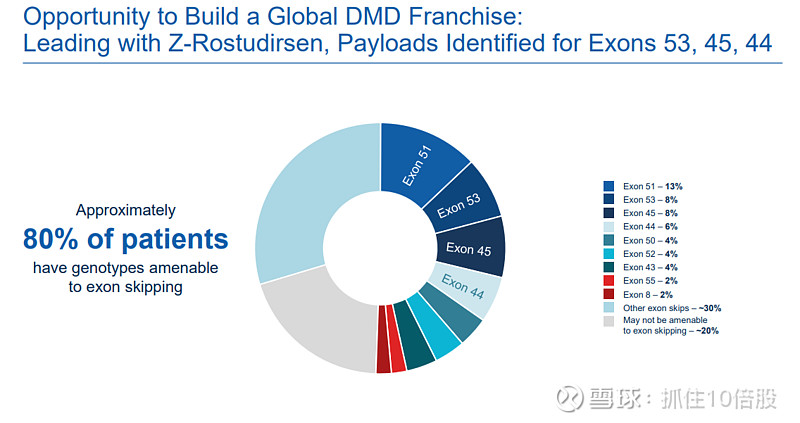
1. 管线快速扩展:单一的、经过验证的抗TfR1 Fab可作为通用“底盘”,通过连接不同的治疗载荷,快速生成针对不同遗传靶点的新候选药物。这显著降低了早期开发的不确定性和成本。例如,在DMD领域,除DYNE-251(外显子51)外,针对外显子53、45、44的后续管线已快速跟进。
2. 疾病领域拓展:平台已验证对肌肉和CNS的靶向能力,为其向更广泛的疾病领域拓展奠定了基础。除神经肌肉疾病外,未来可能涵盖中枢神经系统疾病(CNS)、心脏代谢性疾病等存在高未满足医疗需求且传统药物难以递送的领域。
3. 技术与专利壁垒:Fab的序列、连接子化学、载荷选择与偶联工艺等构成了一套复杂且专有的技术体系,形成了深厚的知识产权护城河。
2.5 总结:平台的核心价值主张
FORCE平台并非一个简单的药物偶联技术,而是一个经过理性设计、机制明确、且已被临床数据验证的“靶向寡核苷酸递送操作系统”。它的成功在于将生物学洞察(TfR1的分布与功能)、蛋白质工程(Fab优化)、化学技术(连接子)和疾病生物学(载荷选择) 进行了深度融合,最终实现了从“有药难送”到“精准强效”的跨越,成为Dyne公司当前估值和未来成长的核心基石。
3. 核心研发管线与关键临床数据
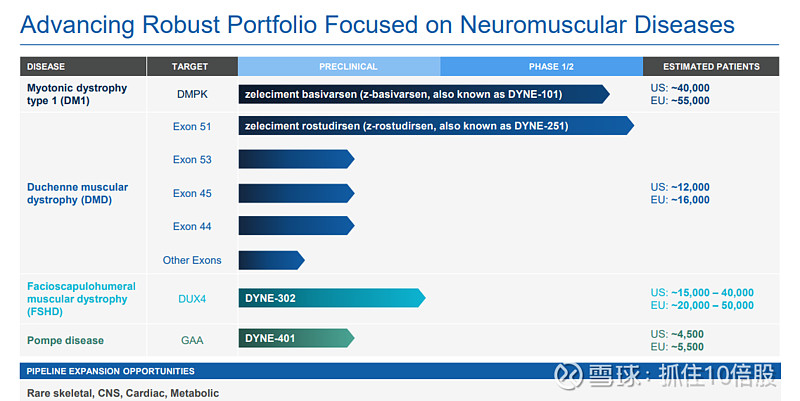
Dyne的研发管线深度聚焦于由特定基因缺陷驱动的严重神经肌肉疾病,其两大核心资产(DYNE-101和DYNE-251)均已获得临床概念验证(POC),并进入旨在支持加速批准的注册扩展研究阶段。以下是对其临床数据及设计的解析。
3.1 核心后期管线总览
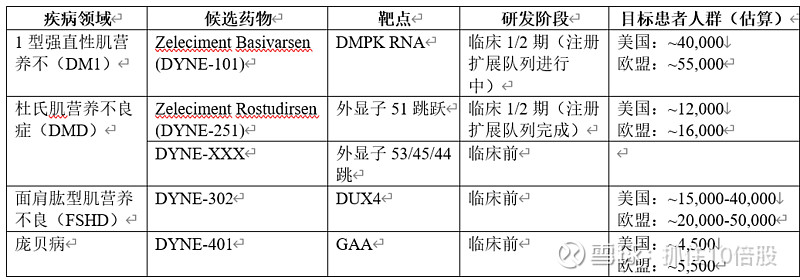
3.2 Zeleciment Basivarsen (DYNE-101):针对1型强直性肌营养不良 (DM1) 的潜在“Best-in-Class”疗法
3.2.1 疾病机制与治疗策略
DM1由DMPK基因3’非翻译区CTG重复序列异常扩增引起。该突变转录产生的毒性CUG重复RNA在细胞核内形成 foci,隔离肌肉盲样(MBNL)剪接因子,导致全身性mRNA剪接错误,进而引发多系统症状。
DYNE-101是一种经FORCE平台递送的、靶向核内DMPK RNA的反义寡核苷酸(ASO)。其设计旨在通过RNase H1机制降解毒性RNA,释放MBNL蛋白,从而从根源上纠正剪接异常。
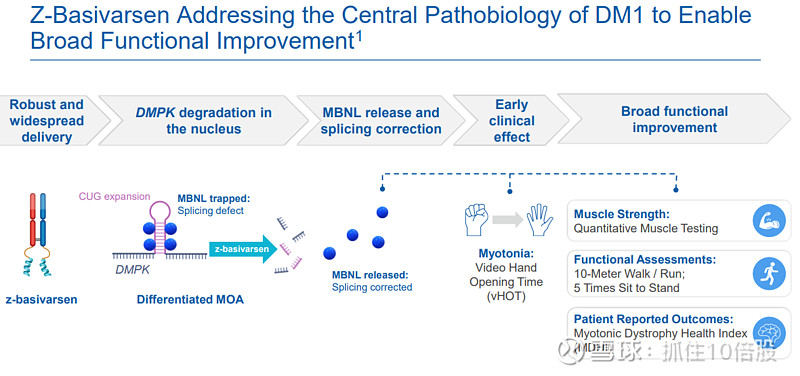
3.2.2 ACHIEVE临床试验关键数据
ACHIEVE是一项全球性、安慰剂对照、剂量递增的Ⅰ/Ⅱ期研究,包含多剂量递增(MAD)、长期扩展(LTE)和注册扩展(REC)队列。
药效学生物标志物——早期、深度应答
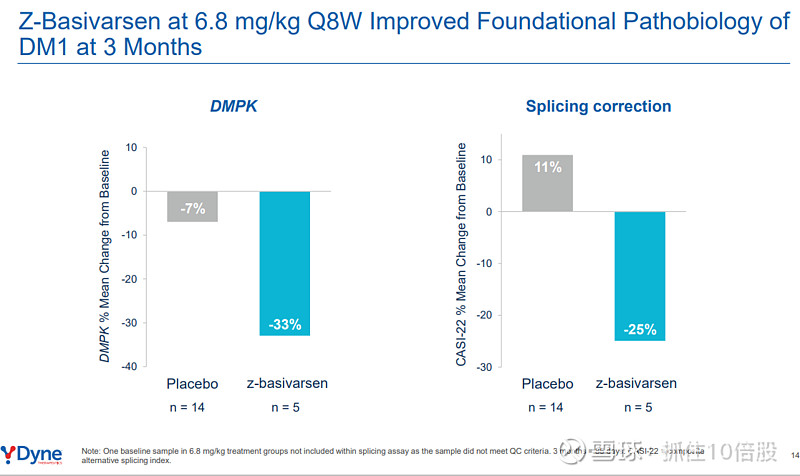
DMPK RNA敲减:在注册剂量6.8 mg/kg Q8W组,治疗3个月(85天)后,肌肉中DMPK RNA水平较基线平均降低约33%,而安慰剂组无变化。这直接证明了FORCE平台将ASO高效递送至肌细胞核并成功 engagement 靶标。
剪接校正:使用复合剪接指数(CASI-22,一种包含22个关键错误剪接事件的生物标志物)评估,同一时间点治疗组显示剪接模式向健康方向显著逆转,平均改善约25%,与DMPK降低同步,证明了其病理修正作用。
临床疗效终点——多维度、持续的功能改善
a. 主要临床终点:强直性改善
视频手部张开时间(vHOT) 是衡量手部肌强直(DM1标志性症状)的客观定量指标。6.8 mg/kg Q8W组在治疗3、6、12个月时,vHOT(中指)较基线分别改善约2.9秒(38%)、3.0秒(39%),改善幅度在3个月时即已完全显现并长期维持。安慰剂组在6个月内无改善。
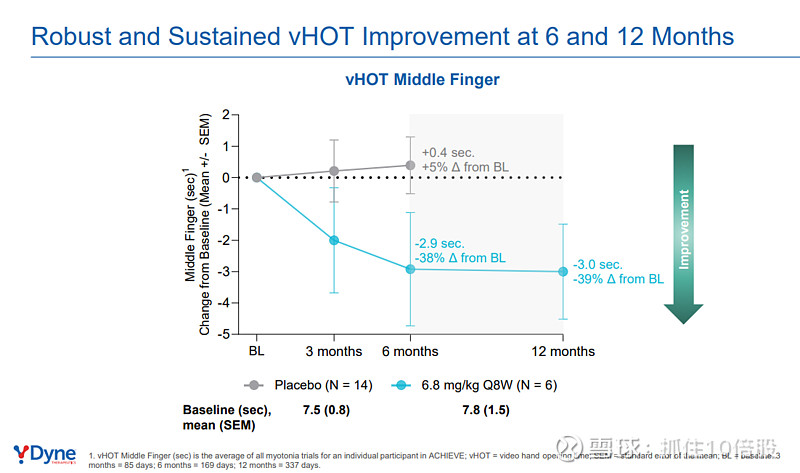
b. 关键次要终点:肌力与功能
定量肌肉测试(QMT)总评分:治疗12个月后,QMT总评分(评估全身多组肌肉的等长收缩力量)较基线提升10.3%预测值(相对改善20.1%),且改善幅度从第6个月到第12个月持续增加(5.2%预测值 vs. 10.3%预测值),表明疗效的持续累积效应。值得注意的是,安慰剂组在同期呈下降趋势(-2.0%预测值)。
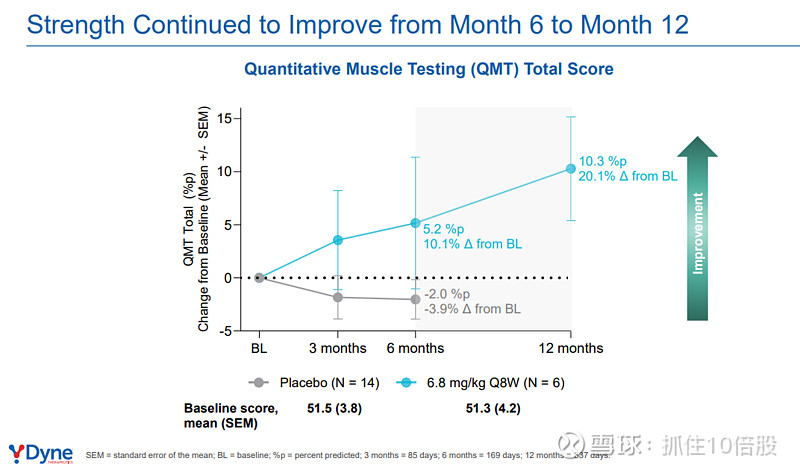
分项肌群分析:改善具有广泛性,在近端(肘屈/伸、膝屈/伸)和远端(手握力、踝背屈)肌群中均有体现。例如,膝伸肌力量在12个月时改善达14.4%预测值(相对改善27.7%)。
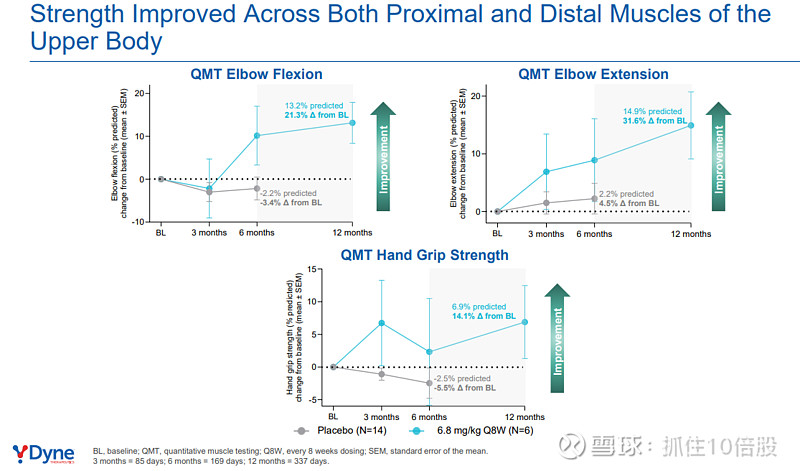
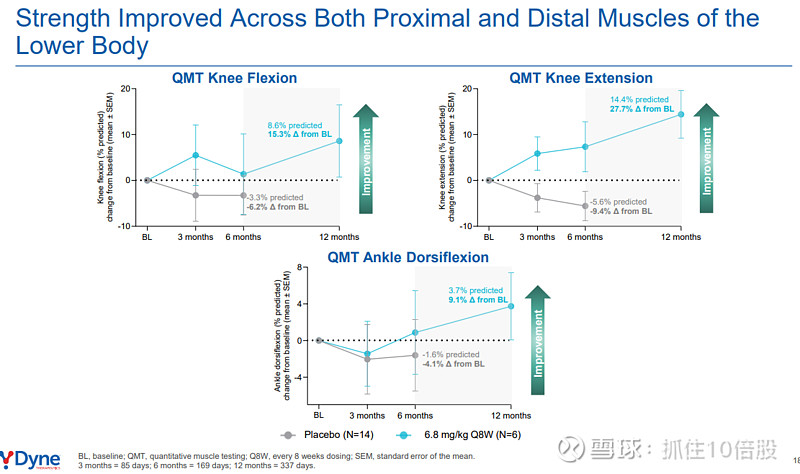
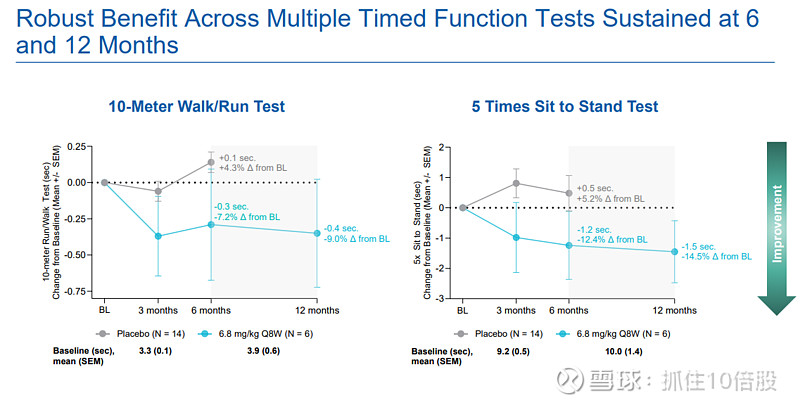
定时功能测试:
10米步行/跑:速度持续改善,12个月时较基线提速约0.4米/秒。
5次坐立测试:耗时持续减少,12个月时缩短约1.5秒。
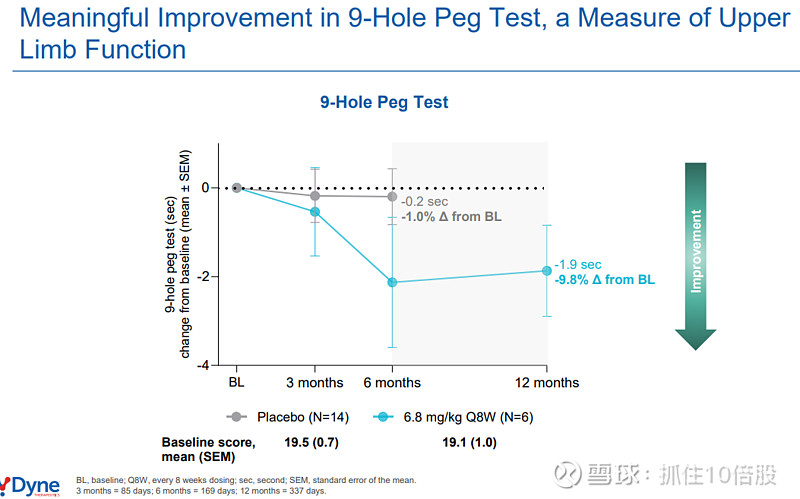
9孔钉测试(评估上肢灵巧度):耗时在12个月时减少约1.9秒(相对改善9.8%)。
c. 患者报告结局(PROs)与全局评估
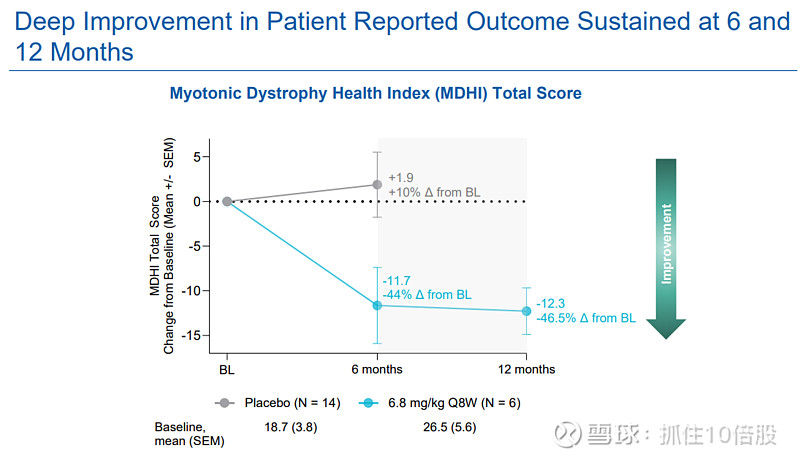
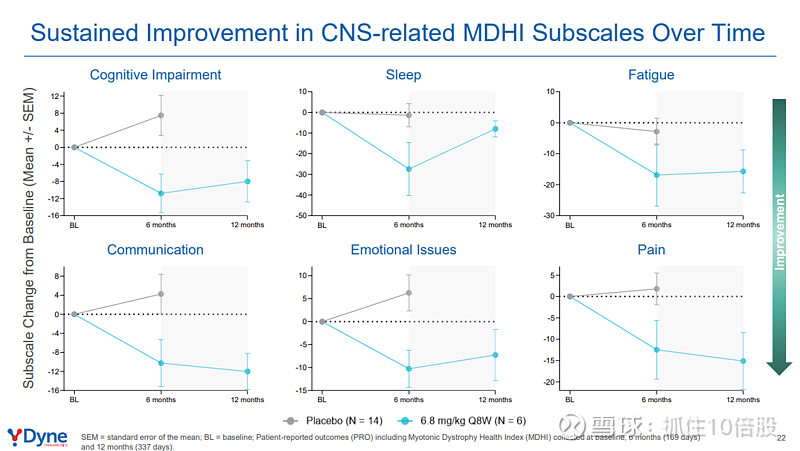
肌营养不良健康指数(MDHI):该疾病特异性生活质量量表总评分在治疗6个月和12个月时分别较基线改善11.7分和12.3分(相对改善均约45%),变化具有深度的临床意义。改善覆盖包括活动能力、上肢功能、认知、疲劳、睡眠、情绪和沟通等所有关键子量表,印证了药物对DM1多系统症状的广泛影响。
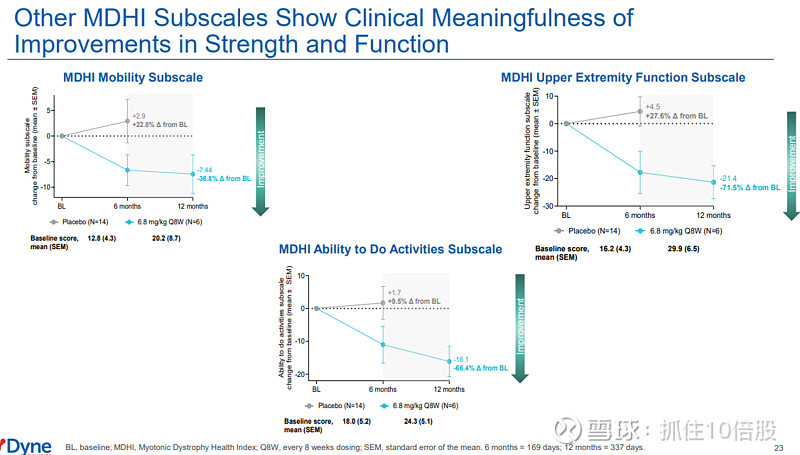
安全性特征
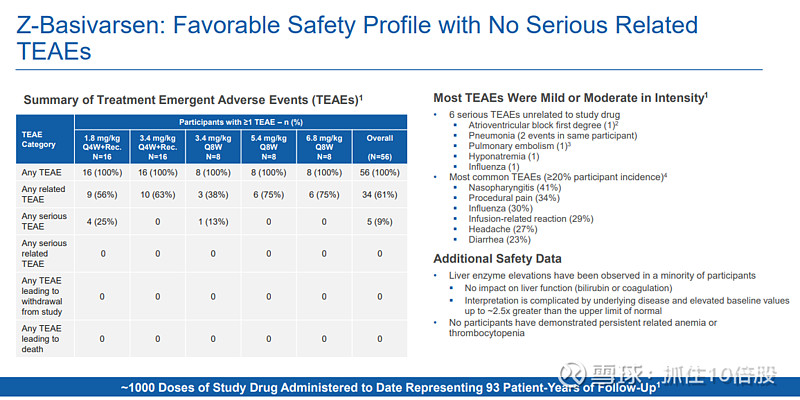
截至2025年4月23日数据,在所有剂量组(n=56,累计给药约1000剂,随访93患者-年)中,未发生与DYNE-101相关的严重不良事件(SAE),无导致停药或死亡的TEAE。
大多数TEAE为轻度或中度,最常见(≥20%)的包括鼻咽炎、程序性疼痛、流感、输注相关反应、头痛和腹泻。
观察到少数参与者出现一过性肝酶升高,但无伴随的胆红素或凝血功能异常,且需考虑DM1患者本身常伴有基线肝酶异常的背景。
3.2.3 注册路径与下一步计划
基于上述数据,公司已选定6.8 mg/kg每8周一次作为注册剂量。
目前正在进行的注册扩展队列计划入组60名患者(3:1随机),以6个月时vHOT的改善作为主要终点,支持向美国FDA提交加速批准申请,目标提交时间为2027年第三季度初。
同时,计划于2026年第一季度启动全球性III期确证性临床试验,以支持完全批准。
3.3 Zeleciment Rostudirsen (DYNE-251):针对杜氏肌营养不良症(DMD,外显子51跳跃)的潜在同类最优疗法
3.3.1 治疗策略与差异化优势
现有获批的外显子51跳跃疗法(如eteplirsen)虽可增加微量抗肌萎缩蛋白(通常<1%),但功能获益有限,且需每周给药。DYNE-251是一种经FORCE平台递送的磷酸二酰胺吗啉代寡聚物(PMO),旨在通过靶向递送和增强的组织滞留,实现更高水平、更持久的抗肌萎缩蛋白表达,并采用每4周一次(Q4W) 的更便利给药方案。
3.3.2 DELIVER临床试验关键数据(2025年12月8日)
药效学终点:前所未有的抗肌萎缩蛋白表达
在注册剂量20 mg/kg Q4W的注册扩展队列中,治疗6个月(25周)后,经肌肉含量校正的、以肌球蛋白重链(MHC)归一化的抗肌萎缩蛋白水平达到正常水平的5.46%(基线为0.83%),绝对增幅达4.63个百分点。与安慰剂组的差异具有高度统计学显著性(p < 0.0001)。
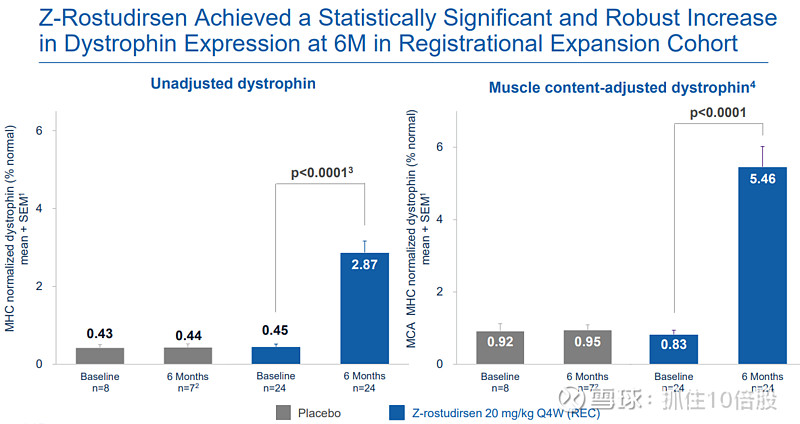
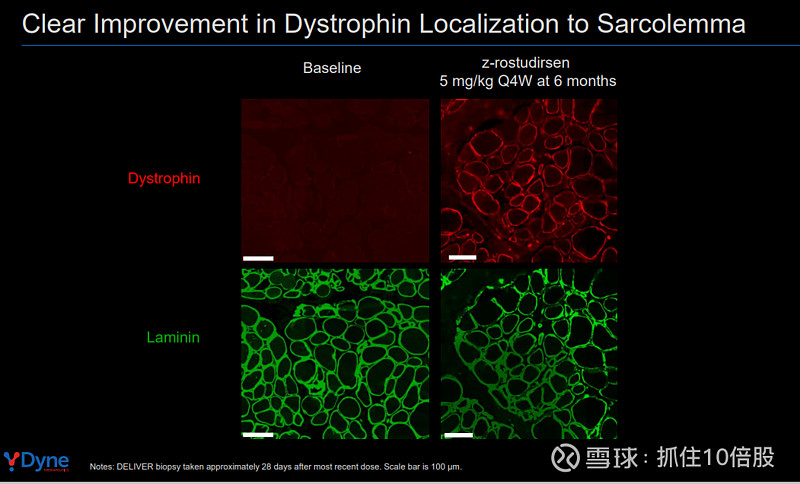
关键意义:这一蛋白表达水平显著超过现有已报道的同类疗法,并且免疫荧光染色证实,新生成的抗肌萎缩蛋白正确且连续地定位于肌纤维膜,这是其发挥稳定肌膜功能的结构基础。
临床功能终点:早期、广泛且持续的改善信号
DELIVER试验的预设统计分析计划未对功能终点进行正式假设检验,但所观察到的改善信号具有明确的临床相关性。
时间从仰卧位起身(TT Rise)速度:在可行走患者中,治疗组6个月时速度改善0.04次/秒,超过了文献报道的最小临床重要差异(MCID, 0.023次/秒),且与安慰剂组的差异达到名义上的统计学显著性(p<0.05)。
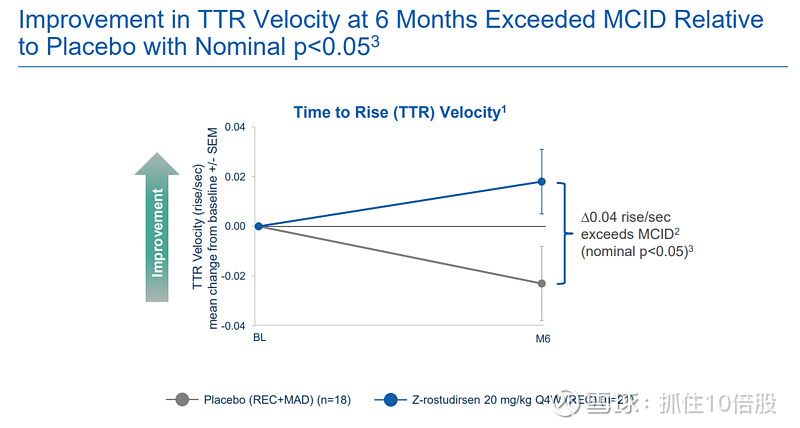
10米步行/跑(10MWR)速度:治疗组改善0.2米/秒,接近MCID(0.212米/秒),与安慰剂差异显著(p<0.05)。
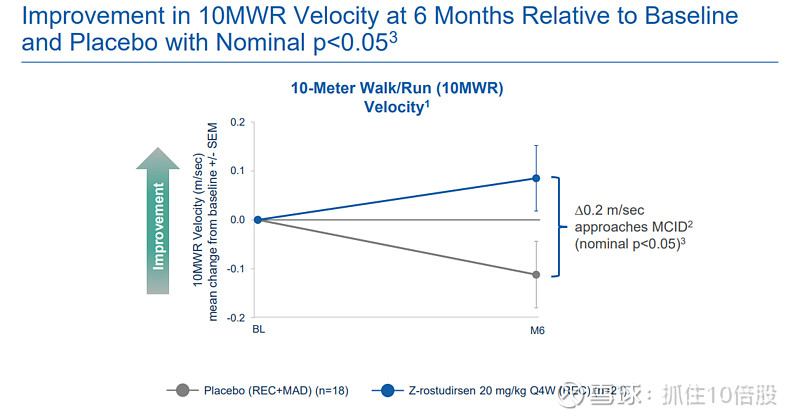
North Star Ambulatory Assessment(NSAA):治疗组总评分改善2.1分,接近MCID(≥2.32分)。(P34)
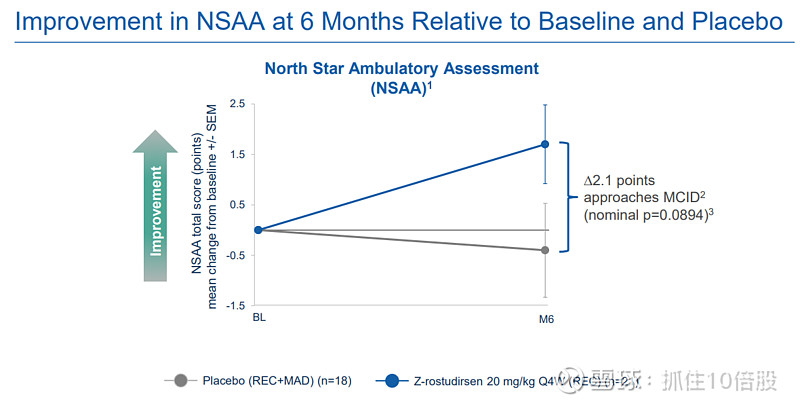
其他指标:95%百分位步速(SV95C)、上肢功能测试(PUL 2.0)均显示改善趋势,且用力肺活量占预测值百分比(FVC%p)在治疗组保持稳定,而在安慰剂组有所下降,提示对呼吸功能的潜在保护作用。
长期扩展数据:在MAD队列中,接受20 mg/kg Q4W治疗的患者,其TT Rise速度、10MWR速度、NSAA评分等的改善可持续至第24个月,表明疗效的持久性。
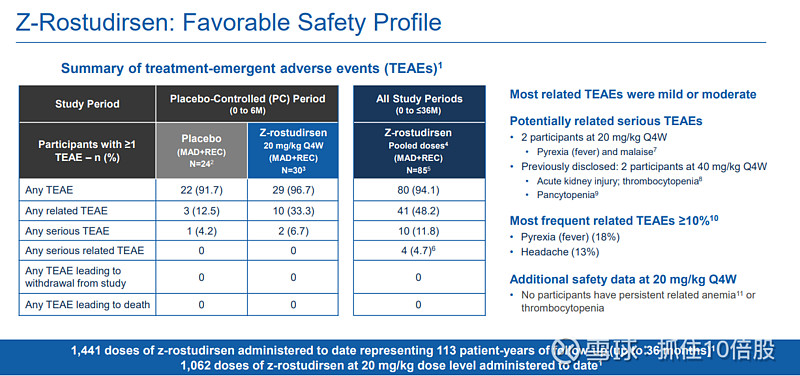
安全性特征
在20 mg/kg Q4W剂量组(n=30,截至2025年8月19日数据),未发生与药物相关的严重不良事件。
最常见的相关TEAE为发热(18%)和头痛(13%)。
关键安全性发现:在注册剂量下,未观察到与药物相关的持续性贫血或血小板减少症。这与使用全长抗TfR1抗体的某些竞争性技术平台形成差异,可能归因于DYNE所用Fab片段对TfR1铁转运功能的干扰较小。
3.3.3 注册路径与DMD产品线拓展
DELIVER研究的注册扩展队列已完成入组,并于2025年12月获得阳性顶线结果。
公司计划于2026年第二季度基于此数据向FDA提交加速批准申请,最早于2027年第一季度实现美国商业化。
Dyne正在利用FORCE平台快速拓展DMD产品线,针对外显子53、45和44的候选药物已进入临床前开发阶段,旨在未来覆盖绝大多数适用外显子跳跃疗法的DMD患者群体。

3.4其他管线
FSHD(DYNE-302)项目仍处于临床前研究。
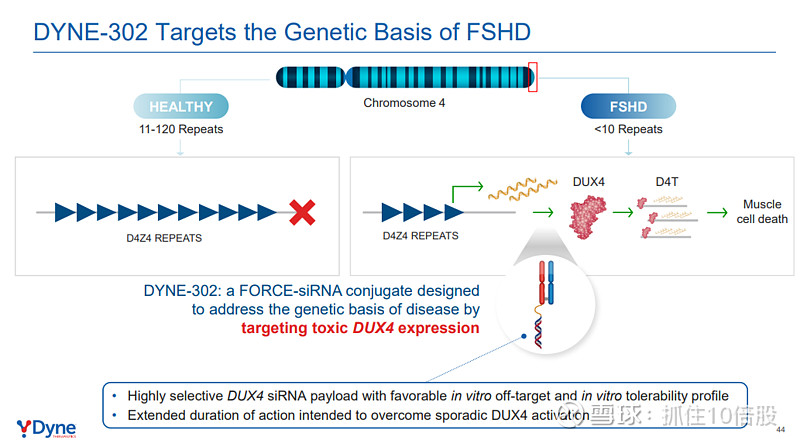
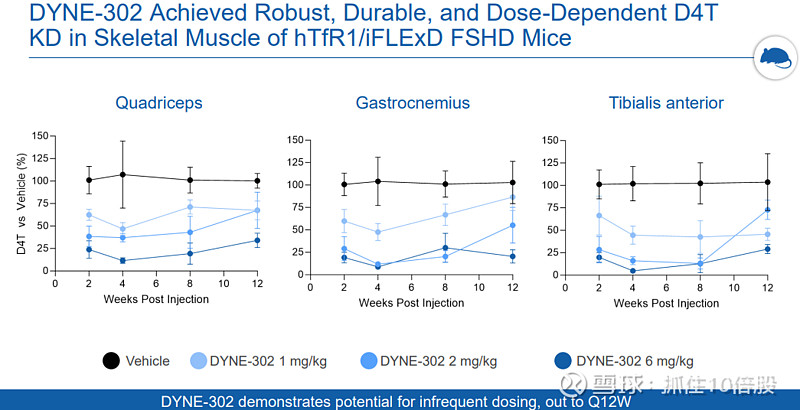
4. 商业化路径与财务现状
4.1 明确的商业化时间表
Dyne正积极向商业化组织转型,计划最早于2027年实现首个产品上市。
DYNE-251 (DMD):
2025年12月:注册扩展队列顶线结果公布(已实现)。
2026年第二季度:计划提交美国加速批准申请。
2027年第一季度:潜在美国上市(假设获得优先审评)。
DYNE-101 (DM1):
2026年第二季度初:计划完成注册扩展队列入组。
2027年第一季度:计划获得注册扩展队列数据。
2027年第三季度初:计划提交美国加速批准申请。
2028年第一季度:潜在美国上市。
4.2 稳健的财务状况
现金储备:截至2025年9月30日,公司拥有7.919亿美元的现金、现金等价物和有价证券。(P49)
资金续航能力:预计当前资金足以支持公司运营至2027年第三季度,覆盖多个关键的临床、监管和潜在商业启动里程碑。
资产所有权:所有研发资产均为公司全资拥有。

5. 未来扩展与战略展望
DMD产品矩阵拓展:除针对外显子51的DYNE-251外,公司已确定针对外显子53、45和44的后续候选药物,旨在构建覆盖约80%可跳跃外显子DMD患者的完整产品组合。
平台延伸潜力:FORCE平台的模块化特性使其可应用于更广泛的适应症,包括其他罕见骨骼肌疾病、中枢神经系统疾病、心脏和代谢疾病。
持续数据催化:公司在2025年底至2028年初拥有清晰且密集的数据读出、监管提交和潜在产品上市催化剂,是驱动近期价值的关键。
6. 总结:优势与潜在挑战
核心优势
1. 经临床验证的差异化技术平台:FORCE™平台在肌肉和CNS靶向递送方面显示出颠覆性的效率(数十倍药物浓度提升、>5%蛋白表达),且其Fab设计在安全性上可能优于竞品。
2. 明确的“Best-in-Class”临床数据:两大核心资产在各自领域(DM1的多维度功能逆转、DMD的高水平蛋白表达)展示了超越现有疗法的潜力,并支持便利的给药方案(Q4W/Q8W)。
3. 清晰且资金充足的注册商业化路径:拥有基于加速批准的明确时间表,且7.9亿美元现金足以支撑至潜在盈利拐点之后。
4. 强大的平台扩展性与竞争壁垒:单一Fab底盘支持管线快速扩展,已建立从临床后期到临床前的丰富管线,技术体系构成深厚专利护城河。
潜在风险与挑战
1. 临床与监管执行风险:注册性试验的最终结果、与监管机构在终点接受度上的最终沟通(如vHOT作为DM1加速批准终点的确认)及审评结果仍存不确定性。
2. 日益激烈的竞争环境:在DM1和DMD领域,Avidity Biosciences等竞争对手进展迅速,需持续证明其疗效与安全性的综合优势。
2025年10月26日,诺华120亿美元收购Avidity Biosciences。同处于这个赛道的Dyne Therapeutics当前约30亿美金市值,是否也有被收购可能?