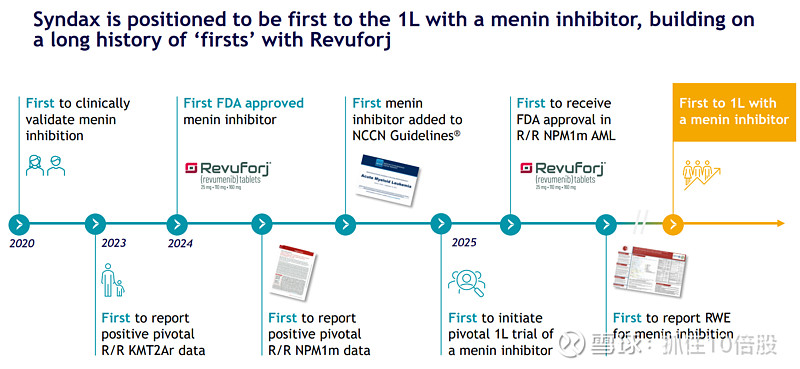
Syndax Pharmaceuticals:双产品商业化加速,前线拓展开启新篇章

摘要:
Syndax Pharmaceuticals已成功转型为一家拥有双引擎驱动的商业化阶段肿瘤生物制药公司。其核心资产—首创口服menin抑制剂Revuforj (revumenib) 和首创CSF-1R抑制剂Niktimvo (axatilimab) —均已获得FDA批准上市,并展现出成为各自领域“重磅炸弹”级药物的明确潜力。本文认为,Syndax正处于一个关键的市值拐点,其价值不仅体现在已获批的复发/难治性(R/R)适应症的快速商业化渗透,更在于其前瞻性且执行力强的临床开发管线,旨在将两款产品推向更广阔的一线(1L)治疗市场。
核心结论如下:
1. 产品优势突出:Revuforj在KMT2Ar/NPM1m急性白血病中显示出深度且持久的疗效,安全性可控;Niktimvo为cGVHD治疗带来了全新的、针对纤维化核心机制的治疗选择,疗效显著且耐受性良好。
2. 商业化开局强劲:两款产品上市后收入增长曲线均超越同类药物早期表现,反映出卓越的产品竞争力和高效的商业执行能力。Niktimvo在上市首个完整季度即为公司贡献利润。
3. 管线价值深挖潜力巨大:通过多项精心设计的临床研究(如SAVE、与强化化疗联用、前线cGVHD试验),公司正系统性地将产品推向早期治疗线,市场总可触达空间(TAM)有望从目前的数十亿美元扩展至百亿美元级别。
4. 清晰的盈利路径:随着收入规模的快速增长和对Incyte的里程碑付款义务逐步减少,公司正向自给自足和盈利迈进。
5. 风险与机遇并存:面临的主要风险包括前线临床试验失败、市场竞争加剧及定价压力。然而,其首创药物的先发优势、强大的临床数据包及全面的商业化布局构成了坚实的护城河。
基于对管线销售峰值的预估,我们预计Syndax两款核心产品的全球销售峰值有望达到50-70亿美元,其中Revuforj约占60-70%。当前市值尚未充分反映其前线适应症的潜力。
一、 公司概览:从临床开发到商业化的成功跨越
Syndax Pharmaceuticals的战略聚焦于肿瘤与纤维化疾病领域未满足的医疗需求。公司发展历程体现了从生物科技公司向综合性生物制药企业的成功演变。2024年,随着Revuforj和Niktimvo相继获得FDA批准,Syndax正式进入商业化阶段,标志着其从一个纯粹的研发实体转型为拥有稳定现金流和明确增长路径的成熟企业。
公司的核心竞争力在于其“精准靶向,深度开发”的策略。针对经过基因筛选的患者群体(如KMT2Ar/NPM1m AML),Revuforj提供了变革性的治疗选择;而针对疾病的核心病理机制(如cGVHD中的巨噬细胞驱动纤维化),Niktimvo开辟了全新的治疗路径。这种“患者细分”与“机制创新”的结合,使得产品在上市后能快速获得市场认可。
二、 核心产品管线深度分析:机制、数据与市场定位
1. Revuforj (revumenib):PPI breaker重新定义Menin抑制剂的治疗标准

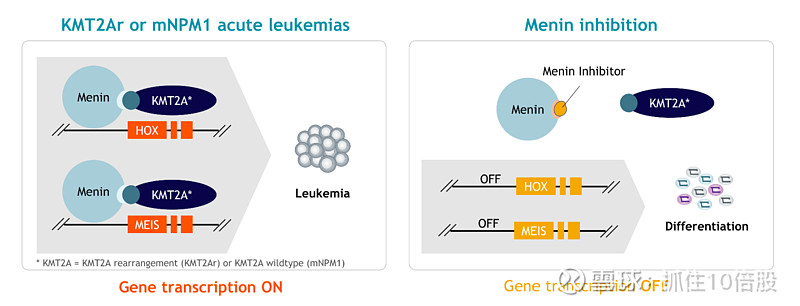
白血病是一种发生在骨髓中的血液癌症,骨髓是正常血细胞生成的场所。未成熟的细胞会发生基因变化,从而形成急性白血病细胞(即原始细胞)。急性髓系白血病,又称 AML。大约 10% 的急性白血病是由 KMT2A 基因的重排所导致的(即 KMT2Ar)。据估计,超过 95% 的 KMT2A 型急性白血病患者存在 KMT2A 易位现象。
NPM1突变型急性髓系白血病(NPM1m AML)是一种由 NPM1 基因突变所导致的白血病。这种突变是常见的遗传变异类型,在约 30%的急性髓系白血病患者中被发现。与 KMT2A 重排型急性白血病类似,NPM1m 急性髓系白血病高度依赖于特定发育基因的表达,而这些基因的表达会受到与 menin-KMT2A 交互作用的抑制剂的负面影响。
作用机制:Revuforj是一种高选择性、强效的口服menin抑制剂。Menin蛋白是HOX基因表达的关键调控因子,而HOX基因的异常表达是KMT2A重排和NPM1突变急性白血病的核心致癌驱动因素。通过阻断menin-KMT2A复合物的形成,revumenib能特异性抑制白血病细胞的增殖并诱导分化。
临床数据深度解读:
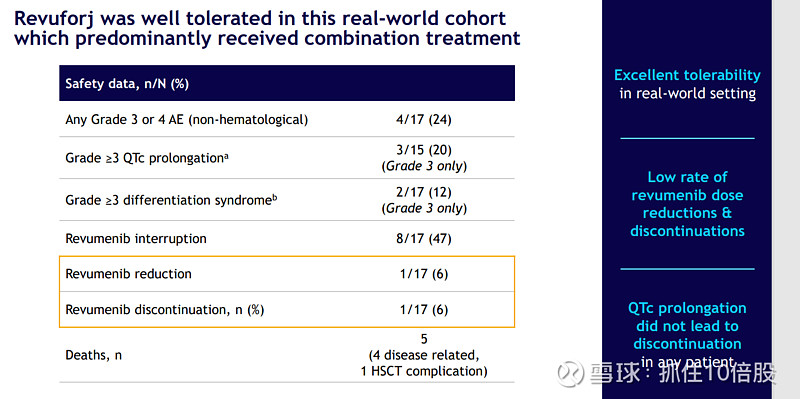
注册试验与真实世界证据(RWE)的一致性:关键AUGMENT-101试验中,Revuforj在R/R KMT2Ar AML患者中实现了高达63%的完全缓解率(CR/CRh)。来自Moffitt癌症中心的早期真实世界数据进一步验证了其在临床实践中的卓越疗效:在包含多线治疗、多种基因亚型(KMT2Ar, NPM1m, NUP98r)的17名患者中,总体缓解率(ORR)达77%,MRD阴性率达75%。这种“试验-现实”疗效的高度一致性,极大地增强了医生处方的信心。

安全性成为差异化优势:与许多靶向药物不同,Revuforj表现出良好的耐受性。关键不良反应如QTc间期延长和分化综合征(DS)发生率较低、严重程度可控,且极少导致治疗中止。这支持了其长期给药,特别是在维持治疗和联合治疗方案中的应用。
市场定位:作为首个且唯一获批的menin抑制剂,Revuforj在R/R市场已建立起领导地位。其目标不仅是巩固在R/R KMT2Ar和NPM1m AML患者中的使用,更是通过前线临床试验,将治疗窗口大幅前移,覆盖初诊患者和移植后维持治疗,从而将目标患者群体扩大数倍。
2. Niktimvo (axatilimab):首个靶向巨噬细胞的cGVHD治疗药物

慢性移植物抗宿主病(GVHD)是一种由供体来源的造血细胞对受体组织产生的免疫反应,它是异基因造血干细胞移植(HSCT)的一种严重且可能危及生命的并发症,这种并发症可能会持续数年。GVHD的病理机制由慢性炎症和纤维化所驱动,这可能导致终末器官损伤,且该疾病通常会在多个器官系统中表现出来,皮肤和黏膜是常见的受累部位。
作用机制:
CSF-1/CSF-1R 通路是慢性移植物抗宿主病(GVHD)中的关键通路,它调控单核细胞的增殖以及巨噬细胞的分化和活性。CSF-1R 信号传导对于交替极化的巨噬细胞的发育和功能至关重要,这些细胞能够发挥促纤维化和炎症作用。在慢性 GVHD 中,单核细胞和巨噬细胞能够介导炎症和纤维化,导致组织损伤。
Niktimvo是一种人源化单克隆抗体,通过靶向集落刺激因子1受体(CSF-1R),耗竭介导组织炎症和纤维化的单核细胞和巨噬细胞。这种机制直接针对慢性移植物抗宿主病(GVHD)和特发性肺纤维化(IPF)等疾病的病理核心,与传统免疫抑制剂的作用路径截然不同。
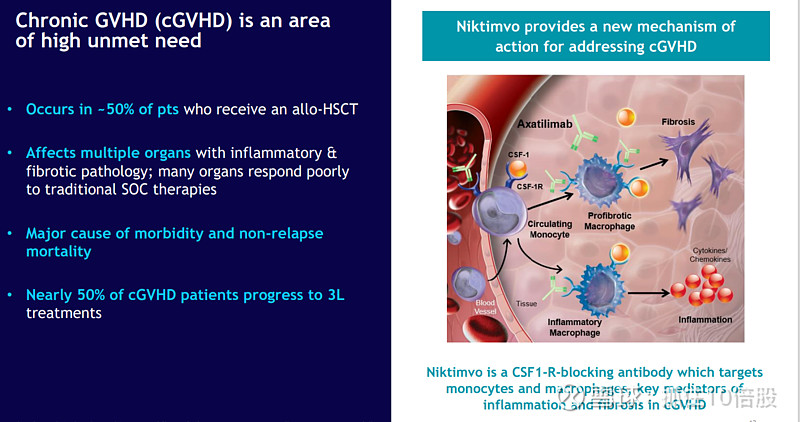
临床数据深度解读:
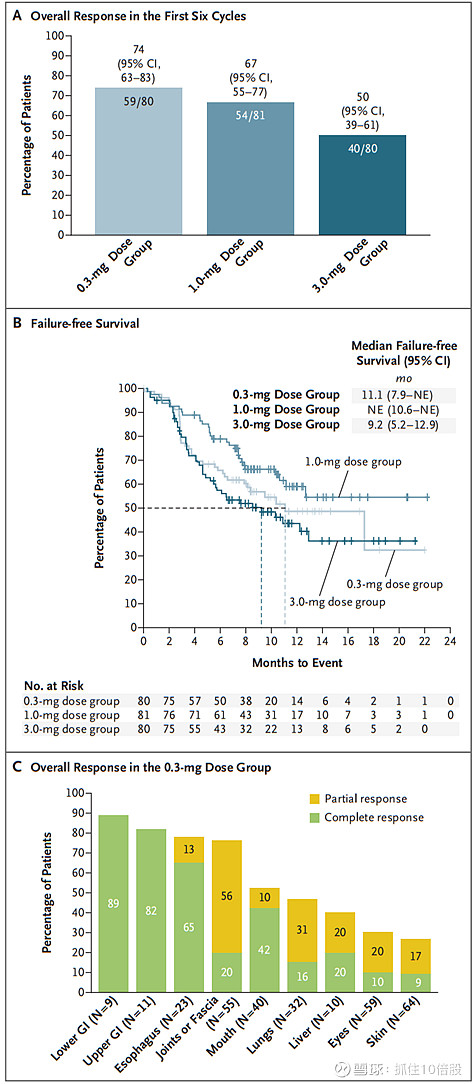
AGAVE-201试验的突破性成果:AGAVE-201是一项国际多中心、随机化、关键性II期临床研究。该研究纳入了241例经二线及二线以上治疗失败的难治性cGVHD患者。患者被随机分配至0.3 mg、1 mg和3 mg剂量组,并接受每两周一次(0.3 mg剂量组和1 mg剂量组)或每四周一次(3 mg剂量组)的静脉给药。结果显示:0.3 mg组、1 mg组、3 mg组的的总体应答率分别为74%、67%和50%,其中分别有60%、69%和41%达到有临床意义的症状缓解(mLSS评分降低≥5分);Niktimvo给药后显示出快速而持续的治疗效果,其中位应答时间小于2个月,中位缓解持续时间达到11.1个月;在器官特异性疗效中,胃肠道缓解率最高,上、下消化道症状缓解率分别为82%、 89%,皮肤和眼部症状的缓解率也为26%-30%。
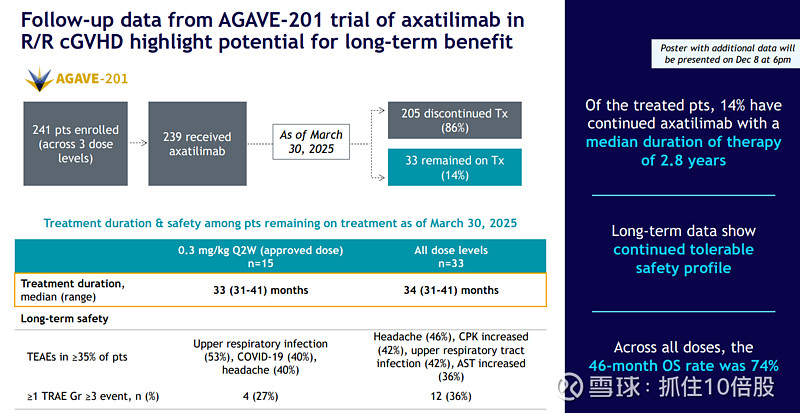
长期耐受性数据坚实:长期随访(中位超2.8年)显示,安全性特征稳定,未出现新的累积性毒性。46个月的总生存(OS)率达74%,对于重度难治性cGVHD患者而言是一个卓越的结果。
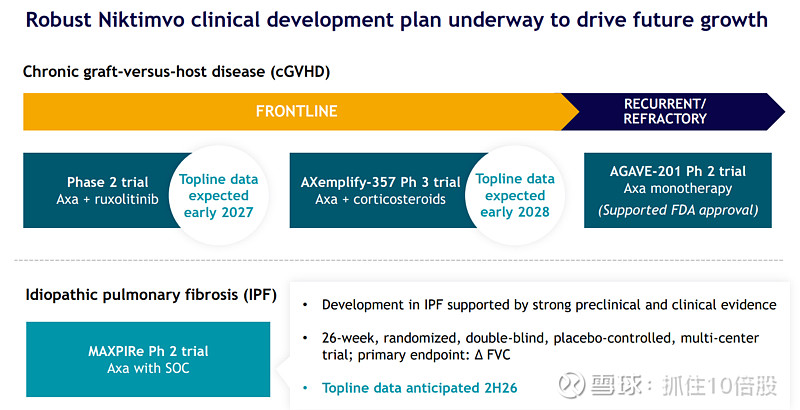
向一线治疗拓展的强劲信号:早期与ruxolitinib联用的数据显示,该组合作为潜在的类固醇减免方案耐受性良好。这为正在进行的、旨在评估Niktimvo+皮质类固醇 vs. 皮质类固醇单药一线治疗cGVHD的大型全球III期试验(AXemplify-357)奠定了基础。
市场定位:Niktimvo已在≥3L cGVHD市场建立了“新标准疗法”的地位。其最大价值在于向1L cGVHD的拓展,若能成功,将直接进入一个患者基数更大、治疗周期更长的市场。同时,进军特发性肺纤维化(IPF)(一个患者群体远超cGVHD的领域)的临床计划,为其打开了另一个价值数十亿美元的想象空间。
三、 关键临床进展解读:通往一线治疗的路线图
Syndax的临床开发策略具有高度的协同性和侵略性,旨在最大化每个产品的生命周期价值。
1. Revuforj的前线组合策略:
SAVE方案(ASTX727 +BCL-2抑制剂+Menin抑制剂):针对不适合强化化疗的老年/unfit AML患者。数据表明,这种全口服三联方案疗效惊人(CR/CRh 81%),且安全性可控。这有望在未来成为一种新的标准治疗方案,极大提高患者的生活质量。
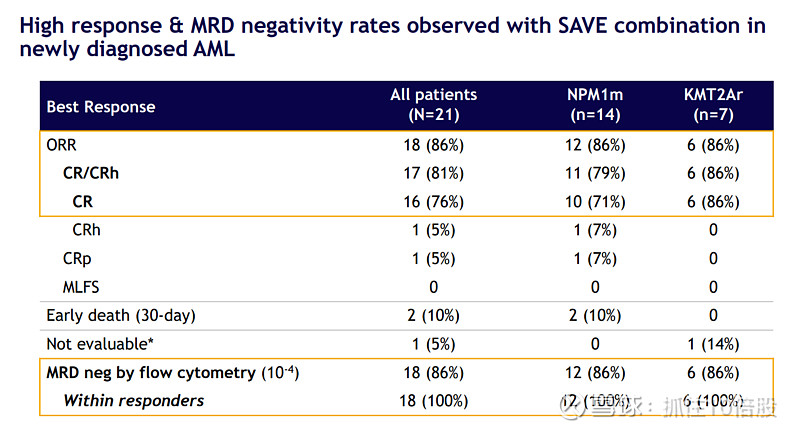
与强化化疗(IC)联合:针对适合强化化疗的较年轻、fit的患者。早期数据显示,Revuforj的加入没有增加IC的预期外毒性,并带来了接近100%的响应率和极高的MRD阴性率。这直接支持了在III期REVEAL-ND研究中,将Revuforj+IC作为fit的NPM1m AML患者一线治疗方案进行验证。
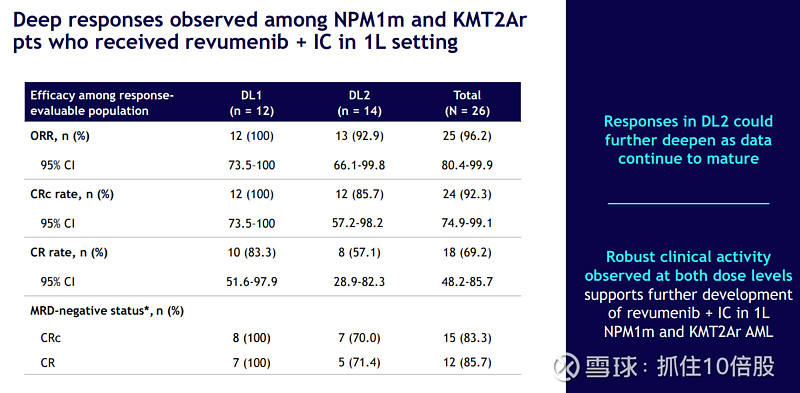
2. Niktimvo的管线拓展:
一线cGVHD(AXemplify-357):这是价值创造的关键试验。如果成功,Niktimvo将从“最后的选择”变为“早期的支柱”,显著扩大市场渗透率和治疗时长。
IPF(MAXPIRe试验):基于CSF-1R在肺纤维化中的核心作用,该拓展具有坚实的科学基础。IPF全球市场庞大,现有疗法仅能减缓疾病进展,Niktimvo有望提供一种全新的、针对疾病根源的治疗选择。
四、 商业化表现与销售峰值预测分析
当前商业化表现:
Revuforj:上市后收入增长迅猛,超越了过去其他AML新药上市初期的增长速度。公司预计到2025年底将治疗1000名KMT2Ar患者。NPM1m适应症的获批带来了显著的需求拐点。强大的医保覆盖和NCCN指南的纳入为其扫清了支付障碍。
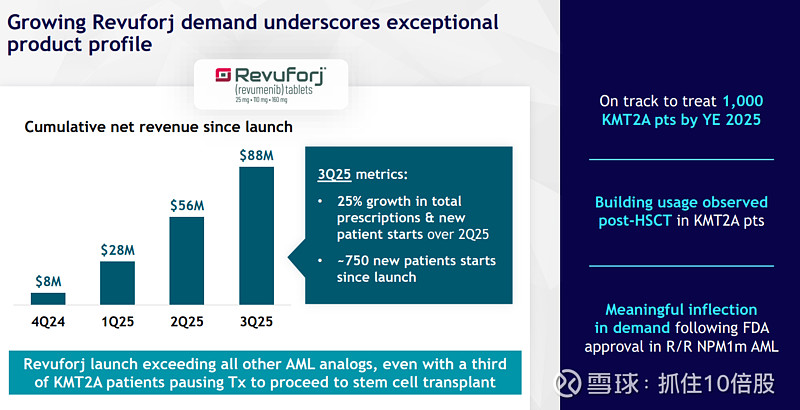
Niktimvo:表现更为亮眼,上市8个月内销售额即按年化计算接近2亿美元,并在上市后第一个完整季度为Syndax贡献了利润。这得益于其与Revuforj在血液肿瘤领域的商业协同效应,以及cGVHD领域对创新疗法的高度渴望。
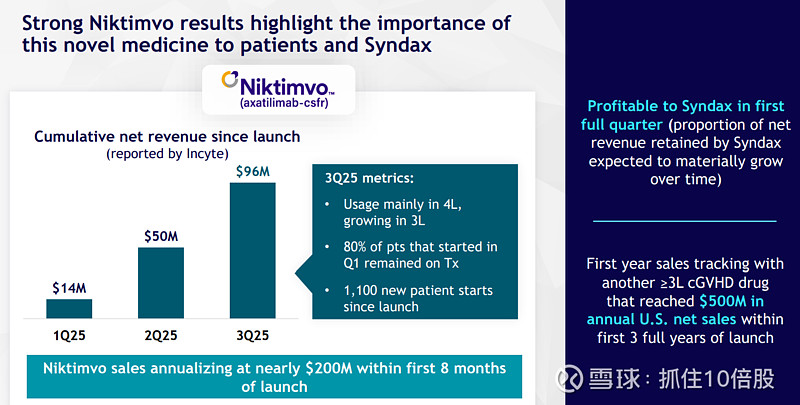
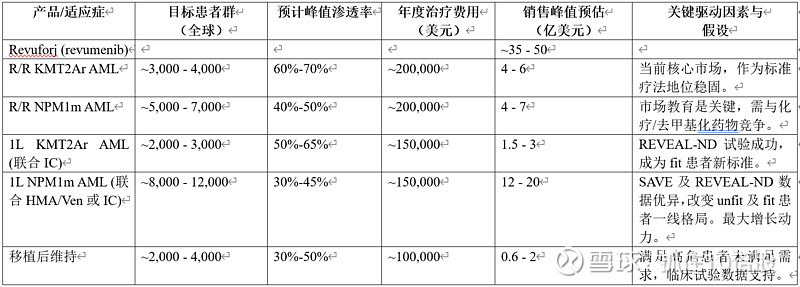
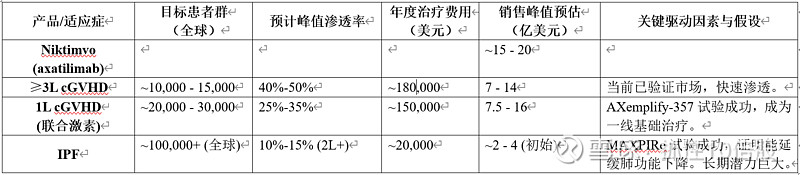
销售峰值(Peak Sales)预测模型:
我们对Syndax两款核心产品的全球销售峰值进行分情景预估。核心假设基于:目标患者人群流行病学数据、当前及未来预期治疗线中的渗透率、定价假设(参考美国及全球主要市场)、治疗时长以及竞争格局。
预测总结与情景分析:
基本情景(概率最高):假设前线关键III期试验(如REVEAL-ND, AXemplify-357)取得阳性结果,但面临一定竞争。在此情景下,全球销售峰值约为50亿美元(Revuforj ~35亿,Niktimvo ~15亿)。
乐观情景:假设所有前线试验大获成功,迅速改变临床实践,且在IPF等新适应症中取得突破。竞争产品进展缓慢。在此情景下,销售峰值可能冲击70亿美元或更高。
保守情景:假设前线试验数据不及预期或竞争加剧,导致渗透率低于预期。在此情景下,销售峰值可能主要依赖当前R/R市场,约为25-30亿美元。
五、 研发战略与未来增长动力
Syndax的研发战略可概括为“纵向深入”与“横向拓展”。
1. 纵向深入(Lifecycle Management):全力推进Revuforj和Niktimvo在已获批疾病领域内向更前线治疗阶段的拓展。这是价值增长最确定、最高效的路径。公司设计的临床试验(如SAVE、与IC联合、AXemplify-357)直接针对当前标准治疗的痛点,成功可能性较高。
2. 横向拓展(New Indications):基于核心机制的科学合理性,探索新的疾病领域。Niktimvo在IPF的开发是典型代表。此外,menin抑制剂在其他依赖HOX通路的恶性肿瘤(如某些实体瘤)中的潜力也值得未来探索。
3. 外部合作与引进:公司与Incyte就Niktimvo在cGVHD和IPF领域的合作,分担了开发成本和风险。未来,公司可利用商业化产生的现金流,选择性引进早期或临床阶段资产,进一步丰富管线。
公司的财务资源能够支持其雄心勃勃的研发计划。截至2025年第三季度,公司拥有充足的现金储备,且随着产品收入的快速增长,对资本市场的依赖度将逐渐降低,走向自我造血。
六、 投资亮点与2026里程碑
投资亮点:
1. 明确的双重增长引擎:两款已上市产品均具有“重磅炸弹”资质,且各自拥有清晰且潜力巨大的临床拓展路径,风险分散。
2. 强大的先发优势和临床数据护城河:作为首创药物,建立了深厚的专利壁垒和医生认知。持续的积极临床数据(包括RWE)不断强化其市场领导地位。
3. 高效的商业化执行力已验证:两款产品上市后快速放量,表明公司拥有出色的市场准入、医学事务和销售团队。
4. 向盈利拐点迈进:Niktimvo已实现季度盈利,Revuforj收入增长迅猛,公司整体迈向现金流平衡和可持续盈利的路径清晰。
5. 估值具备吸引力:相对于其管线蕴含的峰值销售潜力,尤其是尚未被充分定价的前线适应症价值,当前市值存在上行空间。
2026里程碑:
1. 将于 2026 年下半年公布关于 axatilimab 在特发性肺纤维化(IPF)患者中的总体疗效数据。
2. 加快revumenib在关键的 1 线试验中的全球患者招募工作。
3. 启动revumenib在病情稳定的 KMT2A 阳性患者中的 1L 试验
七、 结论
Syndax Pharmaceuticals已经完成了从生物科技公司到商业化生物制药企业的关键一跃。凭借Revuforj和Niktimvo这两款机制独特、疗效卓越的首创药物,公司不仅在当前市场站稳脚跟,更通过极具远见和执行力的临床开发计划,描绘了未来五年乃至更长期的持续增长蓝图。
我们相信,Syndax的核心投资逻辑在于其“近期有业绩,远期有故事”的特质。 近期的业绩由两款上市产品的快速商业化提供坚实支撑;远期的故事则由其在前线AML和cGVHD,乃至IPF领域的巨大市场拓展潜力所书写。