诺奖科学与制药创新的完美共鸣:信达生物IBI363或成Treg/IL-2赛道最大赢家
科学发现与产业应用之间,往往需要十年甚至更久的转化之路。但当它们交汇时,将迸发出巨大的能量。
2025年诺贝尔生理学或医学奖授予了调节性T细胞(Treg)领域的三位奠基人——玛丽·E·布伦科、弗雷德·拉姆斯德尔和坂口志文,表彰他们在外周免疫耐受方面的突破性发现。
他们的研究揭示了免疫系统如何受到调控而不攻击自身组织,其中Treg细胞作为免疫系统的“刹车系统”,通过分泌特殊细胞因子和抑制免疫效应细胞活化等方式,主动维持免疫平衡。
这一基础科学的突破,与信达生物全球首创的PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363形成了完美的科学共鸣。IBI363的巧妙设计思路,恰恰建立在诺奖获奖成果的生物学机制之上,成为了Treg理论在肿瘤治疗领域的前沿实践。
01 诺奖基石:免疫平衡的守护者Treg细胞
逆向而行的科学发现
1995年,当坂口志文做出第一个关键发现时,他是在逆主流科学潮流而行。 当时,许多研究人员坚信免疫耐受仅仅是通过中枢耐受过程在胸腺中消除潜在有害免疫细胞而形成的。
坂口志文证明了免疫系统更为复杂——他发现了一类以前未知的免疫细胞,这类细胞能够保护身体免受自身免疫性疾病的侵害。 他率先找到外周耐受中发挥作用的特殊免疫细胞,并将其命名为“调节性T细胞”(简称Treg)。
Foxp3基因:Treg细胞的主控开关
2001年,玛丽·布伦科和弗雷德·拉姆斯德尔做出了另一个关键发现。 他们解释了为什么一种特定的小鼠品系对自身免疫性疾病特别易感。
他们发现这些小鼠的一个基因发生了突变,他们将这个基因命名为Foxp3。 他们还证明了人类对应基因的突变会导致一种严重的自身免疫性疾病——IPEX。
两年后,坂口志文将这些发现联系起来。 他证明了Foxp3基因控制着他在1995年发现的细胞的发展。 这些细胞现在被称为调节性T细胞,它们监视其他免疫细胞,确保我们的免疫系统耐受自身组织。
免疫系统的精细平衡
人体免疫系统就像“健康卫士”,主要承担两大任务:一是抵御细菌、病毒等外来病原体;二是清除体内突变细胞、衰老或坏死细胞,维持身体内部平衡。
“为什么并非所有人都会患上严重的自身免疫病?关键就在于免疫系统的‘识别纠错’机制,它就是免疫耐受。” 免疫系统的强大在于克制而非攻击。
02 IBI363:基于诺奖科学的巧妙设计
IL-2的双重角色
白细胞介素2(Interleukin-2,IL-2)是第一个被发现和鉴定在T细胞发育和扩增中起重要作用的细胞因子。 IL-2作为一个双功能的细胞因子,既可以通过IL-2受体αβγ三聚体诱导激活CD4+调节性T细胞(Treg),维持机体免疫抑制,又可以通过IL-2受体βγ二聚体刺激CD8+T细胞和自然杀伤细胞,维持机体抗肿瘤作用。
在肿瘤免疫治疗中,这一双重特性构成了核心挑战——如何激活杀伤性T细胞而不激活抑制性的Treg细胞?
IBI363的差异化设计思路
IBI363是信达生物自主研发的潜在同类首创新药,有效成分为PD-1/IL-2双特异性抗体融合蛋白。
与传统思路不同,IBI363的IL-2臂采用了α-biased设计,保留了对IL-2 Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低传统IL-2疗法的毒性。
而PD-1结合臂则发挥着“导航头”的作用,既能阻断PD-1/PD-L1通路,又能将IL-2的选择性递送到需要被激活的T细胞。
精准靶向肿瘤特异性T细胞
由于新激活的肿瘤特异性T细胞同时表达PD-1和IL-2α,这一差异化策略可以更精确和有效地实现对该T细胞亚群的靶向和激活。
IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。
03 机制共鸣:诺奖理论与IBI363设计的完美契合
Treg细胞的CD25标志物
坂口志文在1995年首次识别出Treg细胞的标志分子CD25,并通过实验验证了这些细胞在防止自身免疫病中的关键作用。
CD25正是IL-2受体的α亚基,这使得Treg细胞能够高效响应IL-2信号。IBI363的设计直接针对这一生物学特性,其IL-2臂经过精巧设计,保留了对IL-2 Rα的亲和力。
免疫平衡的双向调节
与自身免疫病相反,肿瘤细胞会“狡猾”地“喂饱”调节性T细胞,使其异常活跃。 此时的调节性T细胞如同被“策反”,反而会阻拦免疫细胞攻击肿瘤。
因此,肿瘤治疗中需采取“削弱肿瘤局部调节性T细胞”的策略,通过抑制其活性,解放被“按住”的免疫细胞,让它们重新“苏醒”并全力追杀癌细胞。
IBI363通过PD-1介导的靶向作用,优先激活肿瘤微环境中的效应T细胞,同时尽量减少对外周Treg细胞的激活,完美实现了对这一平衡的精准调控。
下表展示了传统IL-2疗法与IBI363在机制上的关键差异:
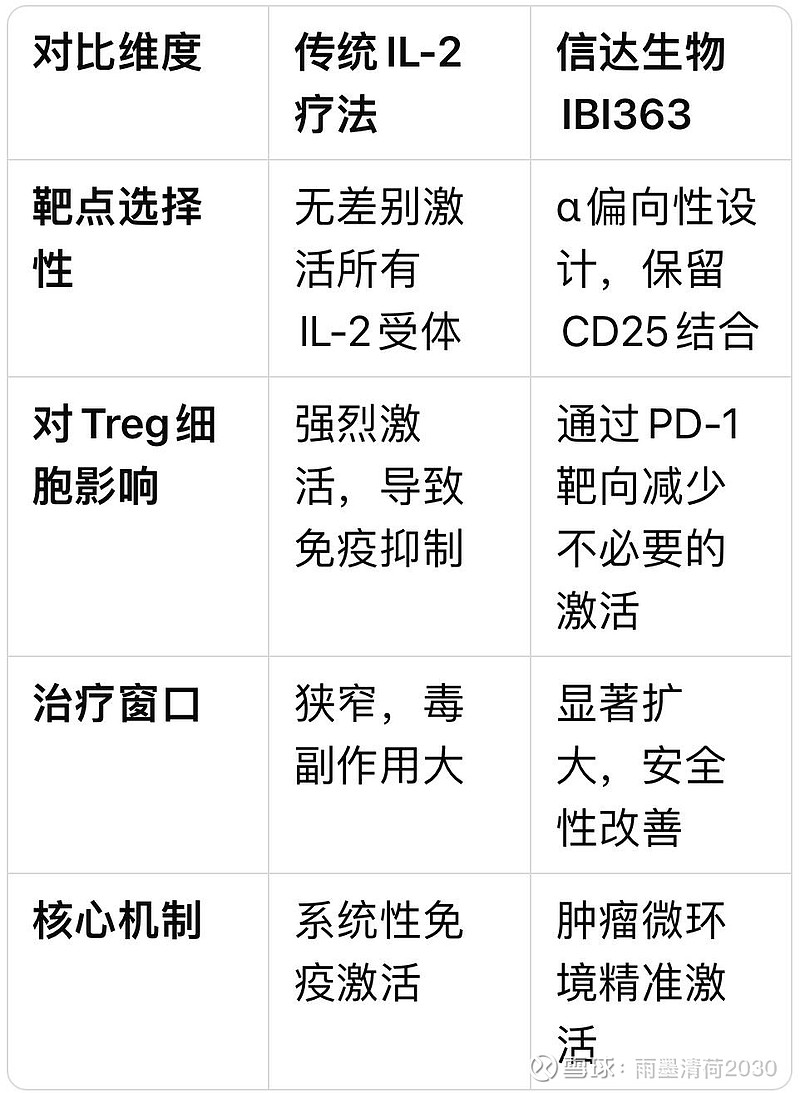
04 临床进展:从概念验证到全球三期
突破性临床数据
在2024年WCLC上,信达曾公布IBI363在既往接受过免疫治疗的鳞状非小细胞肺癌受试者中的积极结果:
在3 mg/kg剂量组至少随访12周以上或已结束研究的患者中(n=18),ORR(客观缓解率)为50.0%,DCR(疾病控制率)为88.9%
中位PFS(无进展生存期)未达到,仍在随访中
在1/1.5 mg/kg剂量组中,中位PFS达5.5个月 (95% CI: 1.5, 8.3),12个月PFS率为30.7%
特别值得注意的是,IBI363在PD-L1低表达人群中也显示出了显著疗效,这预示着它可能给“冷肿瘤”转化为“热肿瘤”带来机会。
监管认可与全球化布局
2025年8月,信达生物宣布IBI363的首个全球III期临床研究获得美国FDA批准,针对免疫耐药的鳞状非小细胞肺癌患者,标志着这一创新性双免疫疗法的全球开发进入最后的POC阶段。
IBI363已同时获得中国CDE突破性治疗药物认证和美国FDA快速通道资格,成为信达全球创新战略的旗舰产品。
05 市场前景:诺奖加持下的价值重估
千亿美元市场的新机遇
诺奖的认可为Treg细胞的研究汇聚了更多力量。 从市场增长看,Treg细胞相关疗法到2031年有望超过2500万美元,年复合增长率可达44%。 肿瘤、自免和器官移植后的抗免疫排斥等领域都有巨大市场潜力。
目前,涉及Tregs的临床试验超过200项。 随着生理学知识的发展,未来这一领域将迅速进步,基于免疫系统疾病的研究也将带来更多治疗方法的选择。
IBI363的领先地位
在全球范围内,IBI363作为研究进展最快的PD-1/IL2靶向药物之一,已经进入全球临床三期。
此外,还有11款也进入临床阶段,研究进展较快的来自于罗氏、盛禾、再生元和Anaveon。
诺奖的肯定,极大地提升了资本市场和医学界对整个Treg/IL-2赛道的关注度,为IBI363后续的临床开发、商业合作和市场教育铺设了更顺畅的道路。
06 挑战与思考:科学到应用的必经之路
精准调控的挑战
目前相关治疗仍存在“精准度不足”的挑战。 以肿瘤治疗为例,2010年出现的针对PD1/PD-L1、CTLA-4等靶点的免疫治疗技术虽能增强免疫杀伤肿瘤的能力,却可能导致患者并发自身免疫病。
像低剂量白细胞介素-2疗法,目前仅适用于传统治疗无效或效果不佳的难治性自身免疫病患者。
安全性管理的重要性
Treg细胞相关疗法并非万能药。 南卡罗来纳医科大学霍林斯癌症中心的研究者发现,在一项针对自免疾病治疗的研究中,CAR-Treg细胞不但没有减缓炎症,还增加了不必要的炎症。
北京协和医学院梅林团队也指出,Treg细胞及其衍生物虽然有治疗多种疾病的潜力,但存在稳定性差和潜在毒性等问题。
结语:从科学奠基到产业引领
2025年诺贝尔生理学或医学奖与信达生物IBI363之间,展现了一条从基础科学发现到创新药物开发的完整价值链。三位诺贝尔奖得主对Treg细胞机制的深刻揭示,为IBI363的巧妙设计提供了坚实的科学基础。
对IBI363而言,诺奖像是从科学殿堂传来的一声喝彩,从底层生物学上强化了其研发逻辑的正当性。对投资者和行业观察者而言,这次诺奖是一个明确的信号,标志着免疫系统的精准调控是毋庸置疑的未来方向。
正如免疫系统需要在攻击和耐受之间找到平衡,创新药研发也需要在科学理想与商业现实之间找到平衡。 信达生物IBI363的探索,正是中国创新药企从跟随创新到源头创新的生动实践。
在这个创新药的新纪元,我们有理由相信,基于深刻科学洞察的创新药物,将能够更好地服务于全球患者,实现科学善念与商业成功的完美统一。