浅述效应指标、P值及临床价值间的关系
Wankm5
· 广东
近期$康方生物(09926)$ 由于HARMONi临床实验的结果引发了大家不少的讨论,由此打算先写一篇文章探讨怎么合理评估临床实验,并对之前的文章系统性梳理NSCLC的过往临床研究并对HARMONi-3实验结果尝试预判(一)作一些补充。一家之言,若有错漏,欢迎指正。
让我们带着以下问题,并从几个临床实验的案例开始:
1.药物的效应指标有哪些?
2.在一个临床实验中,我们需要关注的指标还有哪些?
3.怎么平衡数学上的统计学是否显著与真实世界的药效之间的关系?
HARMONi-A的研究设计
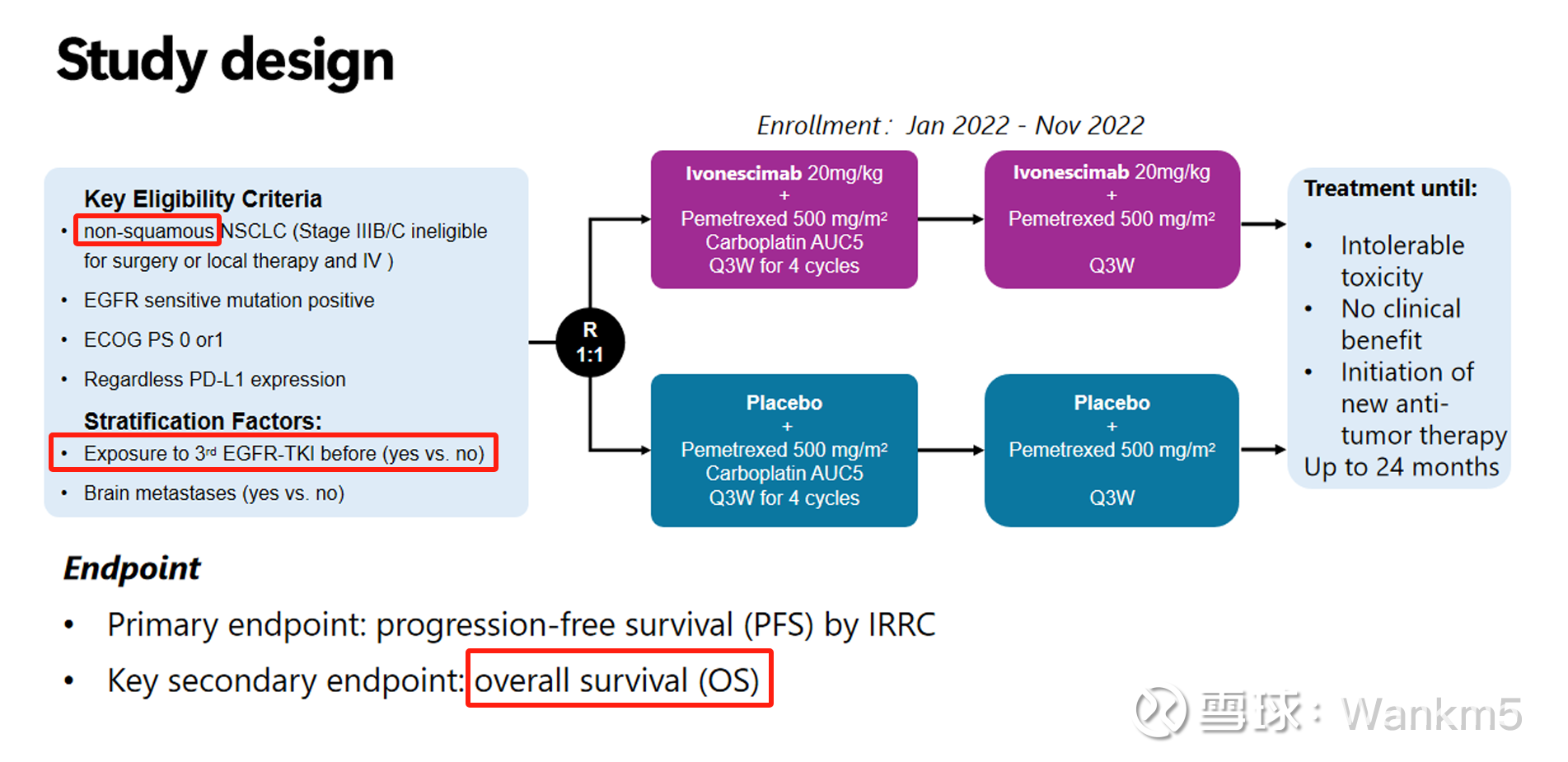
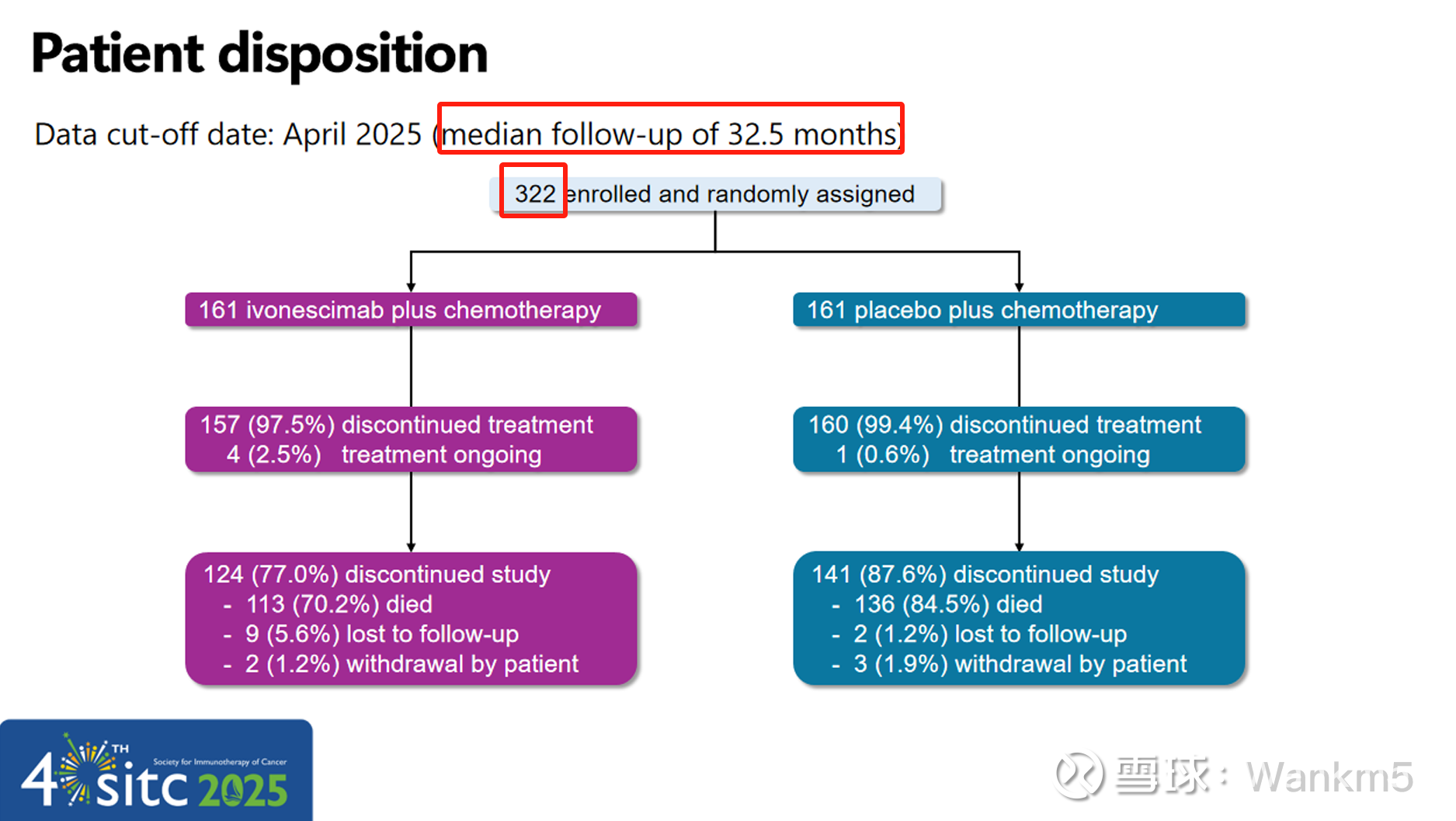
本研究共纳入322例不适合手术或局部治疗的晚期鳞状非小细胞肺癌(NSCLC)患者,按1:1随机分配至依沃西单抗(20 mg/kg Q3W)或安慰剂组。两组患者均联合培美曲塞(500 mg/m²)与卡铂(AUC5)治疗4周期,随后进入单药维持治疗阶段。随机分层因素包括是否经治3代EGFR-TKI与是否出现脑转移。本研究
点击查看全文