医药股投资分析-宜明昂科 1没理论突破能玩的转CD47靶点吗?
本文直接讨论CD47靶点的技术路线以及宜明昂科IMM01的成功率,废话不多说,直接上CD47靶点血泪史。
1CD47靶点难点与血泪史
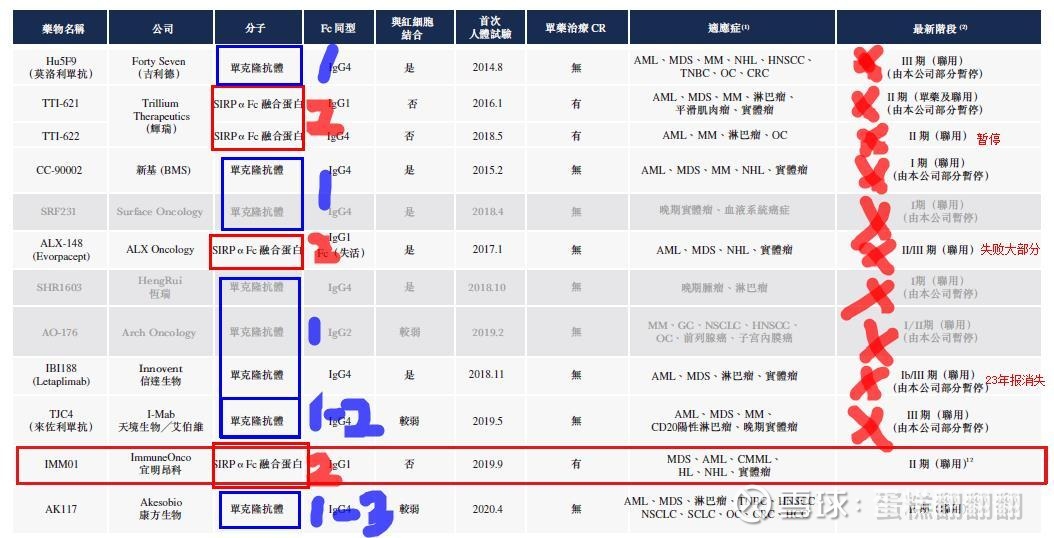
以上是全球12条cd47管线的开发情况,基本全军覆没,目前还在咬牙坚持的只剩下宜明昂科/ALX Oncology/康方生物。
CD47世纪难题:
CD47蛋白广泛表达于我们的正常细胞中,而不仅限于癌细胞。
虽然仅仅阻断CD47-SIRPα的相互作用,不足以引发吞噬作用,还需要钙网蛋白等“吃我”信号的助攻。但在肿瘤细胞、衰老的红细胞和血小板,阻断CD47-SIRPα的相互作用会直接引发吞噬作用。换句话说,红细胞减少和血小板减少是CD47靶点药物成药性的最大挑战。
管线失败的血泪史如下:
阶段一:2018年前后——第一代单抗出现死亡案例,靶点几乎判死刑
第一代的CD47单抗:Arch Oncdogy公司的Ti-061、新基公司的CC-90002以及Surface Oncology公司的SFR231。
2017年5月24日,ArchOncology仅在首例患者入组后就因为红细胞凝集而死亡,ArchOncology也被迫终止了该款CD47药物的研发。
2018年10月,新基公司终止了CD47单抗临床试验CC-90002的受试者招募,原因在于CC-90002临床试验数据疗效及安全性均不佳。
阶段二:2020年前后——百亿美元豪赌失败
2020年3月,吉利德以49亿美元的价格收购了主打CD47抗体的公司Forty Seven。2022年1月份,临床宣传撤回,管线彻底失败。
2020年9月,IBBV以29亿美元和天境生物就CD47达成战略合作。2023年9月,艾伯维宣布退出。
2021年,辉瑞将以约22.6亿美元的价格收购Trillium,获得其阻断CD47-SIRPα信号通路的两款在研疗法——TTI-622和TTI-621。2025年7月,辉瑞宣布中止2期临床,管线失败。
以上收购总计花费100亿美元,总共700亿以上的资金最后全部打水漂。
阶段三:2025年——辉瑞/ArchOncology接连失败,信达生物管线消失
2025年7月,辉瑞宣布中止2期临床,管线失败。
另外一家坚持CD47靶点研发的公司ArchOncology的管线临床也接连失败。
信达生物的IBI188则在2023年年报中彻底消失。
2CD47靶点解题路线
cd47靶点难题理解起来非常简单:
就是药物在杀伤肿瘤细胞的同时,不可避免的同时杀伤了红细胞和血小板。
原因则是cd47靶点不仅在肿瘤细胞中高表达,在红细胞血小板中也表达。而这些开发的药物没办法完全避开红细胞血小板而单独杀伤癌细胞,这就是这个靶点的世纪难题。
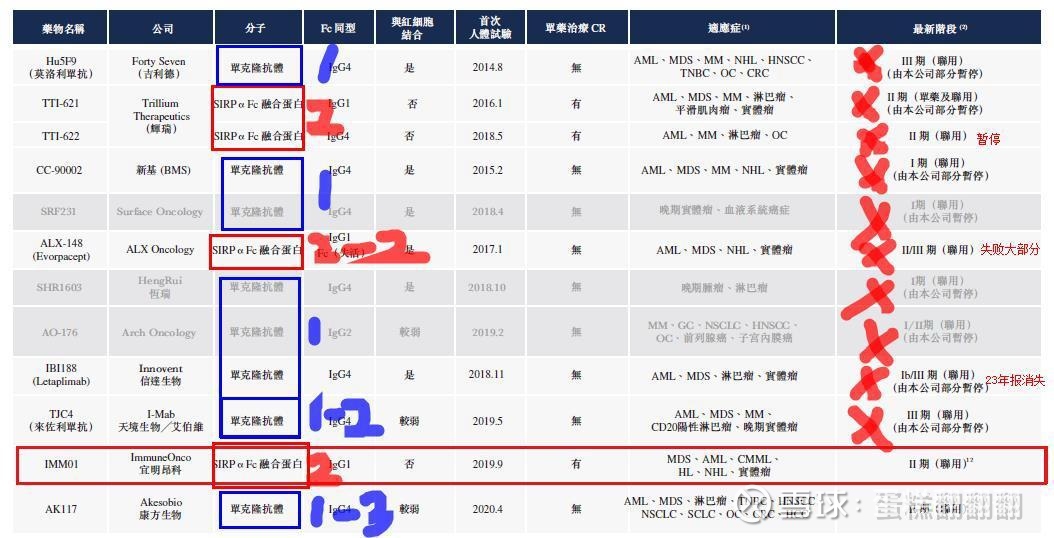
针对这一难题,我把技术路线分为抗体3类、融合蛋白2类、昂利康创新单抗总共6种技术路线如下:
抗体路线1:
一代抗体采用IG2直接触发红细胞毒性,这一代就没有想到红细胞问题
路线1改进型:代表为吉利德,采用IG4避开红细胞杀伤,原理是血浆中的IG4含量低,但是本质上只是毒性减弱,并没有避开红细胞,而药物把红细胞杀伤之后进入肿瘤细胞的量又达不到效果,加量又增加毒性,死循环。也说明了即使是微弱的毒性,也足以造成临床失败。
抗体路线2:
在SIRPα领域,海外生物科技公司Trillium发现了一种神奇的亚型——天然变体V2的Domain1,这一亚型可以高亲和力结合肿瘤细胞表面的CD47,但不结合红细胞表面的CD47。这一发现为后面的融合蛋白技术奠定了理论基础。
既然SIRPα可以结合肿瘤细胞表面的CD47,而不结合红细胞表面的CD47,说明红细胞表面CD47与肿瘤细胞CD47存在着差异。
天境生物便通过反向筛选的方式,找到了一款天赋异禀的CD47单抗TJC4:
该抗体在保留促进吞噬细胞活性和抗肿瘤药效的同时,与正常红细胞上的结合十分微弱,以至于抗体本身不会引起红细胞凝集现象,这一特性可以最大限度减少抗体注射后带来贫血等副作用。
好了,相信大家也看出问题所在,该抗体与红细胞的结合十分微弱,这说明还是无法避免与红细胞的结合。而结合的微弱程度并不足以接近于0,那么就接近于路线1中的IG4方案,最终无法避免血液毒性而造成临床失败。
由此可以说明,红细胞表面CD47与肿瘤细胞CD47存在着差异,但是这种差异不足以达到完全区分,而仅小小的混杂就足以让药物对这部分没区分出来的红细胞造成杀伤,从而导致实验失败。
SIRPαDomain1,这一亚型可以高亲和力结合肿瘤细胞表面的CD47,但不结合红细胞表面的CD47,这种蛋白可以区分两者,而天境生物的抗体也可以区分两者,我很有理由相信抗体和SIRPαDomain1区分的原理很接近,那么也说明抗体没办法区分的部分红细胞,采用SIRPαDomain1也区分不出来,我认为这是造成后续融合蛋白管线也失败的核心。
抗体路线3:
康方生物的AK117在抗体路线上更进一步,既然微弱的毒性可以造成临床失败,那么我更更微弱的接近于0的毒性,会不会成功呢?
AK117抗体的原理是通过技术手段让抗体最多只结合1个红细胞,从而降低对红细胞的杀伤,加上IG4本身就很少与红细胞结合,那么理论上毒性更小,理论是有临床成功的机会。当然这种毒性减少的程度够不够成重大突破,还需要临床验证。
融合蛋白路线1:
在SIRPα领域,海外生物科技公司Trillium发现了一种神奇的亚型——天然变体V2的Domain1,这一亚型可以高亲和力结合肿瘤细胞表面的CD47,但不结合红细胞表面的CD47。这一发现为后面的融合蛋白技术奠定了理论基础。
融合蛋白的理论基础是,只结合肿瘤细胞不结合红细胞,这种理论从原理上看是不存在失败问题的,因为直接就解决了世纪难题。但是为什么又失败了呢?原因就是我上面说的,融合蛋白实际上没办法百分百区分肿瘤细胞跟红细胞,实际上是存在漏网之鱼的,而这个漏洞就导致了临床的失败。
辉瑞/ArchOncology/宜明昂科都是走的这条路线,而辉瑞/ArchOncology在这条路线上已经失败,那么采用统一路线的宜明昂科成功的概率渺茫,特别是辉瑞/ArchOncology已经失败的大适应症。
目前宜明昂科在小适应症上继续推进三期,有点像刮别人不想刮的奖励10元的彩票,中不中奖都发不了财。(CMML全球3.2万人、CHL8.3万人、大适应症MDS前面两家验证了这一路线行不通)
融合蛋白路线2:
ArchOncology这个公司死磕CD47靶点,又来了一个新思路。
直接让融合蛋白结合cd47靶点,但是不发挥抑制或杀伤作用,只发挥关闭信号开关的作用。这个思路其实也绕回去了,CD47的作用就是传递别吃我信号,而不管是关闭这个通路还是杀伤细胞,结果都是把肿瘤细胞跟红细胞的别吃我信号关闭,理论上并没有作用,因为通过药物杀伤肿瘤细胞跟巨噬细胞直接吞噬都会杀伤红细胞。
事实证明这一技术路线也存在问题,ArchOncology公司市值已经跌了99%,目前只剩4亿人名币市值,这个市值放在美国,几乎就是破产中的破产水平。
昂利康创新单抗:
遮罩型抗体药物,抗体部分为CD47单抗。
该CD47抗体对 CD47 靶点的结合活性因偶联了遮罩而大大降低,在血液中高度稳定,从而避免了CD47抗体活性所导致的血液毒性。
原理是到肿瘤细胞后遮罩被打开,从而避开对血液的杀伤,直接作用于肿瘤。理论上直接看也是可行的,问题在于这种遮罩真的能完全避开血液细胞吗?还需要临床验证。
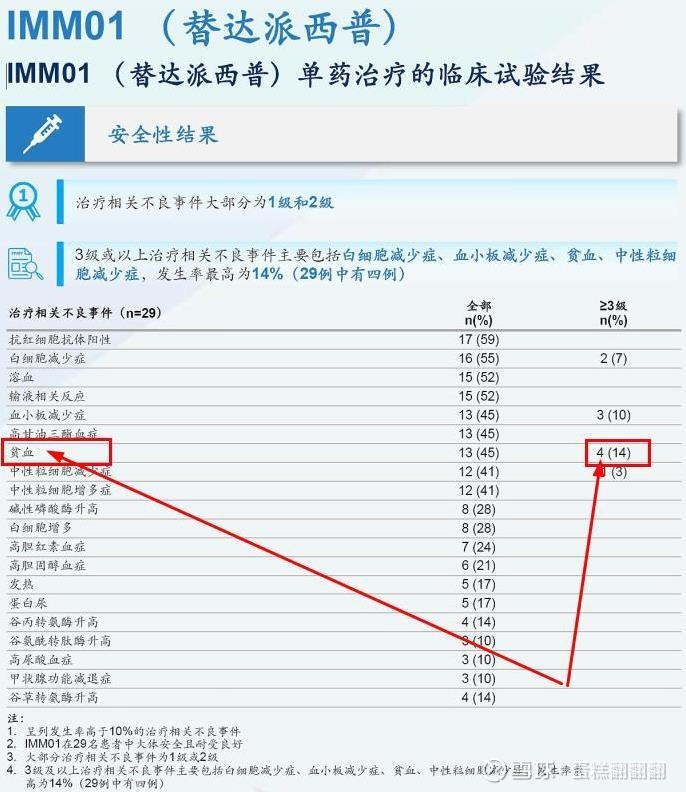
总结以上分析,可以看到,宜明昂科的技术路线并不是首创唯一的方向,而且技术路线已经有两家共3条管线验证失败,加上临床数据显示3级以上贫血事件概率为14%,可以预测管线在前两家印证的MDS大适应症上成功的概率非常低。至于CMML、CHL两个小适应症,公司是首个药物,能不能成功还是未知数。