广泛期小细胞肺癌(ES-SCLC)全球治疗现状及格局
肺癌目前仍然是全球第一高发癌种,其中小细胞肺癌约占13-15%,是由支气管的神经内分泌细胞发育而来,其侵袭性强,生长迅速,在诊断时,大约70%的小细胞肺癌病例已存在远处转移。1957年小细胞肺癌即被分为两类,局限期(LS-SCLC)和广泛期(ES-SCLC)。局限期是指原发肿瘤局限于一侧胸腔,没有证据表明肿瘤扩散到可能存在同侧胸腔积液或纵隔淋巴结受累之外的阶段。除此之外,其他情况均被归类为广泛期,而占据约70%的广泛期小肺预后较差,中位生存期不足1年,长期以来成为肺癌领域的治疗难点和痛点。
根据NCCN和ESMO指南,晚期小细胞肺癌目前标准一线治疗是以铂类为基础的化疗(卡铂或顺铂加依托泊苷)联合PD-L1抑制剂(阿替利珠单抗或杜伐利尤单抗,国内也有替雷利珠,阿得贝利,斯鲁利,特瑞普利等)。这种免疫联合化疗虽已成为一线标准,但小细胞肺癌为免疫冷肿瘤,大多数容易存在免疫逃逸,且促进免疫抑制性环境存在免疫耐药,故临床疗效仍不甚理想。既往单纯接受化疗的中位OS不到10个月,两年存活率约为9%。而增加了免疫后也仅能将OS延长约2-5个月,从10个月延长到12-15个月左右。而二线治疗应用最广泛的化疗药物则是拓扑替康,ORR通常低于25%,中位OS 约6-8个月,且在体内无差别攻击所有快速分裂的细胞,因而导致其具有骨髓抑制等典型副作用,疗效也有限,有巨大未满足的临床需求。那随着医学技术的发展,除此之外,对于广泛期小细胞肺癌还有哪些新兴治疗和新药研发呢?
下面这张图基本概括了国内外研究治疗小细胞肺癌的药物关键类别。
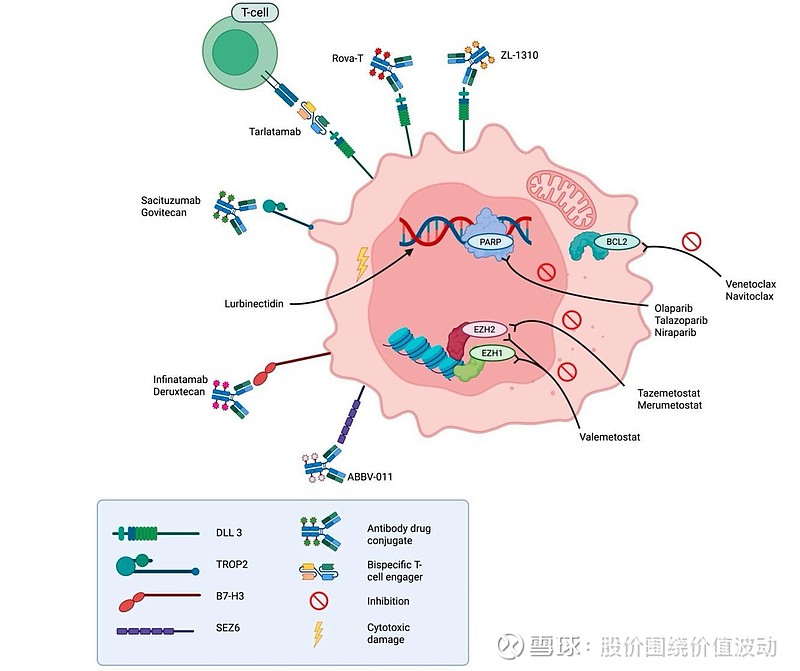
现重点介绍如下几个:
(1)芦比替丁:是PharmaMar公司研发,绿叶制药公司享有国内商业化权益的一种化疗药物,其具有细胞毒活性的合成生物碱类似物,其功能是DNA结合转录抑制物,复发的小细胞肺癌中显示出活性,并具有可接受的安全性。除了其直接的细胞毒作用外,芦比替定还具有免疫调节特性,可进一步增强其抗肿瘤活性。在在一线维持治疗的III期IMForte研究(芦比替丁联合阿替利珠 vs 阿替利珠单药维持)显示,PFS(5.4个月 vs 2.1个月,HR=0.54)。中位OS(13.2个月 vs 10.6个月,HR=0.73)。但实验组不良事件(TRAE)更为常见(83.5% vs 40%)。二线单药,ORR 35.2%,中位OS 9.2个月。总体而言,芦比替定似乎有望在一线治疗后新的维持治疗选择和二线策略之一,然而其长期适用性可能受到毒性的限制;
(2)纳武利尤联合伊匹木单抗或免疫双抗:在I/II期CHECKMATE 032试验中,在复发的小细胞肺癌患者中,ORR(21% vs 10%),2年OS 约30%,证明了联合治疗的获益,但是不良反应更高,3-4级治疗相关不良事件发生率约为30-33%;小细胞肺癌领域免疫双抗进度靠前的主要是BNT327,是一款靶向PD-L1和VEGF的双特异性抗体药物,联合化疗一线治疗中取得了超过85%的ORR和接近100%的DCR,表明绝大多数患者的肿瘤能够显著缩小或得到控制。虽然中位总生存期尚未最终确定,但已有72.7%的患者生存时间超过了1年,预估的中位OS为16.8个月,显示出带来长期生存获益的潜力。而在二线治疗研究中的亮点是,对于已经接受过免疫治疗并发生耐药的患者,BNT327联合紫杉醇方案依然能达到37%的ORR,为目前选择非常有限的二线治疗(尤其是在国内尚无DLL3靶向药可用的情况下)提供了一个重要的新方向;
(3)Rova-T:是艾伯维数年前研发的一款抗DLL3的抗体药物偶联物(ADC),连接的是一个强效的细胞毒性药物(PBD二聚体),理论上可以实现精准打击并减少对正常细胞的伤害。但其研发历程一波三折,在早期2016年,其I期临床试验结果令人振奋。在既往治疗失败、DLL3高表达的小细胞肺癌患者中,尤其是在缺乏标准治疗方案的三线及以后治疗场景下,Rova-T取得了很高的客观缓解率(ORR 39-50%)和疾病控制率(DCR 89-92%)。这在小细胞肺癌治疗数十年停滞不前的背景下,被认为是重大突破。但2021年更大规模III期临床试验(TAHOE研究)却带来了负面结果,遭遇严重滑铁卢。该研究旨在评估Rova-T用于二线治疗(即一线含铂化疗失败后)的效果,直接对比标准化疗药拓扑替康。结果发现,接受Rova-T治疗的患者中位总生存期反而更短(6.3个月 vs 8.6个月),且客观缓解率也更低(15% vs 21%)。这表明Rova-T在二线治疗中并未能带来获益。而在随后联合疗法探索中,研究人员也尝试过将Rova-T与免疫检查点抑制剂(如纳武利尤单抗和伊匹木单抗)联合使用,虽观察到一定的抗肿瘤活性(客观缓解率为30%),但出现了严重的治疗相关不良事件,包括3例致死性不良事件(如肺炎、急性肾损伤),表明该联合方案的耐受性不佳。因此,AbbVie在2019年8月停止了Rova-T的开发。尽管Rova-T本身未能成功应用于临床,但其研发过程为小细胞肺癌的治疗留下了宝贵的经验:首先,验证了DLL3是小细胞肺癌的一个治疗可行性靶点,其次为后续靶向DLL3的新药研发积累了重要经验和数据。例如接下来要介绍的塔拉妥、ZL-1310,以及泽璟的ZG006三特异性抗体,均进一步证实了DLL3是小细胞肺癌上的最佳靶点;
(4)塔拉妥单抗:是安进公司原研,国内百济神州合作的一款靶向DLL3和CD3的双特异性T细胞衔接器。DLL3在80%的小细胞肺癌中高表达,在正常组织中表达极低,使其成为一个非常理想的治疗靶点,且塔拉妥本质上具有免疫持续调控的特性。二线广泛期小肺三期DeLphi-304试验中证实,与化疗相比,塔拉妥ORR 35%,DoR 6.9个月,且显著改善了OS(13.6个月 vs 8.3个月,HR 0.60),安全性也更优。而一线Ib期联合化免DeLphi-303研究取得ORR 71%,中位OS 25.3个月的数据,而三期DeLphi-305也已经在进行中。目前塔拉妥已在美国,日本及英国获批,确立了二线标准治疗地位,且国内百济也于今年7月份提交乐上市申请,未来有望占据国内市场先机。但据传其在美国目前仅覆盖20%的二线病人,且需要剂量爬坡,给药不容易,在全球范围塔拉妥仍不是二线主导药物。不过塔拉妥安全性尚可控制,也有与ADC联用潜力和可能性;
(5)ZL-1310:是一种新一代的抗DLL3 ADC,它连接的毒素部分跟出名的德曲DS8201连接分子设计一样,均为拓扑异构酶I抑制剂(TOPi),后者是一种新型喜树碱衍生物,经过优化改造,比前面提到的二线传统化疗药物拓扑替康的效力、稳定性和药代动力学特性更优,因其高靶向性、高效力,且精准递送,且具有旁观者效应,因而理论上具有高效低毒特点。在二线治疗广泛期小肺的国际一期研究中,1.6mg组中位缓解持续时间6.1个月,ORR为68%,基线脑转移患者有66%的ORR(未接受过脑部放疗的ORR 为80%)和100%的DCR,且亚组覆盖DLL3 阴性及塔拉妥耐药患者。快速清除肿瘤同时耐受性良好,1.6mg组仅有13%的≥3级TRAE发生率,仅报告2例1级间质性肺病ILD事件。目前正在进行国际三期临床试验,领先同类竞品约1.5年(信达IBI3009、恒瑞SHR-4849等,和ZL1310一样,均连接的拓扑异构酶I抑制剂,授权最高交易额均为10亿美元,均处于I/II期研发过渡阶段),预计2027年底或2028年初大概率能凭借全面胜出的ORR数据加速上市获批。未来凭借其高效低毒,尤其是脑转移细分领域最佳疗效等潜在优势,在广泛期小肺一线、二线均可占据更大的联用市场空间(目前主要是一线联用PD-L1,可能联用塔拉妥,26年可以看到初步数据和联用方案),甚至成为治疗小细胞肺癌的基石级药物;
(6)TROP-2 ADC:通过抗体特异性地结合在肿瘤细胞表面高表达的Trop-2蛋白,然后被内吞进细胞释放强效化疗毒素(如SN-38)。其独特的“旁观者效应”还能杀伤邻近的Trop-2低表达肿瘤细胞,有助于克服肿瘤异质性,能实现“精准打击”。主要代表为戈沙妥珠单抗(SG),二线治疗ORR 41.9%,中位OS提升至13.6个月,是一个显著的进步。此外,SG对脑转移患者也显示出初步疗效,为这类预后极差的患者提供了新选择。国内恒瑞SHR—A1921早期研究显示。对于重度经治的广泛期小肺,无论TROP-2表达情况,仍有一定疗效(ORR 33.3%,DCR66.7%,不过DoR只有4.4个月);
(7)DS7300a(简称I-DXd):是由第一三共和默沙东联合开发的一款靶向B7-H3的抗体偶联药物(ADC),它通过一个靶向B7-H3蛋白的抗体将高活性的化疗药物(跟ZL-1310一样均为拓扑异构酶I抑制剂)精准地递送到癌细胞内部,实现“精准爆破”。B7-H3在约65%的小细胞肺癌中高表达,使其成为一个理想的靶点。临床前数据显示出很强的抗肿瘤活性。在一项I/II期研究(NCT04145622)中,DS-7300a在可评估的小细胞肺癌患者中获得了52.4%的ORR,且耐受性良好。且在基线存在脑转移的65名患者中,DS-7300a的颅内客观缓解率达到46.2%,其中30.8%的患者甚至达到颅内完全缓解。对于未接受过脑部放疗的患者,颅内缓解率更高,达57.7%。但出现了约12.4%的肺炎/ILD安全性事件(11 起 1 级或 2 级、4 起 3 级和 2 起 5 级ILD/肺炎事件),因此当三期试验病人样本量扩大后,更大数量的五级ILD事件在临床过程中才被暴露了出来,最近已在全球范围内被暂停小细胞肺癌的关键III期临床试验;
(8)ABBV-011及ABBV-706:ABBV-011是艾伯维研发的一款曾备受关注的靶向SEZ6的抗体偶联药物(ADC),用于治疗广泛期小细胞肺癌(ES-SCLC)。不过,其一期临床开发因肝毒性等严重安全性问题早已终止,目前已转及向ABBV-706的研发。在二线及以上研究中,对于铂类化疗后早期复发(无化疗间隔<90天甚至<30天)的难治性广泛期小肺患者,ABBV-706的ORR依然分别达到59%和53%,为这些预后极差的患者克服铂类耐药提供了新的希望。而在基线存在脑转移的患者中,ABBV-706也观察到了57%的ORR,表明该药物有望对脑转移病灶产生效果;
(9)而其他化合物,如Bcl-2抑制剂、表观遗传调节剂EZH1/2抑制剂和DNA修复酶PARP抑制剂等,虽也在小细胞肺癌不同分子分型和个性化治疗领域进行了一些前沿探索,在克服化疗耐药或激活特定的抗肿瘤机制方面有一定潜力,但均因疗效提升不甚显著或存在一定安全性问题,暂未看到成为未来标准或联合治疗基石级药物可能,因篇幅有限,这里就不再赘述。
而对于晚期小肺患者和家属来说,每一个研发的新药都像是一根救命稻草。现在全球有超过50种针对小细胞肺癌的新药在研发中,塔拉妥和ZL1310带来曙光的同时,DS7300a的突然暂停研发,再次提醒我们:它们就像黑暗中的火柴,能点亮希望,也可能突然熄灭。科学没有‘特效药’,只有‘试效药’。我们必须清醒地认识到,创新药的研发之路极其坎坷和艰难,临床失败率高达90%。这不仅是医学挑战,也意味着投资创新药有很高的不确定性,不过科学探索从无坦途,但每一次尝试,无论成功还是暂停,都是为了最终战胜疾病迈出的重要一步,都值得我们的关注与尊重。
最后道一句扎心的真相:“医学进步从来都是这样,是用无数失败铺就的路——我们既要敢赌希望,更要谨慎乐观,估算风险,在无数次跌倒中匍匐前行,寻找黑夜里那一束光。”
