迈威生物抗ST2单抗9MW1911一期临床试验报告与astegolimab对比
By OYang
提示:对比结论请快速跳转至文末(从加黑段开始)。
在之前的专利比较的文章中,对比了迈威生物的9MW1911和罗氏的astegolimab单抗差异,详见:网页链接
2025年7月31日,Frontiers杂志释放出了$迈威生物-U(SH688062)$ 抗 ST2 单克隆抗体 9MW1911一期临床试验论文。具体如下:
抗 ST2 单克隆抗体 9MW1911 的安全性、耐受性、药代动力学、免疫原性和药效学:首次人体 1 期研究的结果,网页链接
背景:9MW1911 是一种靶向人 IL-33 受体 ST2 的高亲和力人 IgG4 单克隆抗体。它可通过阻断 IL-33/ST2 通路产生抗炎作用。这项首次人体试验(NCT05803902)旨在评估9MW1911在健康参与者中的安全性、耐受性、药代动力学、免疫原性和药效学: 这项Ⅰ期随机、双盲、安慰剂对照研究共招募了 48 名健康成人。经过长达 28 天的筛选期后,他们接受了单次递增静脉注射剂量(从 25 毫克到 1200 毫克不等)的 9MW1911 (每次剂量 6 人)或匹配的安慰剂(每次剂量 2 人)。对安全性、药代动力学、免疫原性和药效学参数进行了评估,并在用药后第113天进行随访: 不同剂量的9MW1911安全性和耐受性良好。大多数不良反应为轻度至中度,无需治疗即可缓解。没有观察到与剂量相关的不良反应,唯一的严重不良反应(胎儿畸形)被认为与研究药物无关。9MW1911的血清药代动力学在100-1200毫克之间呈线性关系。所有参与者均未检测到抗药性抗体。该研究表明,9MW1911对健康参试者安全且耐受性良好,在较高剂量水平上呈现线性血清药代动力学特征。该研究表明,9MW1911 对健康参与者的安全性和耐受性良好。
$罗氏控股(RHHBY)$ 抗 ST2 单克隆抗体 astegolimab 的药代动力学 (PK),详见:网页链接:
Astegolimab 是一种抗 ST2 单克隆抗体,可阻断 ST2/IL-33 炎症级联反应的启动。这里表征了皮下 (SC) astegolimab 在健康志愿者中的安全性、耐受性和 PK。
两项双盲、安慰剂对照的I期研究将健康成人(6:2)随机分配接受单次(SAD;2.1-420mg)和多次递增(MAD;70-210mg Q4W或Q2W)皮下注射剂量的astegolimab或安慰剂。终点包括AE、免疫原性、血清PK和可溶性ST2(sST2)。
48名受试者参加SAD(astegolimab,n=36;安慰剂,n=12),32名受试者参加MAD(astegolimab,n=24;安慰剂,n=8)。没有发生严重或致命的 AE 或因 AE 引起的退出。接受 astegolimab 治疗的 SAD 参与者 5/35 (14.3%) 和 MAD 参与者 5/24 (20.8%) 在基线后产生抗 astegolimab 抗体。在SAD中观察到非线性PK;均值C麦克斯和AUC最后超过 2.1-420 毫克按比例增加超过剂量,但与 ≥70 毫克的剂量大致成正比。疯狂C麦克斯和AUC头70-210mg 的剂量比例(图)。
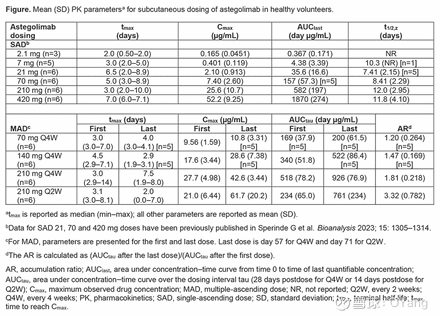
Astegolimab耐受性良好。PK 数据为随后一项针对严重哮喘患者 (NCT02918019) 的 II 期试验的剂量提供了信息,该试验还报告了 70-490 mg astegolimab Q4W 的剂量比例 PK。健康志愿者和哮喘或慢性阻塞性肺病患者的基线 sST2 水平相当。COPD 患者的 PK 将在关键研究中得到证实 (NCT05037929;NCT05595642)
对两个管线一期临床试验结果的比较:
9MW1911和Astegolimab都是抗ST2单克隆抗体,以IL-33/ST2通路为靶点,旨在发挥抗炎作用。虽然它们具有共同的机制,但它们的早期临床试验数据显示出一些不同之处:
1、给药途径:
- 9MW1911 在第一阶段研究中以单次静脉注射给药。
- Astegolimab单抗在第一阶段的单升剂量(SAD)和多升剂量(MAD)研究中采用皮下注射(SC)给药。
2、试验设计和参与者(第一阶段):这两种药物都在健康成人中进行了随机、双盲、安慰剂对照的 1 期研究。
- 9MW1911 的试验涉及 48 名健康成人,他们接受了 25 至 1200 毫克不等的单次静脉注射剂量。
- Astegolimab单抗的 1 期计划包括两项研究:
(1)一项 SAD 研究,有 48 名参与者(36 人接受 astegolimab,12 人接受安慰剂),剂量从 2.1 毫克到 420 毫克不等。
(2)有 32 名参与者参加的 MAD 研究(24 人接受阿替戈利单抗治疗,8 人接受安慰剂治疗),剂量从 70 毫克到 210 毫克不等,每 2 周或 4 周给药一次(Q2W 或 Q4W)。
3、安全性和耐受性
- 9MW1911 和Astegolimab单抗均安全且耐受性良好。两种药物均未报告严重或致命不良事件(AE)、死亡或因AE而停药。
- 9MW1911 的大多数不良反应为轻度至中度,无需特殊治疗即可缓解。未观察到与剂量相关的 AE,且单例严重 AE(胎儿畸形)被认为与研究药物无关。
4、药代动力学(PK)
- 9MW1911 的血清药代动力学(PK)在 100 至 1200 毫克的剂量范围内呈线性关系。
- Astegolimab单抗的 PK 曲线更为复杂:
(1)在 SAD 研究中,在整个剂量范围(2.1-420 毫克)内都观察到了非线性 PK,平均 Cmax 和 AUClast 的增加超过了剂量的增加比例。
(2)然而,在 SAD 研究中,Astegolimab单抗在剂量≥70 毫克时显示出近似剂量比例的 PK,而在 MAD 研究中,Astegolimab单抗在 70-210 毫克时显示出剂量比例的 PK。罗氏根据第一阶段的结果:Astegolimab单抗第一阶段的 PK 数据为随后进行的重症哮喘第二阶段试验的剂量提供了依据,该试验也报告了 70-490 毫克 Q4W 给药的剂量比例 PK。
5、药效学(sST2 水平):
- 9MW1911 会导致血清中可溶性 ST2 总量(sST2)增加,并在较高剂量水平下趋于稳定,这表明靶标结合具有持续性。
- 对于Astegolimab单抗,发现健康志愿者与哮喘或慢性阻塞性肺病患者的基线 sST2 水平相当。资料来源显示,sST2 是一个评估终点,但没有明确详细说明用药后对健康志愿者 sST2 的影响。
5、免疫原性(抗药物抗体):在免疫原性方面观察到明显差异:
- 在接受 9MW1911 治疗的参与者中未检测到抗药性抗体 (ADA)。
- 对于Astegolimab单抗,有相当比例的参与者产生了抗体: 在 SAD 组和 MAD 组中,分别有 14.3%(5/35)和 20.8%(5/24)的患者在基线结果出来后接受了Astegolimab单抗治疗。
5、一期临床意义: 均认为数据支持继续开发针对严重哮喘患者的 II 期试验提供了剂量依据。
个人观点:从一期临床数据的信息,相信我们可以看出这两个单抗,尽管都是抗ST2单抗,但在临床表现上有非常大的差异,这或许为将来进一步验证打下了伏笔。
供参考/不作为投资建议。
