OYang
· 英国
#药闻简讯# 重磅!AD创新药中美双报!
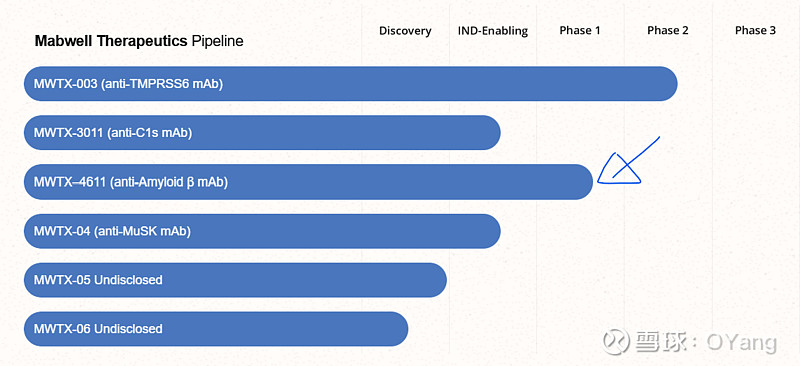
2025年10月3日——美国生物技术公司 Mabwell Therapeutics 宣布,美国食品药品监督管理局 (FDA) 已批准 MWTX-4611 的新药临床试验 (IND) 申请,授权启动针对轻度认知障碍 (MCI) 和阿尔茨海默病导致的轻度至中度痴呆患者的临床试验。阿尔茨海默病是全球最普遍、最严重和最致命的神经退行性疾病之一。
与此同时,中国国家药品监督管理局(NMPA)已于2025年9月11日批准9MW4611注射液(MWTX-4611注射液)针对相同适应症的IND申请。这两个监管里程碑标志着MWTX-4611全球开发迈出了重要一步。
MWTX-4611 是一种全人源单克隆抗体,可选择性靶向 Aβ 原纤维(一种与阿尔茨海默病相关的神经毒性 β 淀粉样蛋白)。临床前研究表明,MWTX-4611 以剂量依赖性方式显著降低原纤维水平和斑块负担。
重要的是,MWTX-4611 与目前已获批的抗 Aβ 疗法(例如 Leqembi® (lecanemab))有着明显的区别。 该抗体对 Aβ 原纤维的选择性比单体高出约 5 倍,有效减轻了全身给药相关的“外周吸收”效应,并有可能降低有效剂量并延长给药间隔。(即:更高选择性的长效制剂)
Mabwell Therapeutics是一家总部位于美国的生物科技公司,专注于开发针对严重疾病和罕见疾病的创新抗体疗法。该公司是$迈威生物-U(SH688062)$ 科技股份有限公司的全资子公司。网页链接