CDH17这势头,真是拦都拦不住了啊/转载
15 December 2025/Jacob Plieth
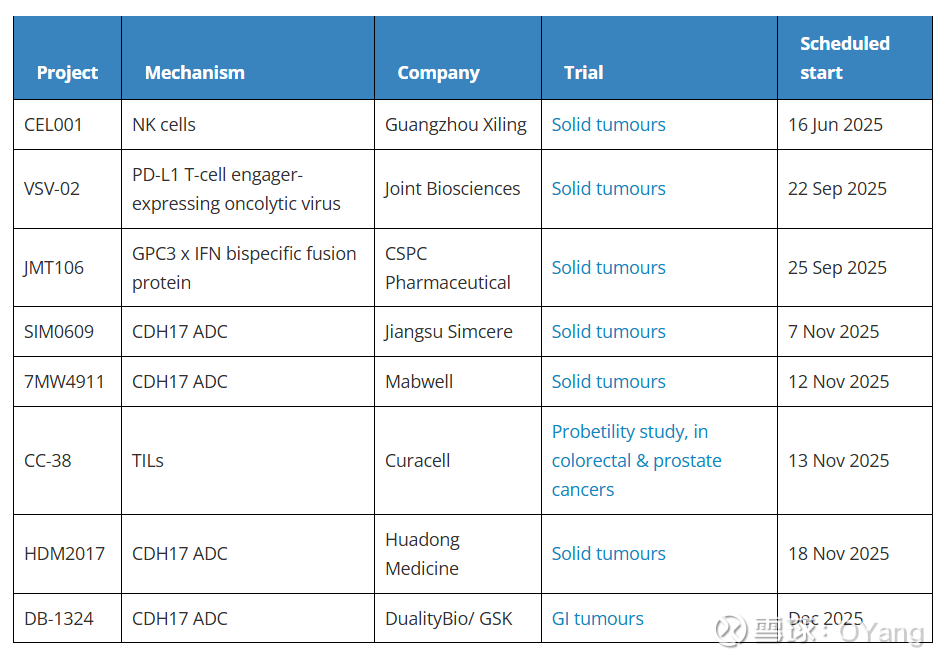
目前,CDH17(钙黏蛋白17)已成为抗体药物偶联物(ADC)研发企业公认的热门靶点,这一点已毋庸置疑。近期美国临床试验注册平台(ClinicalTrials.gov)的信息显示,又有四款靶向CDH17的ADC药物进入了首次人体研究阶段,分别来自江苏先声药业(Simcere)、$迈威生物-U(SH688062)$ (Mabwell)、华东医药(Huadong Medicine)和映恩生物(Duality Biologics),使得该领域的竞争格局进一步升温。
截至今年7月,全球共有11个抗CDH17 ADC在研项目,其中6个已进入临床试验阶段。此前处于临床前阶段的项目中,华东医药的HDM2017、先声药业的SIM0609以及迈威生物的7MW4911均在2025年美国癌症研究协会(AACR)年会上以临床前研究海报形式展示数据。此后,礼新医药(LaNova)的LM-350也已进入人体试验阶段,而南京维立志博(Nanjing Leads)的LBL-054-ADC和SOTIO公司的SOT109预计将于明年提交新药临床试验(IND)申请。随着最新一批项目进入临床,进入临床阶段的抗CDH17 ADC总数已达到11个(此外还有一些通过其他作用模式靶向CDH17的项目)。
大药厂入局
在新进入临床的项目中,最引人注目的或许是映恩生物(Duality Biologics)的DB-1324。早在一年前,葛兰素史克(GSK)就以3000万美元首付款获得了该项目在中国以外地区的优先购买权,但当时并未披露DB-1324的靶点是CDH17。无独有偶,SOTIO公司从百奥赛图(Biocytogen)授权引进一款单抗用于开发ADC(即现在的SOT109)时,最初也对靶点信息保密。迄今为止,对CDH17靶点最大的背书似乎来自罗氏(Roche),该公司于今年10月向翰森制药(Hansoh Pharma)支付了8000万美元预付款,获得了HS-20110的海外权益。
在今年的AACR年会上,CDH17靶点真正崭露头角——其特点是在胃肠道癌细胞中过度表达,但在正常组织中由于分布隐匿而难以接近,这使其成为有潜力的肿瘤药物靶点。尽管目前的授权交易金额相对而言并非天文数字,但这或许反映了中国本土研发的抗CDH17 ADC项目供给充沛,甚至超过了当前的需求。值得注意的是,新进入临床的三款ADC——先声药业的SIM0609、迈威生物的7MW4911和华东医药的HDM2017——目前仍未被跨国药企引进合作
抛开CDH17不谈,近期进入人体试验的新疗法还包括了广州希灵生物的NK细胞疗法和科瑞尔生物(Curacell)的TIL(肿瘤浸润淋巴细胞)疗法。这表明,尽管此类疗法过往的临床历史并不突出,但业界对其的兴趣依然不减。
GPC3(磷脂酰肌醇蛋白聚糖3)仍是治疗实体瘤的热门靶点。不过,石药集团(CSPC)的JMT106并非采用CAR-T或T细胞衔接器形式,而是一种融合蛋白,它将GPC3靶向与干扰素受体激活相结合,以刺激免疫系统。JMT106已于今年5月获准在中国开展临床试验。
而进入临床阶段的、在科学上最具新意的疗法,当属健新原力(Joint Biosciences)的溶瘤病毒VSV-02。然而,这并非普通的溶瘤病毒。它经过额外工程化改造,可表达一种双特异性抗体——具体而言,是一种抗PD-L1的T细胞衔接器——该公司称,这种表达是“仅在肿瘤细胞内”发生的。