一文简览之基因编辑
本文为$青侨阳光(P000385)$ 9月报投资思考部分节选~
——————
青侨基金的投资思路,是在大类之间保持多元分散,但在大类内部寻求相对聚焦。对于国产创新药,青侨基金相对聚焦于能最大化发挥中国创新药产业禀赋优势的工程化抗体领域,尤其是那些正在孕育
世界级原创大药、未来有望成为世界级药企的公司。对于国产创新械,青侨基金优先关注在具备巨大成长空间的新兴赛道里展现突出效率优势的潜在龙头企业,尤其是那些正在孵化国际原创大单品、有望不断打开国际化发展空间的公司。而对于美股生科,青侨基金主要投资于最具颠覆性成长潜力的入胞生物科技,尤其是已有产品被证明处于主流方向性能曲线顶端的开辟式引领型公司。
在上述3大类创新资产里,国产创新药械的既往讨论比较充分,而美股生科的探讨相对较少。考虑到当前青侨基金在美股生科上的投资兴趣主要集中在siRNA和基因编辑这两类入胞生物科技资产,而siRNA技术在2年前(2023年5月)月报里已经做过专题分析,因此,这里也借月报的机会系统梳理一遍我们对基因编辑技术几个重要问题的理解与认知。
一、基因编辑:治愈的诱惑,与终极治疗方案
为什么要关注基因编辑?
在回答这个问题之前,先跑个题,聊一下“要素还原”的话题。我们知道,人都有被解释(以及解释之后被指导)的内在需求,在现代意义上的科学诞生之前,人们就已经在用各种自认为合理的故事和叙事去解释万物:天空会打雷/闪电/下雨,是因为天上住在有雷公/电母/雨神;有人突然得了重疾怪病,可能是做错什么遭到了天罚;而有人生性勇敢可能是因为他的胆长得特别大,有人容易发怒是因为他的肝里有火或者脾里有气……直到后来,随着知识和经验的积累,人们开始学会用证据说话、学会用逻辑推导,慢慢地就学会了用基于要素还原的分析方法来来替代靠捕风捉影和脑洞大开的想象性解释,这就是科学精神的起源。自此,人们对万事万物的解释,开始从神话传说的故事阶段进入到基于要素还原的科学阶段。
人们对事物进行要素还原的能力,取决于当时的思维方式与科技水平。基于要素还原水平的不同,生物医学发展历史也可以被清晰地分成几个层层递进、代际分明的历史阶段:1、自古希腊开始,解剖等经验的积累,将个体层面的生物医学问题还原到了器官和组织层面;2、文艺复兴以来,显微技术的突破和化学的发展,将器官与组织层面的生物医学问题还原到了细胞和生理水平;3、1950s年代以来,分子生物学迎来发展,将细胞层面的生物医学问题还原到了分子和原子水平。
“个体==>器官==>细胞==>分子”,浮出来看,似乎只是科学又往前走了一步,但深进去看,这里每一次还原层级的突破所带来的认知增量都是颠覆性、革命性、爆炸性的跃迁。比如,当我们现在去看一家药企的研发管线,去研究一款药物,就一定逃不过该药物的分子结构、作用靶点、及其背后的分子机制。可以毫不夸张地说,我们现在所讨论的生物医药产业,不管是PD1单抗、Trop2 ADC、GLP1双重受体激动剂,还是HMG-CoA还原酶抑制剂、BTK抑制剂、AR PROTAC,还是CART、基因疗法等等,无不构建在分子生物学这一关键技术底座之上。
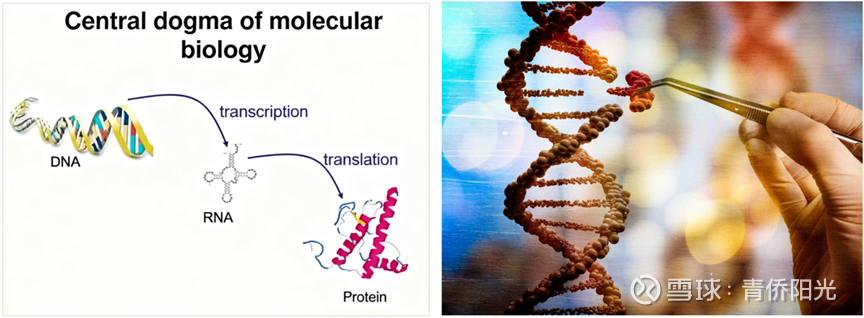
而对于分子生物学这一底座来说,有一个最为重要的统领性规则,即分子生物学的中心法则:“DNA-->RNA-->PROTEIN”。在这个中心法则中,发挥各种功能的蛋白质,只是生命信息末端的执行者;而DNA才是生命信息的源头起点。因此,我们所谓的先天性疾病、遗传病等等,其病根都出在DNA上。对于这些疾病,针对终端功能蛋白的所有已知治疗,不过是小分子抑制剂、还是大分子抗体,本质上都是控制和缓解的姑息疗法,唯有直接纠正DNA序列的基因编辑才算得上是真正的治愈疗法。
从这点来说,分子生物学的中心法则就是基因编辑值得关注的最大理由:因为只有针对生命信息最源头的治疗,才最有可能一劳永逸地治愈所有先天遗传相关的疾病与痛苦。
基因编辑虽然技术路线繁多,但概况起来无非两步:1.找到目标序列(search);2.编辑目标序列(edit)。在这两个步骤中,其实更具挑战的是第一步。想象一下,让你站在上海外滩摩肩接踵的人流中,拿着一张人物照片去找一个你以前也不认识的陌生人,是怎样的一种挑战。基因编辑器,需要在动辄数亿个碱基对的基因组里找到自己想要的十几个碱基的序列,同样是个极其困难的过程。因此,在很长一段时间之内,制约基因编辑发展的最大瓶颈都是如何高效地找到目标序列。而根据找靶标序列方法的不同,我们可以把基因编辑简单地分为三个代际。
第一代基因编辑技术,是借助锌指结构蛋白来寻找靶标序列。我们知道,真核细胞内部存在很多被称为转录因子的天然蛋白质,这些蛋白质的作用就是识别和结合特定的DNA序列,然后上调或下调相关基因的表达水平。在这些转录因子中,非常多的蛋白都含有一个相似的结构,名为锌指蛋白ZFP(结合锌离子的手指状结构蛋白)结构。因此,人们首先想到的就是仿造天然,设计一些能识别特定DNA序列的锌指蛋白ZFP,再融合核糖核酸酶构成能切割靶标基因的锌指核糖核酸酶(ZFN)。下面左图就是一个经典的ZFN碱基编辑器的原理示意,一个编辑器由2个ZFN构成,一个ZFN由多个ZFP和一个核糖核酸酶构成,两个ZFN在两条链两边分别切割后形成DSB(DNA双链断裂),DSB在胞内会触发NHEJ(非同源末端连接)机制,而NHEJ机制会在DNA切口附近引入随机的indels(小片段插入inserts或小片段缺失deletions),这些indels最终会以移码突变的方式导致目标基因功能的沉默与敲除。ZFN的起步比较早,随着1995-1996年ZFN的发明和Sangamo公司(SGMO.O)的成立,基于ZFN的基因编辑就开始起航,只不过早期发展较为坎坷,到2000s年代后期才有所加速。
第二代基因编辑技术,是借助转录激活物样效应物(TALE)来寻找靶标序列。ZALE是在一些植物病原菌中找到的独特机制,它与ZFP一样也是能识别特定DNA序列的蛋白结构,只不过ZFP是每个锌指结构(大约30个氨基酸)识别3-4个碱基,而TALE是单个结构单元(大约33-35个氨基酸)只识别1个碱基,因此TALEN在设计上远比ZFN更为灵活,可以像搭积木一样去设计能识别任何靶DNA序列的氨基酸序列,只不过分子量要大很多,如果体内递送会更加困难。TALE也可以融合Fokl等核酸酶形成TALEN(这里的N代表Nuclease核酸酶),然后两个TALEN联合就像两个ZFN联合一样,去切割和破坏目标基因。该机制最初是2009年发表,美股上市的cellectis(CLLS.O)就用TALEN开发了很多通用CART。

第三代基因编辑技术,是借助成簇的规律间隔的短回文重复序列(CRISPR)来寻找靶标序列。CRISPR是在一些细菌和古细菌中发现的特殊的DNA序列,它们可以被转录成小RNA去寻找噬菌体等病毒DNA,一旦发现就通过招募的核酸酶Cas对其DNA进行切割和破坏,该机制在2012年得到清晰阐述并在2020年获得诺贝尔奖。可以看到,CRISPR转录的RNA起着类似ZFP和TALE的搜寻靶标序列的作用,而Cas起着类似Fokl的核酸酶功能。只不过,ZFP和TALE的蛋白是依赖“蛋白质-DNA”识别,而CRISPR转录的RNA是用“RNA-DNA”识别;然后,Cas核酸酶只需要一个就能完成Fokl核酸酶才能完成的DNA双链切割。
将靶标的识别机制从“蛋白质-DNA”升级成“RNA-DNA”,所带来的影响是极其深远的。因为决定蛋白质结合性能的是高度异质化的三维结构,而决定RNA结合性能的是相对标准化的二维序列(只有4种碱基配对、只不过无穷组合排序而已),两者在设计和递送难度、制备和研发成本上有着云壤之别。举个例子,为了敲除某基因,CRISPR/Cas9体系用的sgRNA核心区域可能20nt就能完成靶标序列识别,而TALEN可能两边合计30多个nt*每个nt需要33-35个氨基酸来识别*每个氨基酸需要3个核苷酸=RNA核心区需要3000多个nt才能完成类似的靶标序列识别(假设利用mRNA递送而不是RNP电转),两者差了100倍量级。需要导入复杂得多的靶序列识别元件,而且还需要两套工具来配合编辑,不只是增加制造成本和递送难度,更重要的是会严重影响编辑效率——2024年发表的一项对比研究,用CRISPR/Cas9或TALEN编辑人胚胎干细胞SORT1,两者编辑效率分别为76% VS 11%——后者只有10%多的编辑效率,在科研场景下制备些模式动植物,或在体外场景下制备些通用CART是可以的,但要想递送到体内去编辑,10%多的编辑率是完全没法想象的。这里巨大的编辑效率差异,不仅变成了压在TALEN(和ZFN)头上的沉重大山,也彻底点燃了人们对CRISPR/Cas技术的狂热期盼。
如果说从一代ZFN到二代TALEN是小踏步升级的话,那么从二代TALEN到三代CRISPR/Cas就是爆发性跃迁。在CRISPR/Cas技术的推动下,基因编辑技术开始加速迎来产业化的春天。
二、传统CRISPR/Cas编辑:基因魔剪
根据识别靶标序列机制的不同,我们可以把基因编辑分为ZFN,TALEN,CRISPR/Cas三代。而在CRISPR/Cas编辑内部,根据靶标识别后的编辑/修饰方式不同,又可分成只依赖核酸酶的传统CRISPR/Cas编辑、融入脱氨酶的碱基编辑(BE)、和融入逆转录酶的先导编辑(PE)三个技术代际。下面,我们根据不同的技术代际进行逐一梳理。
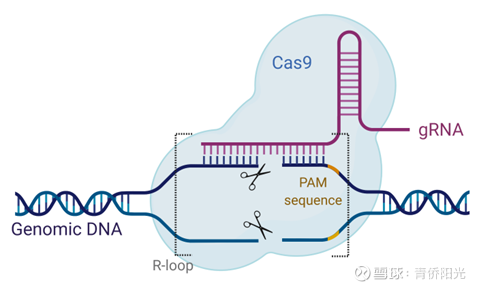
首先,是只依赖核酸酶的传统CRISPR/Cas。其中最常见的组合是:gRNA(用碱基配对来搜寻)+Cas9蛋白(切割DNA双链的核酸酶),这个组合模仿了天然存在的II型CRISPR/Cas体系,但把复杂的crRNA + tracrRNA双RNA组合换成了更简单的单一gRNA。另外,Cas9也并非完全不参与DNA序列的识别,Cas9会用特定结构识别一个叫做PAM的序列,比如最常用的Cas9来自化脓链球菌SpCas9,它识别的PAM序列是NGG(N=A\T\C\G任一碱基);PAM相当于在DNA链上为Cas9提供了“着陆点”。只要gRNA+Cas9组合在基因组里找到与gRNA高度匹配的序列,然后边上有PAM着陆点,就可以结合该段DNA并对其中的特定位置进行双链切割。之后发生的过程与ZFN或TALEN是类似的:CRISPR/Cas9会DBS,DSB会触发NHEJ,NHEJ会引入indels,indels会导致移码突变,并最终导致目标基因的沉默和功能敲除。
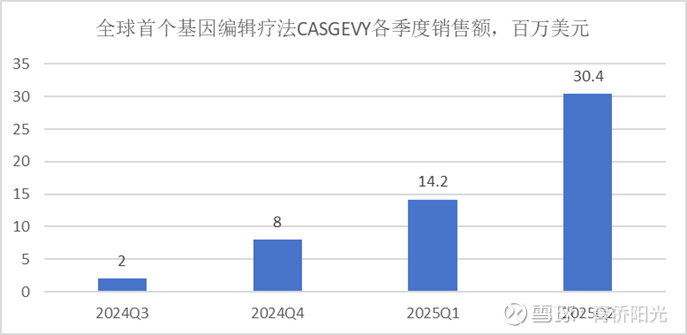
当前美股上市的基因编辑公司多数属于这一类别。商业化进展最快的C公司的先发项目是体外编辑项目,在体外对造血干细胞或T细胞进行编辑后回输治疗,比如C公司授权Vertex开发的CASGEVY,就是模仿HPFH患者的天然突变,用重新激活胎儿血红蛋白的表达来治疗镰刀贫血症SCD和地中海贫血TDT。该产品在2018年获批临床,2022年报产,2023年底获批,2024年正式商业化,上市后的季度销售额从2024Q3的200万美元到2025Q2的3040万美元,作为一款单价昂贵的全球首创疗法(昂贵意味着可及度低+首创意味着推广难度大),在早期能获得这样的放量速度已经算得上优秀,可见医生和患者对体外基因编辑疗法的接受度不低。
除了体外编辑造血干细胞之外,C公司还有多款体外编辑制备的通用CART产品在研——事实上,C的通用CART设计思路上相当程度借鉴了cellectis的先发经验,只不过因为CRISPR/Cas9相比TALEN有突出的技术优势,最终实现了追赶和反超。类似的例子在biotech领域比比皆是,可见保持底层技术领先的重要性,一旦底层技术被全面反超,那么再多的努力、再巧妙的设计,有一天也可能会成为他人的嫁衣裳。
C公司虽然在体外编辑的进度上明显领先,但在体内编辑的进度上却落后于另一家基因编辑I公司。I公司针对2个靶点(KLKB1和ATTR)的3个适应症(HAE和ATTR-CM和ATTR-PN)均已进入3期临床。其中,治疗HAE的3期在不久前已经完成超预期的提前入组,ATTR项目的入组速度也超预期,提示相关产品的临床获益可能较为优异,而且医生和患者对一次性治愈疗法的意愿可能比预期的更高,这对整个基因编辑赛道都是个积极信号。
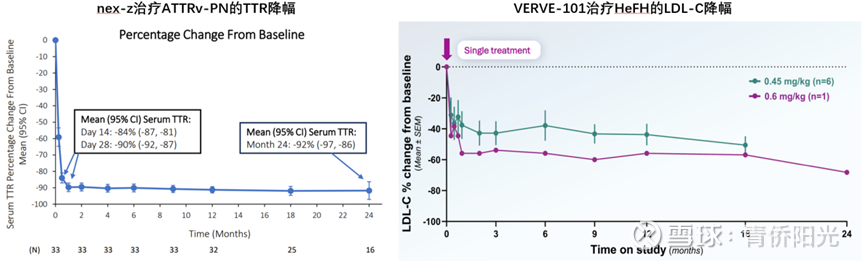
体内编辑的最大屏障在于递送,如何将基因编辑器递送进入目标细胞是个困难的事。好在肝脏递送上,因为Arbutus、Alnylam、Ionis等前辈的探索耕耘,用LNP载体将DNA或RNA分子递送进肝脏细胞已经是相当成熟的路线。因此,包括I公司在内的几家体内编辑的公司都采用了“LNP递送+肝脏靶向”的思路组合。不过LNP毕竟是个有相当成分的复杂载体,在体内大剂量使用时还是会带来ALT/AST等肝酶升高和注射部位反应等不良,这个对剂量还是会有明显的约束。比如I公司治疗ATTR的nex-z的量效关系非常漂亮,原则上说只要提高剂量就能明显提高疗效,但该药物在剂量爬坡时爬到0.7mpk和1.0mpk后AE率就开始大幅飙升,以至于后面I公司都不敢尝试超1mpk剂量,这就明显约束了疗效的进一步提升。
但I公司的这个困扰是可以得到优化改进的,答案就藏在V公司的内部项目迭代上。V公司的主导项目是通过基因编辑破坏肝脏PCSK9基因来治疗高脂血症,这是个既不那么危急也有大量替代疗法的领域,因此对安全性更为敏感。V公司的首个PCSK9项目(V-101)原来用的也是普通的LNP载体,该药物剂量爬坡到0.45mpk和0.60mpk就都出现了>=3级TRAE,这样的安全性数据,对于降脂这样的慢性大病来说基本就没戏了。但V公司并未就此放弃,而是紧接着开发了将递送载体升级为GalNAc-LNP的VERVE-102,该药物剂量爬坡到0.6mpk后,肝酶等指标都正常且无任何TRSAE,这是个很好的信号,说明把LNP载体升级为GalNAc-LNP有可能会显著提升安全性。LNP(纳米脂质体颗粒),进入血液循环后会吸附ApoE等各种血浆蛋白,ApoE会通过肝细胞表面的LDLR介导内吞;而GalNAc配体则能结合肝细胞表面的ASGPR,进而诱发内吞机制;因此,普通LNP只能通过LDLR单一途径入胞,而GalNAc-LNP能同时通过LDLR和ASGPR双重途径入胞,进入肝细胞的效率更高(比如LDLR低表达或不表达的肝细胞也能内吞入胞),进入其它组织或滞留血液而引发不良的风险就会相应降低。虽然V公司的V-102是递送的是碱基编辑器,而不是传统的CRISPR/Cas编辑,但在递送机理上,所有基因编辑逻辑上是通用的,因此在V公司的GalNAc-LNP完成初步验证之后,国外的P公司、E公司和国内尧唐等也都在快速跟进。V公司前脚在2025年4月公布V-102的积极临床数据,礼来后脚就在2025年6月以13亿美元收购V公司,应该是V-102的数据让礼来看到了基因编辑治疗慢性大病的可行性。
I公司和V公司的项目,不仅向我们展示了肝脏编辑治疗遗传罕见病和慢性大病的潜力,其早期临床数据,也展示了基因编辑疗法一个独有特质:虽然注射一次之后就再也没给过药,但疗效指标不仅不会随时间而衰减,反而可能会逐渐增强!比如下面左图是I公司的nex-z治疗ATTRv-PN的TTR降幅,2周时降幅是84%,中间未再给药,到2年时降幅反而加深到92%;下面右图是V公司的V-102治疗杂合子家族性高胆固醇血症的低密度脂蛋白LDL-C降幅,0.6mpk剂量下2周时降幅也就40%左右,中间未再给药,到2年时降幅反而扩大到60%以上。说明基因编辑的一次性治疗是真正的一次性治愈,而不像绝大多数AAV基因替代疗法那样,疗效过个2-3年就开始衰减,过个5年8年就没法看了。这是非常有吸引力的特征。
只依赖核酸酶编辑的美股CRISPR上市公司,除了先发体外编辑的C公司、主攻严重肝脏遗传病的I公司之外,还有两家比较特色的公司:一家是布局了RNA编辑的W公司,另一家是通过编辑3’UTR调节基因表达的E公司。这两家公司目前看都算不上最主流,但了解它们的在研产品,对我们建立对基因编辑技术更全面的理解和认识会有帮助。
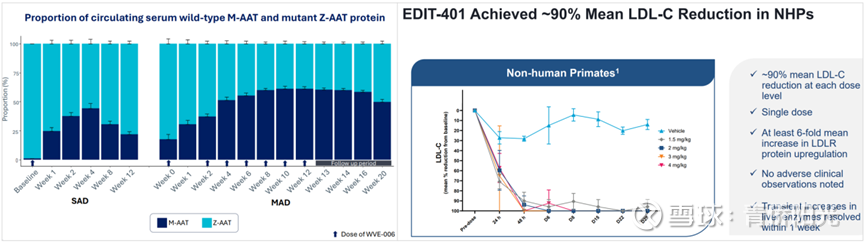
先看一下RNA编辑,RNA编辑的机理与DNA编辑类似,只不过靶向的是RNA而不是DNA、而且核酸酶是CAS12或CAS13而不是Cas9。相比DNA编辑,RNA编辑的优势是不会导致基因组的永久改变、所以不怕脱靶编辑带来的不可控突变风险,劣势也是不会导致基因组的永久改变、所以疗效无法持久而需要定期给药。看一下W公司W-006的疗效情况,下面左图以200mg剂量治疗AATD后M-AAT(好蛋白)与Z-AAT(坏蛋白)的相对变化,持续给药后差不多能让功能正常的M-AAT占到50%;在公司把剂量提高到400mg后,M-AAT占比仍然在50%左右,暗示该药已经摸到了疗效天花板。相比之下,B公司的碱基编辑产品B-302在60mg剂量下就已经让M-AAT占比提高到90%,P公司的先导编辑产品的疗效似乎还要更强,意味着相同靶点的RNA编辑的疗效明显不及DNA编辑。不过疗效低些还不是最麻烦的,最麻烦的是先导编辑等新技术已经可以做到几乎不存在脱靶编辑,RNA编辑讲的不会导致DNA永久改变的价值根基被破坏,如何找到强大的不可替代价值,将是相关企业进一步发展之前不得不面临的严峻考验。
再看一下E公司用3’UTR编辑来调节基因表达的案例。下面右图是E公司E-401的临床前数据,该药物通过编辑肝脏LDLR基因的3’UTR,3’UTR在mRNA终止密码子3’下游的非翻译区,不参与蛋白质的翻译,但参与mRNA稳定性与翻译效率的调控,因此对3’UTR逻辑上说确实会影响相关蛋白的表达水平。E-401在灵长类动物实验中,1.5mpk剂量下即可降低接近90%的LDL-C!这是非常惊人的数据,要知道过去20年里出过那么多的PCSK9i疗法,不管是安进、赛诺菲/再生元的PCSK9单抗,还是信达、恒瑞、君实、康方的PCSK9单抗,或是诺华从alnylam引进的PCSK9 siRNA,亦或是礼来收购V公司获得的V-102编辑疗法,它们对LDL-C的敲除和降低水平都只能在40%-60%之间徘徊,因此,LDL-C接近90%的降幅绝对算得上鹤立鸡群。而且,理论上说,编辑3’UTR来上调特定基因表达的机制绝不应该只局限于LDLR,因此,也或不定呢,或许从这里能衍生出一个不小的技术新天地?
三、碱基编辑与先导编辑:探索不止,迭代不休
上述这些产品都可归入CRISPR/Cas的第一代疗法:靠CRISPR找到靶标基因序列,然后用Cas核酸酶去“咔咔”两刀切断DNA双链,然后靠NHEJ机制引入的indels去破坏靶标基因功能。但这也有个问题:靶序列的搜寻相对精准,但搜到靶序列后的编辑却太过原始粗暴,DNA双链断裂(DSB)后NHEJ所带来的遗传结果太过随机混乱,而且始终伴随着基因组重排/异位以及脱靶编辑等风险。为了解决这一痛点,科学家们开始探讨在不切断DNA双链、没有那么多indels、脱靶风险降低甚至几乎清零的基因编辑新技术。
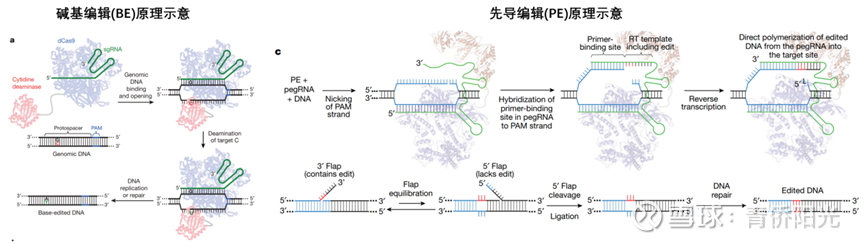
第一个突破来自哈佛大学/Board研究所的华裔科学家刘如谦(David Liu)。2016年,刘如谦团队发文,通过突变让Cas9失去切割DNA双链的能力(dCas),并在Cas蛋白上整合融入胞苷脱氨酶结构域,以此制备能在特定编辑窗口内将C编辑成T的胞嘧啶碱基编辑器(CBE)。一个全新的技术分支,单碱基编辑(Base Editing, BE)自此起航。不过CBE虽然解决了DSB问题,indels很少,编辑的遗传结果更可预期、更可控,但编辑窗口过宽的问题一直无法有效解决,因此长期被旁观者bystander效应所困扰(目标C碱基附近的C也会被编辑成T),加上脱靶效应虽然下降但仍可被检测,因此后续临床开发一直很谨慎。
2017年,刘如谦团队通过将CBE里的胞苷脱氨酶替换成了腺嘌呤脱氨酶,获得能在特定编辑窗口内将A编辑成G的ABE(腺嘌呤碱基编辑器)。虽然开发得更晚,但ABE编辑窗口比CBE更窄(膀胱者编辑问题更轻),而且全基因组的脱靶风险也更低,加上AàG编辑能解决的潜在遗传问题更普遍。因此,当前商业化的碱基编辑基本都是需求更广泛、过程更精准、结果更清爽的ABE。美股的B公司是转化自刘如谦实验室的单碱基编辑上市公司,其主导的SCD项目、ATTR项目、GSD1a项目,用的都是将特定位置的A变成G的ABE。
但ABE要想实现临床转化也有个必须回应的考验:如果将传统CRISPR/Cas升级成ABE,得到的只是“基因编辑遗传后果更可预期”这样的难以量化、难以比较的“理论上会存在的获益”,那在强调可测量价值的临床研究中会非常吃亏。好在ABE不仅是indels和脱靶编辑风险更小,其编辑效率也可以做到更高。以B公司的B-101为例,它与已经获批上市的CASGEVY类似,都是通过模仿HPFH患者的天然突变、重新激活胎儿血红蛋白(HbF)的表达来治疗镰刀贫血症。只不过B-101用的是“更先进文明”的ABE,而CASGEVY用的是“更原始粗暴”的传统CRISPR/Cas。下面是我们梳理的两款药物治疗SCD(镰刀型贫血症)的非头对头数据比较,可以看到B-101相比CASGEVY的优效趋势非常明显:
1、基因编辑过的CD34+HSC(造血干细胞)回输后,B-101只需要16.5天和19.0天就完成了中粒细胞和血小板的植入(engrafment),而CASGEVY则要27天和33天,这里的植入是指中粒细胞或血小板持续达到某个阈值之上,B-101编辑的造血干细胞达到理想细胞水平要快得多,说明不破坏DNA双链的ABE对细胞活性的伤害更少,保留的繁殖复制能力更强;
2、在细胞回输15个月后,B-101治疗患者的总血红蛋白最高升到了18.6g/dl,其中能提供正常功能的HbF(可以理解成是好的蛋白)占比升至65.3%,而容易导致镰刀型病变的HbS(可以理解成是坏的蛋白)占比降至34.1%;相比之下,CASGEVY治疗患者的总血红蛋白最高只升到了13.7g/dl,其中HbF占比只升高到41.5%,而HbS占比仍然高达54%;更高的总Hb和更高的HbF意味着更强的疗效,B-101实现细胞植入后未再有严重血管闭塞危象(sVOC)发生,而CASGEVY后续有2人出现sVOC,这些数据都指向,碱基编辑疗法B-101的编辑效率要显著优于基于传统CRISPR/Cas编辑的CASGEVY。这两点对于碱基编辑技术赛道来说还是很有意义的,因为它证明了碱基编辑相比传统CRISPR/Cas编辑,不仅可以更“文明”,也可以更“高效”。

不过,即使ABE相比传统CRISPR/Cas展现了更“文明”和更“高效”的优势,也不能就此认定碱基编辑代表了基因编辑的最优势和最前沿。因为,一个比碱基编辑还要“文明”、还要“高效”的编辑技术正在破土而出,即将崭露其锋芒。
2019年基因编辑领域迎来了另一个关键的升级突破,刘如谦团队将催化受损的nCas9(只剩DNA单链切割能力的Cas9变体)融合逆转录酶,并将gRNA替换成融合了gRNA+引物+转录模板的pegRNA,据此开发了先导编辑(P公司,PE)——其实,对于学过生物的同学,也可以把它理解成是“引物编辑”,因为PE不是简单的切而改,而是可以在引物的后面任意编辑想要的任何序列,然后逆转录后整合进目标位点。虽然引入逆转录机制让整个体系变得复杂,但从技术原理来说,PE相比传统CRISPR/Cas和BE,又完成一次大踏步的跃迁:
1. 先导编辑PE不仅可以像传统CRISPR/Cas那样通过插入或丢失碱基来破坏原有基因功能,而且对两条链的编辑是先后进行,不会造成DNA双链的同时断裂,因此不会产生大量随机不可控的indels(不会给编辑区域造成不可控的遗传后果),同时,先导PE从配对识别到引物结合再到模板复制需要3次配对,3次配对意味着3重检验,原则上几乎不可能再存在任何脱靶风险(不会在目标基因之外的地方造成任何编辑);
2.先导编辑PE不仅可以像碱基编辑BE那样对单一碱基进行编辑修复,而且不仅可以编辑A-->G(ABE)、C-->T(CBE),还能编辑A-->C、G-->T等任意碱基更换(编辑编辑的可用场景扩大),此外,PE通过引物实现明确的序列一一对应,不会对目标序列旁边的序列进行编辑(没有旁观者编辑带来的困扰);
3.除了比传统CRISPR/Cas更安全地破坏原基因功能、比碱基编辑更强大地修改任一碱基之外,PE还有很多其他基因编辑所不具备的新功能,比如对热点突变密集区进行一锅端式的编辑替换,比如以单个碱基精度的方式精确插入或精确删失1个或多个碱基,再比如通过与整合酶的联手将完整大基因片段精确插入靶标序列等等。
因此,从某种程度上说,前两代都还算不上真正的基因编辑:传统CRISPR/Cas充其量也只能算是把“基因魔剪”(只能破坏基因而不能修复基因),碱基编辑BE充其量也只是只“基因涂改笔”(只能对单一碱基进行有限规则的涂改)。唯有先导编辑PE才算得上真正的“基因编辑”(可以对目标序列进行任意形式的编辑性修改)。从技术理念上说,先导编辑已经接近于“通用碱基编辑”,有着显而易见的系统性优势。
当然,光是技术理念先进是远远不够的,最终还是需要把技术优势转化成临床优势才有现实意义,尤其是PE体系的复杂性远超传统CRISPR/Cas与BE体系,复杂性带来强大功能的同时会否严重牺牲编辑效率也需要打问号。不过现在看来,这一担忧似乎是多余的。从刘如谦实验室引进PE技术进行转化的P公司,在2025年披露了治疗p47phox CGD的首个项目的首2位患者临床数据:首位患者DHR+中粒细胞的占比从15天的58%增加到30天的66%再到60天的71%,保持了良好的逐级抬升趋势,且均远超20%的治疗阈值;第二位患者DHR+中粒细胞占比在第15天和30天分别达到70%和80%,也远超20%的治疗阈值。P47phox CGD是个非常小众的市场,P公司在战略重组后停止了该项目开发,但其披露的初步数据仍然给了我们班中窥豹的机会,从中看见PE在人体细胞中的高效编辑潜力。
P公司推进的第二个项目是体内编辑治疗Wilson’s Disease。,这是一种遗传性铜代谢障碍疾病,肝脏无法排除多余的铜导致铜在大脑等器官蓄积而带来持续损伤,欧美患者超2万,其患者基数远远大于p47phox CGD,目前尚无获批疗法。在该病的小鼠模型中,PE在两个关键突变的纠正上实现了接近90%的编辑率,这是BE都未必能做到的非常高的编辑效率。
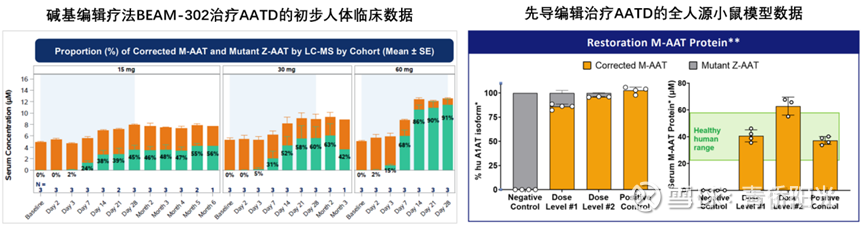
P公司的第三个项目是体内编辑治疗AATD,它的患者基数更大,欧美有接近20万患者,A公司有相关的siRNA疗法已经在做3期临床,B公司有相关的BE疗法已经在做1-2期临床。siRNA只能降低肝脏中突变的Z-AAT蓄积来缓解肝脏损伤,但不能促进正常的M-AAT分泌,无法解决肺因缺乏M-AAT而持续受损的问题,因此PE疗法的直接竞争对手主要是BE。下面左图是B-302在人体临床试验中的初步数据:编辑前,血浆AAT总量约为6uM,基本全是活性非常低的Z-AAT突变蛋白;15mg剂量编辑后,血浆AAT总量约8uM,活性正常的M-AAT占比可达50%以上;剂量增加到60mg后,血浆AAT总量约12uM,M-AAT占比增至接近90%。预计B-302在触发安全性风险前有机会把剂量继续提高到90mg,而血浆AAT有可能会达到更接近正常人群范围的14-15uM。这样的数据已经非常优秀,但先导编辑似乎有能力做得更好:下面右图是P公司的AATD项目在全人源化小鼠模型中的数据,在2个临床相关剂量下,M-AAT蛋白含量直接把总AAT拉回到20-60uM的人类正常水平,这一数据如何能在人体临床中得到复现,对于AATD治疗领域而言,将是相当了不起的突破与成就。
当然,PE也不是一开始就如此高效。事实上,基于上述理念做的一代编辑器PE1在一开始尝试时甚至没有得到可被检测的编辑,后来将pegRNA中的引物结合序列扩展到8-15个碱基后才检测堪堪实现2%-3%的编辑率。然后通过对逆转录酶各种点突变筛选优化,将编辑率提高到5%以上(PE2)。之后又进行了一系列优化改进:在非编辑链引入新切口,让细胞在处理异源序列时选择编辑链而非未编辑链进行修复,提高编辑效率(避免被修复机制修复回原始序列);通过在pegRNA的3’端引入结构化的基序来增加稳定性避免降解(可以让pegRNA在胞内存留更久);在胞内引入MLH1dn来抑制内源性的DNA错配修复机制(避免已编辑链被修复回去的同时进一步降低indels风险)……正是在这一次次试错、优化、迭代之后,先导编辑的效率才一点点地从2%、5%、10%、20%逐渐提升到40%-50%以上。
这是个熟悉的剧本,从DNA克隆、基因重组,到抗体药物,再到siRNA技术,每个颠覆性新技术在理念诞生的那刻起,就伴生着茫茫多的问题与挑战。但总归会有一大批人站出来去直面这些挑战,他们基于兴趣也好、基于信仰也罢,他们的努力汇集在一起就形成了技术迭代优化路上绵绵不绝的力量源泉;然后迟早会有一两个幸运儿捡到那把钥匙,打开阻挡着技术进步的那扇门;于是人们鱼贯而出,一起涌入刚打开的新天地,创造出百花齐放的新奇迹;然后遭遇新的挑战,触摸到新的瓶颈,并开始蓄积新的突破与进击。
或许先导编辑PE未来的临床转化之路上也是荆棘密布,也还会有大量未曾预料的挑战埋伏在路上;或许PE也不是基因编辑的终极方案,说不定哪天在哪里就冒出一个人,提出一个我们现在还想象不出、但看到时一定会为此惊叹的新方案。但至少有一点是可以肯定的:人类向来是不会安分的,只要有机会有能力,人们不会只听信于所谓的命运,闭上眼睛地全盘接纳自然突变带给我们的疾病与苦痛;而基因编辑的出现为人们带来了全新的希望,让我们有机会在底层的基因层面直接解决疾病的最根源;考虑到人类的不安分与基因编辑的巨大潜力,我们可以相信,基因编辑技术会在人们永无止境的探索与冲锋之下,不断进化,不断优化,不断发展。
路虽远,行则将至,一个因为通用型基因编辑技术的普及性应用而让整个生物医药产业迎来系统性变革与蓬勃新生的未来,是值得期待的。
四、基因编辑 VS siRNA:入胞生物疗法的技术主线之争
对于生物药的前沿趋势,我们有过一个基础判断,即:全球生物科技正在进入以入胞生物技术为引领的全新的入胞时代;而在众多入胞生物技术中,我们优先看好的是siRNA和基因编辑。目前为止,我们仍然坚持这样的判断。看好siRNA,是因为作为小核酸的独特优势,让siRNA有机会摆脱载体递送带来的桎梏,凭借无载体递送的巨大优势,率先走向全面成熟。相比之下,其它多数入胞生物技术因为需要递送大核酸,目前为止还无法摆脱对LNP与AAV等复杂载体的依赖,要么局限于肝脏难以实现肝外递送(LNP载体),要么有着巨大的不可控风险无法广泛普及(AAV载体)。而看好基因编辑,是因为在涉及遗传因素相关的疾病治疗时,不管是多肽、单抗、或是RNA药物,本质都只是控制和缓解的姑息性治疗,唯有直捣黄龙的基因编辑具有一劳永逸的治愈性治疗潜力。
但siRNA与基因编辑并不是两条各自平行发展的技术路线,两者之间也存在大量的交叉和竞争。比如,siRNA的主要机制是在RNA层面对基因功能进行敲除和沉默,而当前占主导的传统型CRISPR/Cas基因编辑的主要机制,是在DNA层面对基因功能进行敲除和沉默;两者在机理上是竞争的,都是对基因功能的敲除与沉默。然后,siRNA目前主要针对的还是肝脏场景(肝外递送还在拓展初期);而基因编辑目前开发的重点也是肝脏场景(体外编辑血液来源细胞相对次要)。因此,逻辑上说,siRNA与基因编辑,在肝脏场景的基因敲除与沉默领域,有着激烈的技术路线竞争。事实上,这两大技术在多个肝脏基因功能敲除的应用场景上已经兵戎相见了。
首先是ATTR项目,通过敲除肝脏ATTR来治疗ATTR-PN和ATTR-CM。全球ATTR患者可能多达40-50万人,这些患者因为突变型或野生型ATTR蛋白在神经系统和心脏等器官的淀粉样沉积,导致严重的神经性疾病或心脏性疾病等(比如ATTR-CM是导致心衰的重要原因),带来痛苦病症的同时严重损害预期寿命。足够大的患者基数加上足够严重的疾病后果,催生了足够可观的市场空间。当前的治疗主要包括两类(两个机制之间可以协同,机制内部有竞争),一类是稳定TTR蛋白的小分子药物,市场开发较早,2024年辉瑞的TTR稳定剂tafamidis销售额已经突破50亿美元,开发了下一代TTR稳定剂的BridgeBio当前市值已经达到100亿美元;另一类是敲除ATTR表达的siRNA药物,市场开发较晚,2024年Alnylam的patisiran和vutrisiran合计营收也已超10亿美元。当前Alnylam接近600亿美元市值背后的第一大支撑就是ATTR资产,从LNP递送的patisiran、到GalNAc配体偶联递送的vutrisiran,再到性能进一步大幅提升的ALN-TTRsc04,ATTR项目不仅代表了Alnylam公司内部的技术最前沿,也代表了全球肝内siRNA技术的最前沿。而I公司也把首要战场选在了ATTR,该公司的Nex-Z通过基因编辑敲低TTR表达来治疗ATTR-PN和ATTR-CM,2020年进入人体临床,2023年启动3期临床。作为全球首个全身给药的体内编辑项目,Nex-Z同样承载着基因编辑领域里“全村人的期盼”。从某种程度上说,siRNA和基因编辑在ATTR的攻守形势的变化,直觉决定着人们对未来该场景下“到底基因编辑 VS siRNA谁能更好地笑到最后”的趋势性判断。
首先,看一下nex-z与当前已获批的vutrisiran的疗效比较。从下面左图可以看到,基因编辑疗法Nex-Z对TTR的敲低水平显著高于siRNA疗法vutrisiran,前者的TTR降幅可以达到90%以上,而后者只有80%出头;从下面中图可以看到,TTR的敲低幅度越大,临床获益越大,在TTR降幅超过85%之后,mNIS+7指标便不再显著恶化,当TTR降幅超过90%之后,mNIS+7甚至可以整体改善趋势;从下面右图可以看到,Nex-Z在临床上带来的心血管获益似乎明显优于Vutrisiran。因此,仅就Nex-Z与vutrisiran的对比看,基因编辑的疗效明显优于siRNA。
当然,基因编辑存在不可预知的indels问题和靶标基因外脱靶编辑的潜在风险,但毕竟靶标基因内的indels只影响ATTR单一基因,而靶标外的脱靶编辑风险整体可控,加上LNP递送后高度富集于肝脏单一器官,不会影响高度敏感的生殖等系统,因此,这些潜在风险在临床上是可接受的。而且,基因编辑的“单次治疗、终生获益”的特性本身还能带来额外的的加分项。因此,综合上看,Nex-Z相比vutrisiran是有竞争优势的。
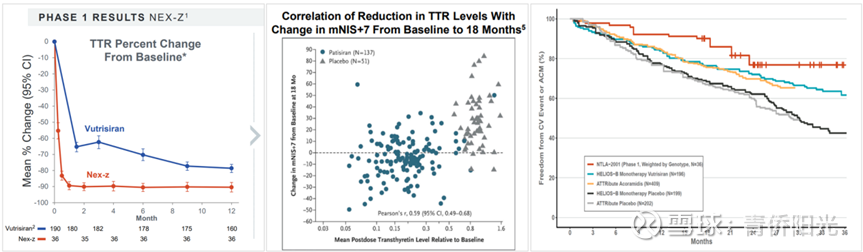
但Nex-Z疗效优于Vutrisiran,并不能就此认定基因编辑就优于siRNA,因为siRNA技术本身还在不断迭代。比如下图展示的是Alnylam最新一代的ALN-TTRsc04治疗ATTR的有效性和安全性,该药物所使用的平台技术相比vutrisiran又有了非常大的提升:vutrisiran是25mg剂量、3个月给药一次,而ALN-TTRsc04是爬坡到900mg也十分安全、预计能支持1年给药一次——是的,你没看错,不是从25mg提升到90mg,而是从25mg提高到900mg仍然无TRAE和SAE!受益于性能的大幅提升,TTR降幅也从Vutrisiran的80%多直接爆拉到ALN-TTRsc04的95%以上!这样的疗效数据,显然又比Nex-Z强上一截,因为Nex-Z受制于LNP载体的不良反应,剂量只敢给到0.75mpk-1.0mpk,在此剂量下,TTR降幅也就止步92%左右了。因此,考虑到LNP递送的安全隐患带来的剂量约束,大幅升级优化后的siRNA药物(ALN-TTRsc04)综合竞争优势上再度反超了基因编辑(Nex-Z)。
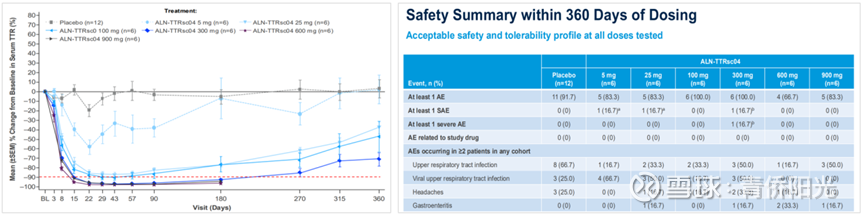
但即使这样,我们依然不能就此认定基因编辑的疗效就比不上优化升级后的siRNA,因为不只是siRNA可以优化迭代升级,基因编辑疗法也同样可以优化迭代升级。首先,基因编辑器本身也还处在不断迭代的早期,未来完全有可能会不断迭代出更强大更安全的碱基编辑器;其次,LNP载体也还有很大的提升空间,比如将普通LNP升级成GalNAc-LNP,通过引入对肝脏的双重靶向来提高潜在的有效性和安全性;再次,基因编辑也可以做成多次给药,LNP带来的副作用是短暂的,对于基因编辑后疗效不理想的患者,完全可以二次给药、三次给药,从而不断累积和提高药效。此外,传统CRISPR/Cas的indels问题和脱靶风险,可以通过升级成低indels且逻辑上说不会脱靶的先导编辑PE来解决。因此,考虑到基因编辑技术广阔的技术迭代优化空间,或许目前siRNA占优,但从足够长视角看,时间反而可能站在基因编辑的一边。
第二个例子是AATD项目(α-1 抗胰蛋白酶缺乏症)。α-1 抗胰蛋白酶(AAT)是由肝脏分泌后进入血清的糖蛋白,其核心功能是抑制体内过度活跃的蛋白酶,从而保护肺等器官免遭蛋白酶的侵害。但AATD患者的AAT存在突变(最典型最严重的是piZZ突变),一方面错误折叠的Z-AAT会在肝内堆积造成肝脏损伤,另一方面是肺部因缺乏足够AAT的保护,而极易在外界刺激引发的过度免疫反应中造成持续损伤。当前已有蛋白质替代疗法来缓解肺损伤,但Z-AAT在肝脏蓄积带来的肝病尚无获批疗法,因此A公司开发了直接敲低AAT基因表达的fazirsiran,该药物由授权合作方武田在推3期临床。但fazirsiran并非是AATD的理想方案,因为敲低AAT基因的表达会进一步降低血清中保护肺部的AAT蛋白含量,让肺对定期注射AAT蛋白替代疗法更加依赖;而且fazirsiran对于肝损伤的改善数据本身也还算不上多惊艳。相比之下,基因编辑可以在根源上将突变的基因变回正常基因,让肝脏由分泌错误折叠的Z-AAT变化分泌正确折叠的M-AAT,既解决了肝脏AAT蓄积带来的肝病,也解决了肺部AAT缺乏造成的肺病,一劳永逸,一举两得。其中,单碱基编辑疗法B-302已经在人体临床中展现了优秀的初步数据,而先导编辑则在全人源小鼠模型中展现了有望更优异的疗效前景(具体数据见上文)。因此,仅就已知信息看,在AATD这个适应症上,基因编辑相比siRNA具备全面竞争优势,只是临床进度上会晚几年上市。
第三个例子是通过靶向敲低PCSK9基因来控制他汀控制不佳的剩余高血脂风险。PSCK9 siRNA疗法已经获批上市(英克司兰),LDL-C的降幅在50%左右、与PCSK9单抗相仿,凭借半年一针的便利性优势获得了很好的市场认可,2025年销售额预计将超过10亿美元。至于基因编辑,原来我们因担心传统CRISPR/Cas遗传结果的不可控与LNP自身存在的安全性隐患,并不看好用基因编辑治疗高血脂等慢性大病。不过,V公司的V-102用碱基编辑BE替代CRISPR/Cas(降低indels和脱靶风险)、用GalNAc-LNP替代载体(提高潜在安全性)的VERVE-102,让我们看到了基因编辑拓展慢性大病的可行性。而同样使用GalNAc-LNP载体,但将编辑对象换成LDLR基因3’UTR的EDTI-401,则凭借其对LDL-C惊人的90%降幅,让我们对基因编辑治疗高血脂等慢性大病有了更大的期待。
综上所述,我们倾向于认为,在肝脏这一场景里,siRNA疗法技术更成熟、临床进度更领先,但时间可能站在基因编辑的一边,基因编辑靠着后来居上并对siRNA产生预期挤压的可能性不容小觑。
不过,在体内递送的肝外场景上,siRNA的比较优势仍然十分巨大,基因编辑很难望其项背。基因编辑在体内编辑时,需要递送长度至少在3000碱基以上的mRNA来编码Cas9蛋白(和脱氨酶或逆转录酶结构域),这么大的RNA在体内是不可能直接裸露递送并自动进入靶标细胞的,因此,必须依赖LNP或AAV等载体的递送。而LNP载体的递送效率很高,安全性和耐受性也不错,但对肝脏的靶向性太强,很难进行肝外器官递送;AAV可以靶向肝外器官,但递送效率比较低,且潜在副作用也太大,开发风险非常高。因此,受限于递送技术水平,递送到肝外器官进行体内编辑基因,目前为止还看不到成药前景。
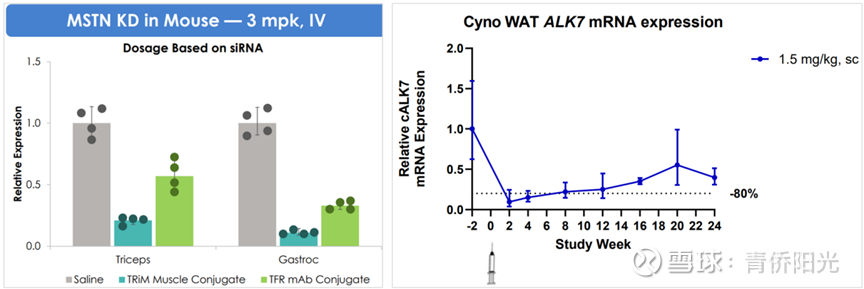
相比之下,siRNA药物只需要递送两条20多nt的核苷酸链就能完成核心功能;这么小的分子量,在充分化学修饰后就可以在体内以裸露的形式稳定存在。而且,分子量足够小也意味着只需偶联小分子配体就能实现靶向递送。在GalNAc走通siRNA偶联配体递送的路之后,原则上说,我们可以借鉴类似的思路,给各种器官靶向找到各自匹配的配体,然后将这个配体偶联在siRNA上就能实现不同器官的特异性靶向。在过去几年里,siRNA的肝外递送已经积累了非常多的突破。以A公司的肝外递送为例,下面左图是肌肉组织递送,3mpk剂量下配体偶联siRNA能将MSTN敲低超75%,降幅显著优于抗体偶联siRNA(AOC)约50%的水平;下面右图是脂肪组织递送,1.5mpk单次给药后2周,配体偶联siRNA能将ALK7敲低幅度超80%,在小鼠模型中能与替尔泊肽显著协调减重。除此之外,Al公司、A公司、D公司等在神经、肺等肝外组织的靶向递送中也都完成了技术验证。这几年,siRNA药企已经在技术上验证了广泛的肝外递送的可行性,未来几年能否在临床上也完成siRNA肝外递送治疗的疗效验证是很值得期待的。
综上,基因编辑和siRNA药物都有很好的发展前景,但两者值得期待的潜力方向有着明显的差异。基因编辑,除了体外编辑造血干细胞治疗SCD等血液病、或者体外编辑CART制备通用CART之外,靶向肝脏基因的体内编辑应用也在迅速成熟,随着载体的升级(如GalNAc-LNP)、场景的拓展(如3’UTR调控)、多次给药的探索等,未来能否后来居上并逐渐成为越来越多肝脏场景疾病的治疗优选是很值得期待的。而siRNA,除了继续深耕肝脏场景之外,未来在神经、肌肉、脂肪、肺等肝外器官的递送拓展上也很值得期待,在这些场景里,siRNA有望凭借其它入胞生物技术难以复制的无载体递送优势,不断探索开拓着入胞生物技术的治疗新边疆。
五、国产编辑:道路是曲折的,前途是光明的
和多数有前景的新兴赛道一样,基因编辑的广阔发展前景也吸引了众多国内生物科技公司的加入。不过,与国产创新药企在双抗、ADC、双抗ADC等工程化抗体领域的攻城拔寨不同,国产创新药企在基因编辑领域的崛起之路可能会更加的困难与漫长。
几年前,资本市场高度活跃,涌现出了很多完成大额融资的基因编辑公司。不过随着时间的流逝,很多曾经耳熟能详的基因编辑公司在近年也逐渐归于沉寂。其中相当比例受累于早期聚焦时的方向选择不当:比如国内某两家元老级的基因编辑公司,在RNA单碱基编辑上布局很深,但近年发展明显受阻,事后看,RNA编辑为了降低脱靶风险而牺牲编辑效率与放弃一次性永久治愈的最大优势,似乎并非明智之举;再比如国内某家由大学教授技术孵化的碱基编辑新秀,选择基于AAV进行肌肉递送,用基因编辑促进外显子跳跃来治疗杜氏肌营养不良症,自2024年8月启动IIT后很长时间内只入组了2名患者,其中可检测患者的肌肉中只观测到1.6%的DNA编辑效率和2.17%的外显子50跳跃,而且实验中有患者还出现了SAE,这样的安全性和有效性再次提示了用AAV载体进行肝外递送的巨大风险。当然,从技术和产业的角度看,这些敢走不寻常路的企业也是值得尊敬的,它们的探索为行业积累了宝贵的实践经验。
虽然行业的发展远不如工程化抗体等领域那般顺利,但还是有一些公司做出了让人印象深刻的工作。其中一家是专注在体外编辑造血干细胞和T细胞的邦耀生物,该公司的技术创始人不仅在基因编辑的早期就做了大量相关研究,也推动过很多基因编辑器的迭代优化工作,相信对基因编辑有很深的理解;2024年该公司发表在CELL发表的“通用CART治疗自免疾病”的研究曾引起不小的关注热潮,在其他人刚意识到可以用CART治疗自免疾病时,邦耀已经用数据证明了这一赛道的可行性前景。另一家是2021年才成立的后起之秀,尧唐生物,虽然也是基于LNP的肝脏基因编辑,但与某些同行只顾着“copy-to-china”不同,该公司一是比较早地就转向了GalNAc-LNP载体,二是开发了编辑HAO1基因治疗原发性高草酸尿症PH1,三是探索了基因编辑的二次给药。这三项工作都让人眼前一亮:比如编辑HAO1治疗PH1的工作,明显是借鉴了Alnylam的工作,其实,个人觉得Alnylam肝内siRNA项目的那几个靶点都值得用基因编辑再做一遍,包括靶向AGT治疗顽固性高血压和靶向HBV整合序列治疗慢性乙肝的项目;再比如基因编辑的二次给药,基因编辑药物不像自体CART那样因为高度个性化而无法降低成本,LNP载体也不像AAV那样有强大免疫原性而无法二次给药,标准化的基因编辑药物在达到一定规模后可以做到低成本,而LNP递送后只要隔开时间完全能支持二次三次给药,那为什么不能通过可控剂量的多次给药来降低副作用+增强疗效呢?
但即使有这些让人眼前一亮的工作,我们对整个国产基因编辑领域的前景仍然会比国产工程化抗体、工程化细胞等领域要谨慎很多。这种谨慎源自供给和需求两方面。从供给端来说,全球基因编辑仍处在底层技术快速突破的早期阶段,在这一阶段,技术的发源国往往能更容易凭借技术的快速迭代来维持相比追赶国的技术优势,比如从上文看到,全球基因编辑的技术前沿是先导编辑PE,国内布局的就非常少,而且仅有的一两家有临床前数据披露的,其编辑效率仍然远远落后于P公司。这与工程化抗体形成鲜明对比,抗体技术所依赖的最底层的杂交瘤技术自发明以来已经走过了半个世纪,抗体很多关键的工程化改造技术也早已充分扩散,这时候,技术的发源国是很难靠技术迭代去继续维持先发优势,反而是后发国有机会利用后发优势和成本优势等去实现追赶甚至反超。除此之外,国内也还缺乏E公司E-401那样的更大胆、更具开辟性的创新探索,在场景创新上暂时也还没看到引领性的工作。
从需求端来说,当前基因编辑的应用主要集中于遗传罕见病,这些疾病的患者人数有限,要想获得可观的投资回报就需要维持很高的产品定价,但国内的支付环境对高价药仍然很不友好。当前国内新药放量仍然高度依赖国家医保的报销,而国家医保又有保基本的底线约束,不太愿意接纳单次费用或年费用超过30万元的新药(比如CART),而若降价到30万元以内,很多遗传罕见病疗法的投资回报率又会明显受挫。相比之下,商业健康险倒是能接受高价药,但国内商业健康险的基数还是太小,在可预见的几年内都很难对高价创新药构成强有力支持。
当然,这些都是中时间尺度上的阻碍和挑战,若放到长时间尺度上去看,国内基因编辑行业还是很值得期待的。首先,随着海外前沿技术迭代速度的逐渐放缓,以及国内科研院校和相关研发型公司的基础创新能力的逐渐增强,国内外技术层面的代差预计会逐渐缩小,从而为在中国诞生世界级基因编辑公司在技术上提供了可能性;其次,随着国人医疗支付能力的不断提高和商保市场的不断壮大,国内非医保高价药物所面临的支付环境预计会从十分艰难的状态中持续快速改善,推动非医保高价药市场在低基数下持续快速增长;而且,就已有信息看,基因编辑走向血脂血压血糖等慢性大病,已经开始初步展现成药潜力,未来国内的基因编辑市场有可能在慢性大病突破后迎来加速大发展。因此,国内基因编辑行业的远端前景同样很值得期待的,只是我们可能需要用更包容的耐心去等待行业的逐渐成熟与企业的持续发展。
注:文中提到的公司名称合规原因做了简化用大写字母表示,本文仅供逻辑讨论示意,不构成推荐或不推荐暗示。利益披露:青侨基金组合持有文中提及的部分标的,未来3天无交易计划。