Genmab再放弃一项TCE资产,双抗毒性难解


抗体药物领域龙头Genmab近日悄然更新了clinicaltrials.gov上一项试验记录:其早期T细胞衔接器(TCE)双抗项目GEN1078已被终止。
这个由Genmab与抗体专家OmniAb合作开发的TCE项目,仅在2025年1月启动I/II期临床,不到半年便宣告夭折。

作为双抗领域的领跑者,Genmab依托四大抗体技术平台曾孕育出多款成功药物。但就在其明星产品Epcoritamab在全球市场高歌猛进之时,这家丹麦生物技术公司却接连折戟于早期研发项目。
在去年终止针对B7-H4和CD30的TCE双抗后,如今又一个未公开靶点的TCE倒在研发路上,为行业敲响警钟。
01
一期临床悄悄终止

根据clinicaltrials.gov以及Eu clinical trials的注册资料显示,GEN1078源于Genmab与OmniAb的合作协议,是一款TCE双抗,但肿瘤靶点一直处于保密状态(文档中多次提及的肿瘤相关抗原,具体名称未明确,但强调其在多种实体瘤中高表达,正常组织中低表达)。
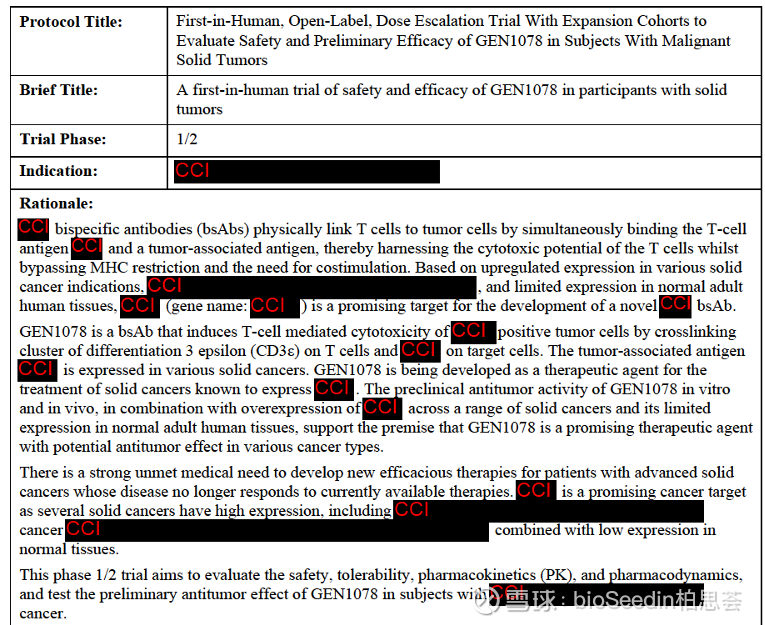
图源:Eu clinical trials
在这之前,Genmab利用OmniAb®转基因小鼠和大鼠平台一共合作了三个项目,目前除了GEN1078,另外两款都在正常推进中,其中PD-L1/4-1BB双抗Acasunlimab进度最快,处于2L治疗非小细胞肺癌的3期临床研究,Genmab预计Acasunlimab的销售峰值将达到10亿美元。

该项目的神秘面纱引人深思,因为在艾伯维的临床试验网站上,GEN1078也同样赫然在列。这源于2020年Genmab与艾伯维达成的7.5亿美元预付款、总价值近40亿美元的肿瘤合作,但除了Epcoritamab 以及已终止的靶向CD37 的GEN3009 和靶向5T4 的TCE项目GEN1044之外,协议所涵盖的其他项目均不为人知。
值得注意的是,GEN1078的排除标准允许曾接受过抗TIGIT、PD-(L)1、LAG3和CTLA-4药物治疗的患者入组。这一线索暗示该项目的作用靶点可能不同于这些热门免疫检查点。

而对于本项试验的终止说明,官方给出的原因是毒性问题。要知道在双抗领域,毒性问题始终是研发过程中的重要障碍。GEN1078的快速终止凸显了早期药物开发中难以预测的风险,即便对于拥有DuoBody等先进技术平台的Genmab也不例外。
02
明星产品耀眼,但研发管线暗礁重重

在早期项目频频受挫的阴影下,Genmab与艾伯维合作的Epcoritamab正成为全球血液肿瘤治疗领域的一颗明星。
这款基于Genmab专有DuoBody技术构建的CD3/CD20双抗,已被行业媒体Evaluate列为“2023年十大潜在重磅疗法”之一。其销售表现也印证了这一预测:其2024年销售额已经达到了1.46亿美元,而2025年Q1财报显示,Epcoritamab销售为5100万美元,其中美国市场为2100万美元,国际市场为3000万美元,同比增长89.8%。未来预计年峰值销售额为12亿美元,有望进入重磅炸弹的门槛。
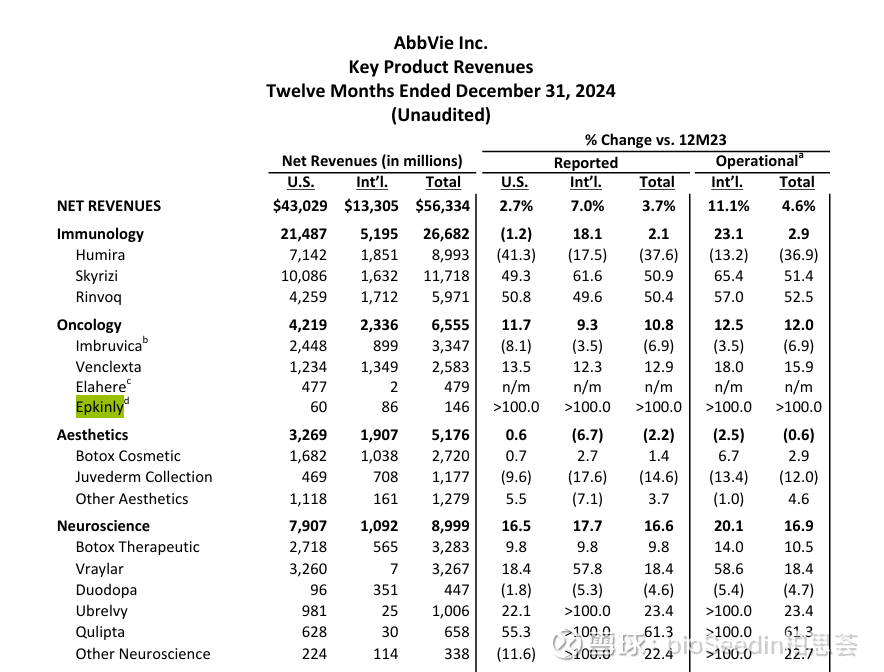
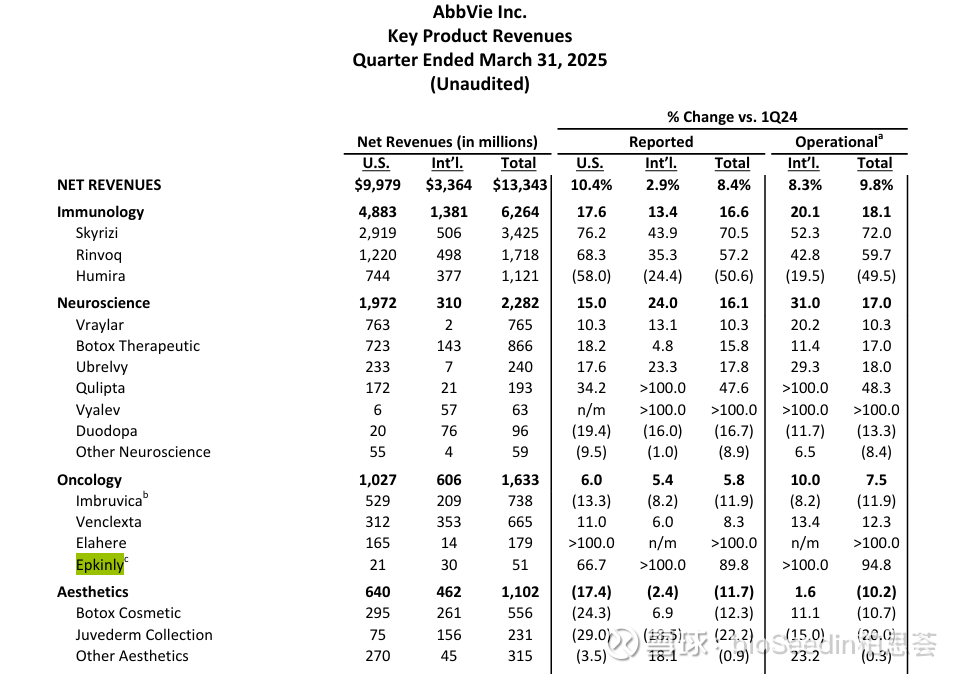
图源:艾伯维官网
然而,在Epcoritamab耀眼表现的背后,是Genmab管线的频频折戟。在2024年年底,Genmab召开第三季度电话会议,一连终止3项双抗早期临床项目GEN1047、GEN3017和GEN1056的开发,原因是根本没有达到内部设定的真正差异化治疗候选药物的高标准。
Genmab研发管线不断折戟背后,也反映了双抗领域的残酷现实——双抗研发成功率仍低于传统单抗。根据JAMA Oncology 2024年的数据现实,双抗的临床成功率仅为8%,而单抗中这一数字则为20%。
从以上数据能够看出,即便是技术平台强大的公司,也难以避免早期探索中的科学不确定性。
而也正因生物制药研发本质上是高风险的试错过程,因此在面对双抗的研发挑战过程中,Genmab能够快速终止前景不佳的项目,将资源集中于最有希望的项目。
其中除了上文中提到的与艾伯维合作开发CD20/CD3双抗Epcoritamab、PD-L1/4-1BB双抗外,通过收购中国企业普方生物而获得的FRα ADC Rina-S,以上三款产品将在未来共同支撑起Genmab的营收。
从数据面来看,Rina-S 120mg/m²,Q3W治疗组的疗效十分亮眼:在18名接受治疗的晚期卵巢癌患者中,4例CR(2名确认;2名未确认),8例PR,ORR为66.7%,确认的ORR为55.6%,DCR为88.9%,mDOR尚未达到(中位随访时间48周)。相较于2024 ESMO上公布的数据(ORR为50%),Rina-S高剂量组的疗效有了进一步提升。
另外值得注意的是,该赛道的FIC药物Elahere则受限于FRα高表达(FRα TPS>75%),而Rina-S并未限定入组患者的FRα表达水平(此前接受过Elahere治疗的患者除外),这也就意味着Rina-S有望面向更多患者,并具有成为FRα靶向疗法BIC的潜力。