全球首创药物爆发前夜,复星神级BD精准卡位


8月11日,上海复星医药宣布将在研DPP-1抑制剂XH-S004在中国大陆、香港及澳门地区以外的全球开发和商业化权益转让给新兴炎症性疾病生物技术公司Expedition,作为回报,Expedition为复星支付至多1.2亿美元不可退还的首付款、开发里程碑付款,以及最高5.25亿美元的销售里程碑付款,外加销售提成。

图源:复星医药官网
一方面,市场为在创新药牛市中低调已久的复星医药迎来今年BD出海第一单而感到兴奋,今日开盘上涨3%。
但更值得注意的是,此前2025年2月,FDA正式受理Insmed的Brensocatib治疗非囊性纤维化支气管扩张症(NCFBE)的新药申请(NDA),并授予优先审评资格,最终决定日期锁定2025年8月12日,也就是今天!
要知道Brensocatib一旦获批上市,将直接创造三大首创:
1、首个获批的NCFBE靶向药物;2、首个上市的DPP1抑制剂;3、首个针对中性粒细胞介导疾病的机制疗法
而复星这款药物的BD时间也正好赶在Brensocatib获批的前一天,这一波可以说是卡点造势了。
另外,随着Brensocatib的获批以及XH-S004的大额BD出海,只有AZ受伤的世界达成了。毕竟Brensocatib这款药当时还是AZ“贱卖”给Insmed的,现在不管AZ再重新从Insmed手上买回来还是从国内药企手中BD,价格基本不会再低于复星本次交易的金额了。
01
DPP1引爆市场

在呼吸系统疾病治疗领域,DPP-1抑制剂代表了一种革命性的治疗机制突破。这种小分子口服药物通过靶向中性粒细胞炎症的核心路径,为解决多种慢性呼吸疾病提供了全新方案。
从机制来看,DPP-1是激活中性粒细胞丝氨酸蛋白酶(NSPs)的关键酶,负责激活包括中性粒细胞弹性蛋白酶在内的多种蛋白酶,然而在慢性炎症性肺病中,中性粒细胞在气道异常积聚,导致过度活跃的蛋白酶释放,引发肺组织损伤、炎症恶性循环及气道结构破坏,因此抑制DPP1有望成为治疗中性粒细胞相关炎症疾病的新途径。
而本次复星医药对外BD的XH-S004和Insmed即将获批的Brensocatib,均作为口服DPP-1抑制剂,能穿透细胞膜进入溶酶体,直接抑制DPP-1活性,阻断中性粒细胞丝氨酸蛋白酶的激活过程。这种机制从源头控制炎症反应,减轻肺部损伤,同时避免了传统抗炎药物的全身性副作用。
另外从适应症上来看,DPP-1抑制剂的潜在市场价值巨大,主要cover了非囊性纤维化支气管扩张症(NCFBE)和慢性阻塞性肺疾病(COPD)两大适应症领域。
而复星医药在以上两项适应症上均有所布局:2025年5月31日,XH-S004用于治疗NCFBE于中国境内启动Ⅱ期临床试验。2025年7月17日,XH-S004用于治疗COPD适应症在中国境内启动Ib期临床试验(均不包括港澳台地区)。
其中NCFBE作为一种严重慢性肺病,其特征是支气管永久性扩张、反复感染和炎症,在美国约影响34万至52万患者。目前美国、欧洲和日本均无获批的专门疗法,患者只能依赖抗生素和症状管理。
COPD的市场更为广阔,作为全球第三大死因,COPD患者群体庞大且增长迅速,根据Precedence Research报告,全球COPD治疗市场规模在2024年为200亿美元,预计到2034年将达到330亿美元,CAGR为5.14%。
近日,默沙东以百亿美元并购Verona,看重的便是后者手中COPD领域的首创新药,也是对COPD领域看好的最佳证明。
行业媒体Evaluate曾将Brensocatib其列为"2025年十大潜在重磅疗法"之一,预测2030年销售额可达28亿美元。更激进的市场预判认为,单NCFBE适应症销售峰值将突破50亿美元。
02

随着DPP-1抑制剂价值飙升,行业目光聚焦到这一靶点的原始所有者——AZ身上。回顾历史,AZ的选择令人扼腕。
2016年10月,AZ决定将还处于早期阶段Brensocatib的全球独家权益转让给Insmed公司。交易条款显示,阿斯利康仅获得3000万美元首付款和最高1.2亿美元的里程碑付款,以及未来销售分成。
不过实际上AZ还给自己留了一手。
2020年3月,阿斯利康行使Brensocatib在COPD或哮喘领域的独家开发权,负责完成IIb期临床试验,并保留在IIb期后继续推进的选择权;Insmed继续保留该药在所有其他适应症和地区的开发及商业化权利。
而随着未来Brensocatib的商业化兑现,DPP-1抑制剂的价值更是呈几何级增长
反观国内,DPP-1抑制剂研发也呈现三强争霸格局。除复星医药外,海思科和恒瑞医药也有布局这一靶点。
其中海思科的HSK-31858进度最快,目前针对NCFBE的适应症已经进展到临床3期。
今年3月,国际顶刊《柳叶刀·呼吸医学》在线发表了HSK31858的II期临床研究成果。该研究由钟南山院士与关伟杰教授联合牵头。主要结果显示,与安慰剂组相比,20 mg HSK31858组(下降幅度为48%)和40 mg HSK31858组均显著降低急性加重发生频率(下降幅度达60%)。未发生急性加重的人数,HSK31858 20mg组和40mg组均显著多于安慰剂组。与安慰剂组相比,HSK31858 20 mg组和HSK31858 40 mg组至首次急性加重的平均持续时间均显著延长。
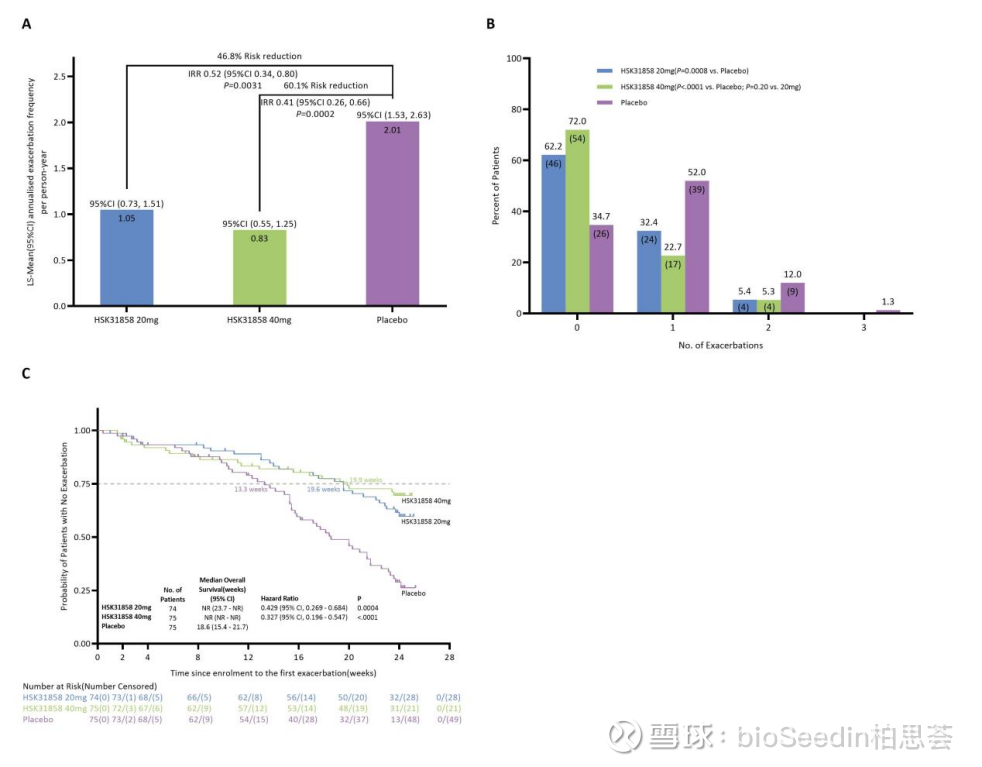
安全性方面,与安慰剂组对比,HSK31858 20 mg组(86.5% vs. 85.3%,P>0.05)和HSK31858 40 mg组(88.0% vs. 85.3%,P>0.05)治疗中出现的不良事件发生率相当。
CDE官网显示,HSK31858片已于2024年被纳入突破性治疗品种,用于治疗NCFBE,成为我国气道慢病领域首个获批成为突破性治疗的药物。
另外,恒瑞子公司瑞石生物的RSS-0343目前在哮喘以及NCFBE适应症上也均进入临床2期。不过2023年瑞石生物解散风波闹得沸沸扬扬,而RSS-0343也从2023年4月宣布获批临床后,到现在都没披露相关的临床消息。
不过此时此刻最令人翘首以盼的,还是FDA对Brensocatib的审评结果即将揭晓。