庖丁解牛,详细拆解诺思兰德的创新药NL003到底有多低估?
核心观点:舒泰神,广生堂,昂利康…创新药众星璀璨,但是低估的品种,依然不少。作为创新能力被质疑的北交所医药公司,可以掘金。
本文承袭老师《创新药估值洼地:北交所低估的创新药有哪些?》,对诺思兰德进行深层次解读。
阅读本文,你讲解惑以下内容:
1.下肢外周动脉疾病(PAD)对健康的危害及发展趋势?
2.4-6级属于严重下肢缺血性疾病(CLI)治疗方法及局限性?
3.诺思兰德的创新药NL003针对CLI的创新性疗法?
4.NL003研发上市进展及全球专利情况?
5.NL003的市场空间测算?
*** 温馨提示,如果您对前面部分不感兴趣,可以直接跳跃到第四章节(NL003研发上市进展及全球获批情况)和第五章(NL003的市场空间测算)节进行阅读。
一、下肢外周动脉疾病(PAD)对健康的危害及发展趋势
下肢外周动脉疾病(PAD)是一种极其严重的全球流行病。2022年全球疾病负担研究报告称,全球有2.02亿成年人患有PAD,其患病率高于缺血性心脏病(1.54亿)、心力衰竭(6400万)、阿尔茨海默病/痴呆症(4400万)、癌症(4300万)、艾滋病毒/艾滋病(3600万)和阿片类药物成瘾(2700万)。
外周动脉疾病(PAD)是什么原因造成的?通常因动脉硬化闭塞症(ASO)、糖尿病性动脉硬化闭塞症(DAO)和血栓闭塞性脉管炎(TAO)等引发下肢动脉狭窄或闭塞、血流灌注不足,进而导致下肢间歇性跛行、疼痛、溃疡或坏疽等缺血表现。
根据缺血程度的不同,临床上采用Rutherford分级,将下肢缺血性疾病从轻到重分为0-6级,其中4-6级属于严重下肢缺血性疾病(CLI),临床症状主要以腿部和脚部静息痛、溃疡及坏疽为主,随疾病的进展,感染、溃疡和坏疽逐渐恶化,严重者将面临截肢甚至死亡。
下肢缺血(CLI)听起来不像是一个什么很严重的病,但实际上这个病的严重程度跟癌症差不多了,不治疗的情况下,12个月死亡率22%,截肢率也达到了22%,5年死亡率超过50%,比所有癌症5年总死亡率还高(31%),所以这个病的治疗药物或者方法,实际上是非常刚需的,不亚于肿瘤药。
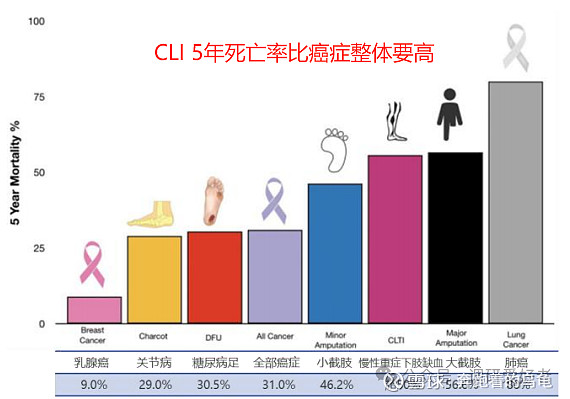
从致病原因可以看到,动脉硬化,糖尿病,血管栓塞这些普通的疾病都有可能导致严重下肢缺血性疾病(CLI)的发生,7月发表于《Research》杂志的一项开创性研究论文显示,预计到2050年,全球PAD患者人数将从2021年的1.13亿激增至超过3.6亿,对应的CLI患者接近4000万。
二、4-6级属于严重下肢缺血性疾病(CLI)治疗方法及局限性
很多不明就里人认为,下肢外周动脉疾病就是个小毛病,做个小手术即可,但是事实是,CLI的资料难度绝对超出你的想象。
现有治疗方案中,约85%采用血管腔内成形术(球囊扩张和支架植入)改善下肢血运,另外约10%采用开放手术治疗,如动脉内膜切除术或动脉旁路术,类似于呼吸病人的呼吸机,是用人造血管或自体静脉建立新的血流通路。
然而,这两种治疗方法的弊端都很大。
腔内介入手术最大的问题是患者的复发程度很高,腔内介入手术后,6个月复发的概率在20%-40%,一年内复发的概率为40%-60%。如下图
图:CLI手术疗法复发时间及概率

因此,手术在治疗严重下肢缺血局限性明显。简单的腔内治疗手段难以对闭塞血管进行开通,达不到恢复下肢血供的目的。而在于复杂病变的治疗中,手术更是束手无策,无论是跨髋关节还是跨膝关节的病变,在支架植入后均容易出现再狭窄或支架断裂的情况。
三、诺思兰德的创新药NL003针对CLI的创新性疗法?
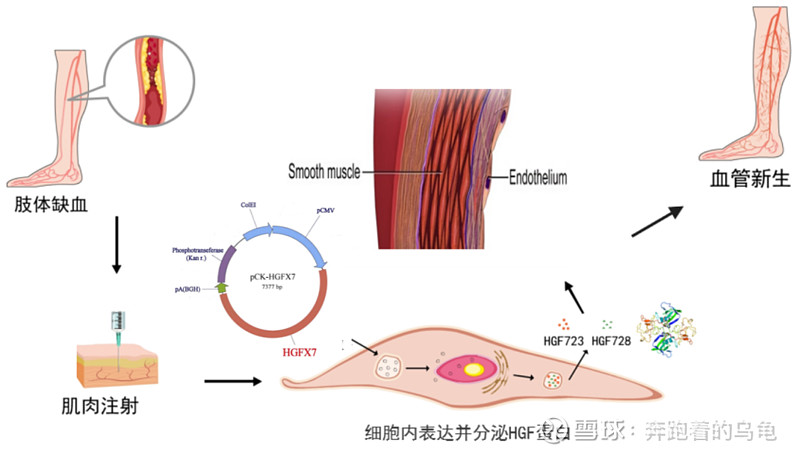
诺思兰德针对严重下肢缺血的创新药塞多明基注射液(代号NL003)。是一种创新型基因治疗药物,采用HGF基因+裸质粒技术,通过促进血管新生实现有效治疗。其作用机制如下:在缺血部位的局部肌肉注射塞多明基后,质粒转染横纹肌细胞,在细胞内持续表达和分泌两种肝细胞生长因子HGF723及HGF728蛋白,促进新生血管形成;通过“分子搭桥”机理,在缺血部位形成侧支循环,增加缺血部位的血流供应,从而达到疾病治疗目的。
图:NL003治疗原理
由北京协和医院牵头组织的塞多明基注射液Ⅲ期临床试验主要针对CLTI人群,分为溃疡(Rutherford 5级)和静息痛(Rutherford 4级)两个适应症分别开展。溃疡试验已于2024年2月揭盲,静息痛适应症于2024年8月揭盲,结果均达到预期,目前在全球范围内独此一家。
在溃疡适应症中,与安慰剂相比,主要终点指标180天溃疡完全愈合率为43.5% vs 18.5%,具有显著临床意义(P<0.0001)。在静息痛适应症中,与安慰剂相比,主要终点指标180天疼痛完全消失率为44.1% vs 18%,塞多明基组显著优于安慰剂对照组(p<0.0001)。
塞多明基注射液在病人依从度、疗效以及安全性等方面具有明显优势。其溃疡适应症已正式向国家药品监督管理局提交新药上市申请(NDA),一旦获批将是全球范围内首个治疗CLTI溃疡适应症的基因药物,特别是为合并糖尿病的患者,心功能不全或身体状态不佳、不愿意接受手术治疗的患者以及手术开通效果差、复发的患者带来新的治疗选择和新希望。
四、NL003研发上市进展及全球专利情况
全球仅日本AnGes的Collategene(溃疡适应症)获批,但商业化有限;国内NL003有望成为国内首个获批的CLI基因治疗药物。
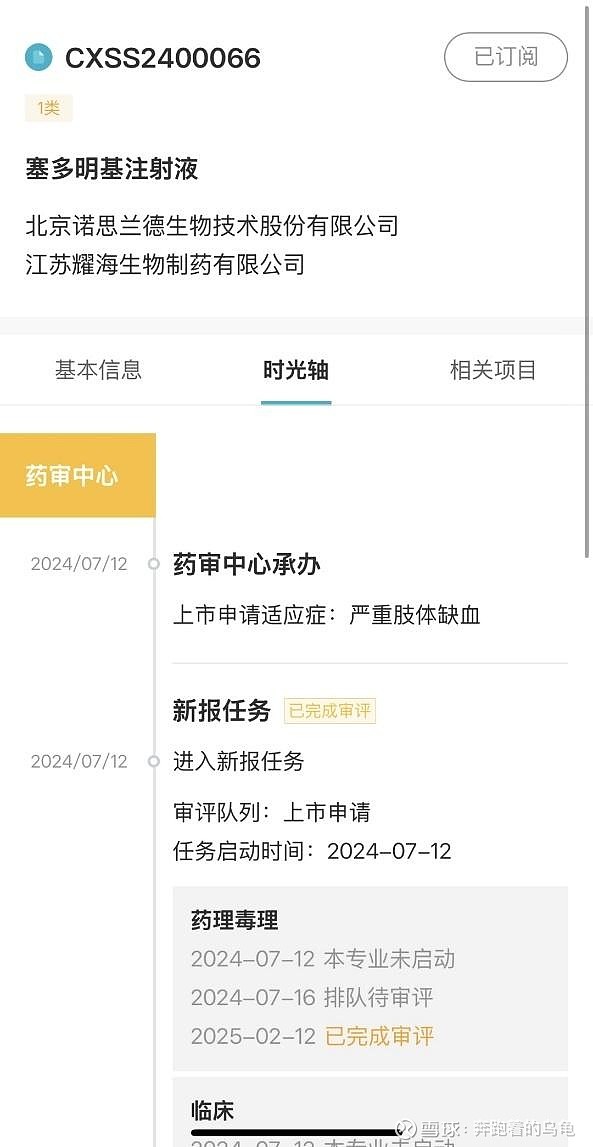
目前NL003已经完成全部临床试验,审评工作结束,进入上市申请阶段,今明年获批的概率极大。
图:NL003审批情况
我们来推测NL003的市场空间
国内方面:以纳入医保测算:
从市场价值角度看,重组质粒-肝细胞生长因子注射液面临着千亿级的潜在市场空间。参考日本AnGes公司的Collategene的定价策略(年治疗费用约7.94万元,按一个疗程治疗2次计算),结合中国CLI患者规模,可进行初步市场测算:
2025年中国CLI患者约566万人,假设患者就诊率为70%,未经血运重建的患者占比约60%,按此计算,理论目标患者人群约为566万×70%×60%=237.72万人。按Collategene定价估算(单疗程约8万元)估算,潜在市场空间可达237.72万×8万元≈1901.76亿元;估计中国的定价会低一些;按照一半计算也是妥妥1000亿市场。以上计算仅限于该药的理论市场空间。
我们按照极其保守的方法估计,假设NL003的最终渗透率在15%,降价降到1万(每个月800块钱),那么治疗人数是237万*15%=35.5万人,稳态市场需求在35亿左右/年。考
海外市场:美国已经认可并且延长专利到2041年,日本也认可专利,目前就差欧盟。考虑到海外售价提高,预计海外市场空间是国内的2-3倍。
目前NL003生产线和推广情况
1.生产准备:公司已完成生物药产业化基地主体建设,并通过GMP认证,规划产能120万支/年,为商业化提供保障。
2.市场策略:与艾昆纬合作完成商业化策略研究,重点布局血管外科科室,通过精准推广覆盖目标患者群体。计划通过医保谈判、医院准入及学术推广提升渗透率,同时探索轻症适应症扩展潜力。
五、诺思兰德:被严重低估的创新药
按照我们第四部分的空间测算,仅仅按照纳入医保测算,国内NL003的市场空间稳态在35亿左右,利润在5-7亿,如果考虑海外市场的拓展,预计年化峰值的利润在10-12亿。诺思兰德NL003属于无研发风险,市场空间确定,诺思兰德被明显低估,国内创新药的估值还处在“癌线高估值、非癌被轻视”的阶段,公司的合理估值在180-250亿左右。