单日暴涨近6倍,miRNA药物时代或将来临
7月22日,法国生物技术企业Abivax宣布,其口服miRNA药物Obefazimod(ABX464)在治疗中重度溃疡性结肠炎(UC)的两项临床三期研究种,成功达到主要终点。
此消息促使Abivax股价单日飞涨586%,创下今年以来美国biotech单日最大涨幅,公司市值也由6.3亿飙升超40亿美元。
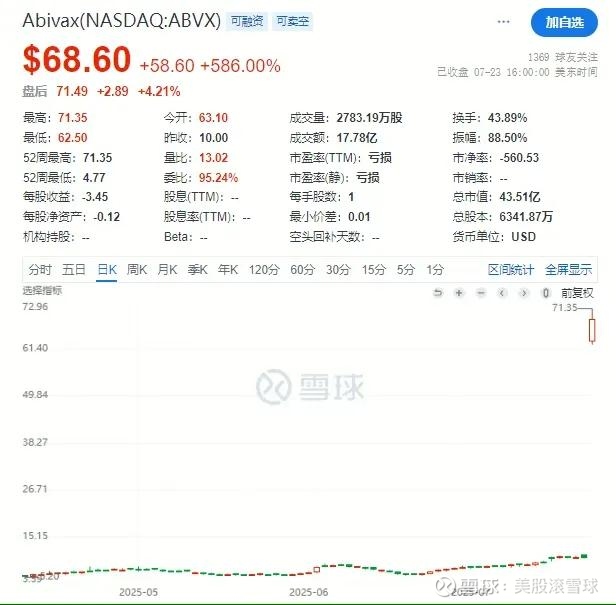
在此之前,Abivax账上仅剩1亿美元(每年支出约2亿美元),处于破产边缘,而在数据发布后,公司迅速在高位增发融资4亿美元,为药物的上市审批提供充足的现金支持。
投资机构孵化的单药药企
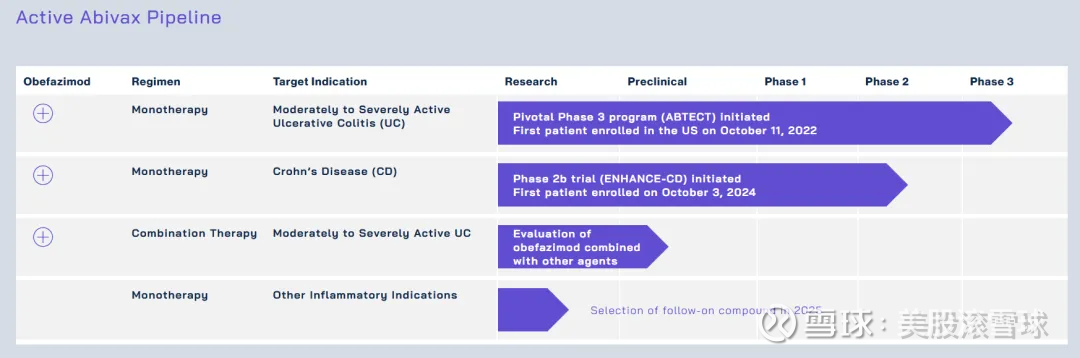
Abivax成立于2013年,是一家专注于开发利用人体自然调节机制治疗慢性炎症性疾的公司。Abivax于2023年10月在美国纳斯达克上市,仅凭一款药物obefazimod,就在IPO发行中募资2.36亿美元,成为法国Biotech在美国上市史上最大IPO。
公司技术源于2024年的诺贝尔生理学或医学奖得主Victor Ambros和Gary Ruvkun,两位学者“发现了miRNA及其在转录后基因调控中的作用”。
与siRNA等传统核酸药物相比,miRNA发挥功能不需要与靶标mRNA完全互补配对,故单个miRNA可调控数百个基因,这也使得miRNA治疗可实现多靶点调控,应用领域更广并且适合更复杂的疾病如肿瘤、纤维化等。
在广泛应用领域的优势下,miRNA也有脱靶效应及因此而来的毒性等缺点。miRNA Therapeutics公司旗下药物MRX34在临床一期试验中,曾发生了5例严重的治疗相关副作用,4例患者发生死亡,临床研究被迫终止。
obefazimod是一种靶向miR-124的口服小分子药物,而miR-124的作用靶点包括MCP-1/CCL2, STAT3, IL-6R等多个在炎症通路发挥重要功能的基因。其RNA剪接调节作用所产生的效应构成了强大的抗炎症作用和抗病毒作用,被开发用于治疗多种炎症性疾病(如溃疡性结肠炎、克罗恩病、类风湿性关节炎)和多种病毒性疾病(COVID-19、HIV)。
最初,obefazimod计划用来治疗HIV感染。2017年,研发人员在一项ABX464治疗HIV的二期临床中发现,小鼠DSS模型上呈现出了对肠道粘膜的保护作用(HIV发病的进展会引起胃肠道粘膜损伤,可以使得细菌从肠道移位并继发炎症),公司借此发现迅速调整研发方向,进入了炎症性肠炎(IBD)领域。
Obefazimod通过促进长非编码RNA剪接,可显著提升miR-124表达量,精准结合STAT3 mRNA,阻断Th17细胞分化通路,从而缓解肠道炎症。
公司创始人Philippe Pouletty博士是Truffle Capital(法国的生物技术风险投资公司)的联合创始人兼首席执行官(Truffle Capital是Abivax的最大股东),曾投资了SangStat、Novexel等多家药企。除了Abivax外,他还创立(或共同创立)了Carmat、Deinove、Pharnext等多家公司。
Abivax管理层经验丰富,首席执行官Marc de Garidel曾担任CinCor Pharma的CEO(被阿斯利康以18亿美元收购)、Corvidia Therapeutics(被诺和诺德以21亿美元收购),以及大药企Ipsen的CEO,有着长达40年的生物医药领域经验。
首席医疗官Sheldon Sloan博士曾任职于Arena Pharma(被辉瑞以67亿美元收购),强生IBD业务的全球医疗事务负责人,领导Stelara在克罗恩病和溃疡性结肠炎领域的上市与销售;首席财务官Didier Blondel曾担任赛诺菲巴斯德MSD的CFO。
股价为何暴涨
在数据发布后,Abivax取得引人注目的涨幅,其主要原因如下:
首先,Obefazimod适应症为炎症性肠炎(溃结性肠炎与克罗恩病 ),市场需求巨大,该领域诞生了多款百亿美元重磅单品,如阿达木单抗、乌司奴单抗等,市场对Obefazimod的期待较高。
目前获批药以口服小分子为主,但一线治疗仍由生物制剂(抗TNF/IL-23)主导,口服药多为JAK抑制剂(如托法替布)与S1P调节剂,但在实际治疗中,大约有三分之一的炎症性肠炎患者对目前的生物制剂疗法没有反应,且在初始治疗有效的患者中,仍有约二分之一的患者会发生“继发性反应丧失”现象,而药理与现有疗法不同的Obefazimod将会为这些患者提供新的选择。
Obefazimod已显露Best-In-Class潜力,不仅有望成为生物制剂无效者的高效口服方案,而且有望成为一线口服首选(前提是44周维持数据积极),且定价也有优势,市场想象空间巨大。
其次,优异的临床试验数据。Obefazimod本次发布的数据是ABTECT研究,ABTECT是目前最大规模的溃结性肠炎的三期临床试验之一,30个月内在36个国家600多个临床中心,共纳入1275名对常规和先进疗法应答欠佳、无效或不耐受的中重度活动性溃结性肠炎患者。研究以治疗第8周达到临床缓解的患者比例作为主要评价指标。
公布的结果显示,在第8周,25mg和50mg剂量组实现临床缓解的患者占比分别为23.8%和21.7%,显著优于安慰剂组的2.5%:
(1)在ABTECT-1研究中,25mg、50mg和安慰剂组的临床缓解率分别为23.8%、21.7%和2.5%;
(2)在ABTECT-2研究中,三组的临床缓解率则分别为11.3%、19.8%和6.3%。
数据表明Obefazimod疗效显著,尤其在50mg剂量组中,缓解率远超安慰剂。此外,药物展现了良好的安全性与耐受性,未见新的安全问题。
尤其值得注意的是:本次临床入组的受试者有47.3% 对既往疗法(生物制剂/JAK抑制剂等)应答不足,是迄今为止3期溃结性肠炎试验中最大规模的JAK抑制剂经治失败人群,该部分患者从现有的疗法已无法获益,Obefazimod让这些患者看到了重获新生的希望。
最后,Obefazimod具有First-In-Class优势。Obefazimod有望作为全球首款获批的miRNA药物,采用口服方式,不用冷链、输液等其他成本。就目前数据而言,Obefazimod没有像JAK抑制剂那样被FDA贴黑框,也没有像抗TNF那样需要住院观察,患者依从性较高。
miRNA药物或出现快速发展
miRNA作为小核酸药物的重要组成部分,与小干扰 RNA(siRNA)同属 RNA干扰领域。但与siRNA药物的飞速发展相比,miRNA药物研发目前尚处起步阶段,目前全球范围内无药物获批。
目前,仅有数款药物进入临床领域数款进入临床阶段,适应症多集中在心血管疾病、代谢性疾病、炎症等方面,如UniQure的临床Ⅰ/Ⅱ期管线 AMT-260(治疗颞叶癫痫)和 AMT-130(治疗亨廷顿舞蹈症),Regulus Therapeutics用于治疗丙肝的RG-101,Apic Bio开发的针对遗传性肌萎缩侧索硬化症(SOD1-ALS)的 APB-102(Ⅰ/Ⅱ期),以及心力衰竭治疗药物 CDR 132L(miR-132 抑制剂,Ⅱ期)等。
Obefazimod凭借临床三期试验成功,不仅大概率会成为第一款获批的miRNA药物,而且佐证了miRNA治疗自免疾病策略的可行性,有望开创miRNA治疗新时代,并引领小核酸药物的开发热潮。