重磅突破!Gotistobart 3期临床数据公布,重新定义CTLA-4靶点
▎徐卉
2025年12月2日,BioNTech/OncoC4在北美肺癌会议NACLC 2025上发布摘要,发布了下一代CTLA-4抗体Gotistobart(BNT316/ONC-392)的3期临床试验第1阶段的数据,该研究是一项针对免疫耐受的鳞状NSCLC患者的随机、对照、国际多中心试验。公司将于12月6日在大会上做口头汇报。

关于该项研究,前期已经出现多个信号,提示这是一项积极的阳性结果:
10月27日,中国NMPA授予gotistobart突破性治疗(BTD)认定;
11月11日,BioNTech在研发日强调Gotistobart是重要的优先研发管线,并预告12月6日即将发布第1阶段的临床数据;
目前临床3期第2阶段的试验正在招募中,BioNTech预计2026年有数据读出。
Gotistobart(BNT316/ONC-392)
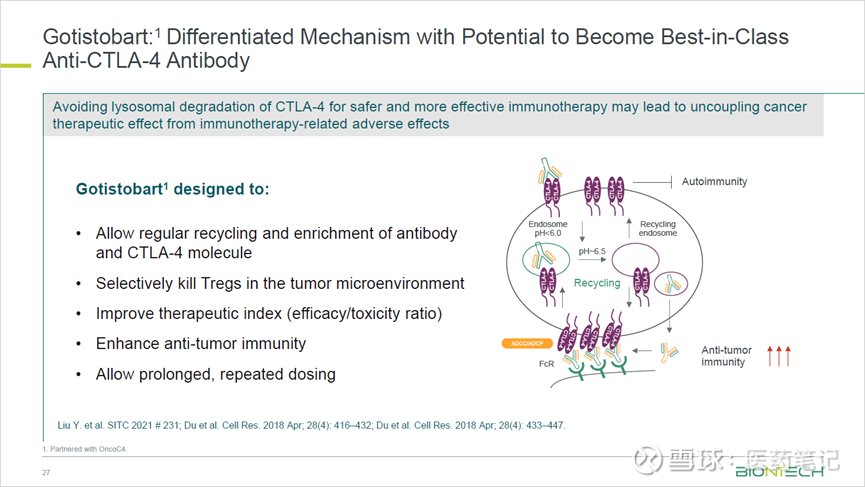
Gotistobart(BNT316/ONC-392)是基于OncoC4刘阳、郑盼教授的多年科学研究而开发,并不单纯阻断CTLA-4信号,而是通过选择性清除肿瘤微环境(TME)中的Treg,从而达到有效性和安全性的更优平衡。
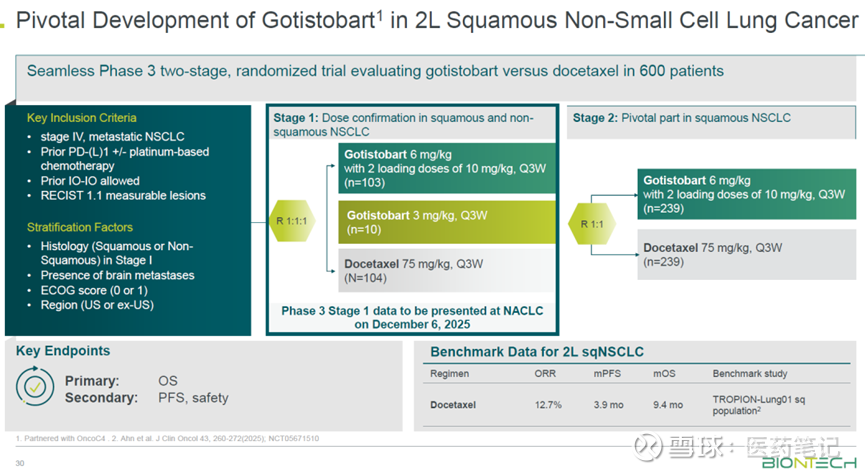
PRESERVE-003(NCT05671510)是一项注册性连续两阶段的国际多中心随机3期临床试验。该临床试验旨在评估Gotistobart作为单一疗法与标准化疗药物多西他赛在此前经PD-(L)1抑制剂治疗下进展的转移性鳞状NSCLC患者中的疗效和安全性。
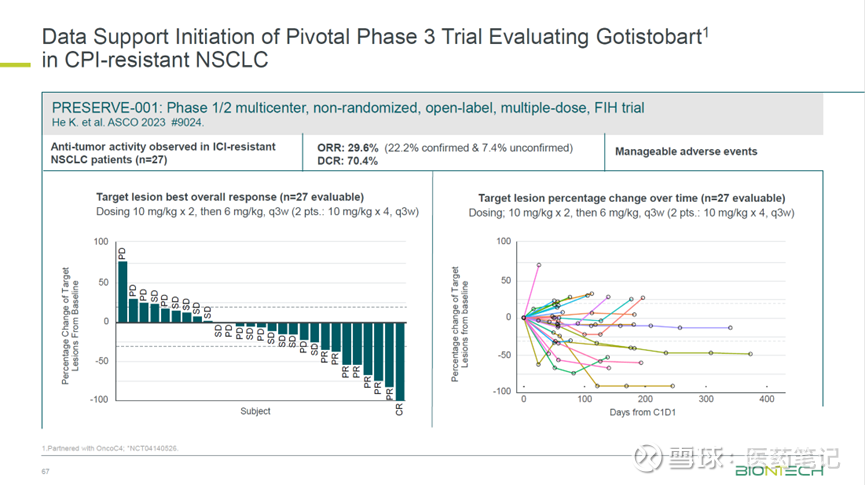
3期临床试验的启动,主要是基于此前2期的数据,也是针对免疫治疗耐受的NSCLC患者,ORR 29.6%,DCR 70.4%。
2023年3月,BioNTech与OncoC4达成合作开发协议,OncoC4收到2亿美元预付款,以及额外的里程碑和双位数百分比销售分成。
2024年10月,美国FDA曾部分暂停过PRESERVE-003,但很快于12月批准继续进行。暂停的原因系独立数据监测委员会发现鳞状和非鳞状疾病患者之间的“不同结果”。恢复开展临床试验后,便只招募鳞状NSCLC患者。
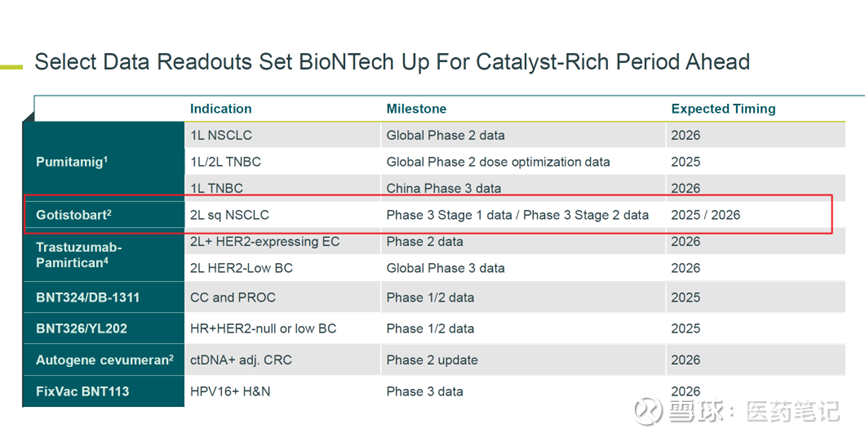
根据BioNTech最近研发日的披露,目前该试验正在全球160个中心开展临床3期第2阶段的试验,预计2026年有数据读出。
突破性的临床结果
PRESERVE-003(NCT05671510)是一个随机、对照、国际多中心的临床试验,数据质量和获得的结果,都相当有说服力。当前正在进行的三期stage2的临床,临床方案和这次报道的stage1高剂量组完全一样,参与的临床中心也一样,相信这也是BioNTech提前预告2026年Stage 2数据读出的底气。
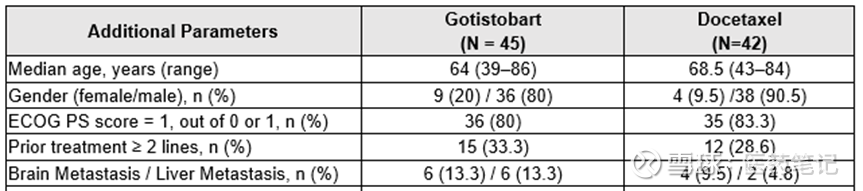
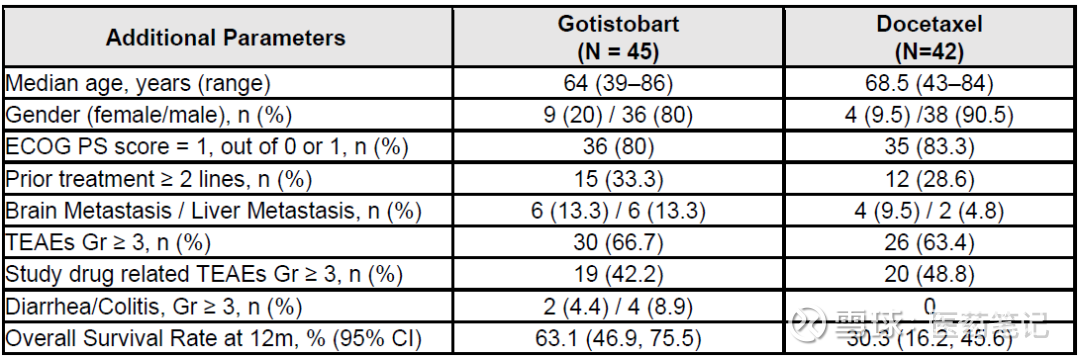
Phase 3 Stage 1设计了2个剂量的试验组和化疗对照组,试验组 1)Gotistobart单药,3mg/kg,Q3W,只入组了10例患者,并且Stage 2不再招募;2)Gotistobart单药,先给2个loading dose是10mg/kg,然后6mg/kg Q3W,也是此次报道的剂量组,N=45。对照组是Docetaxcel,N=42。试验组的脑/肝转移比例高于对照组。
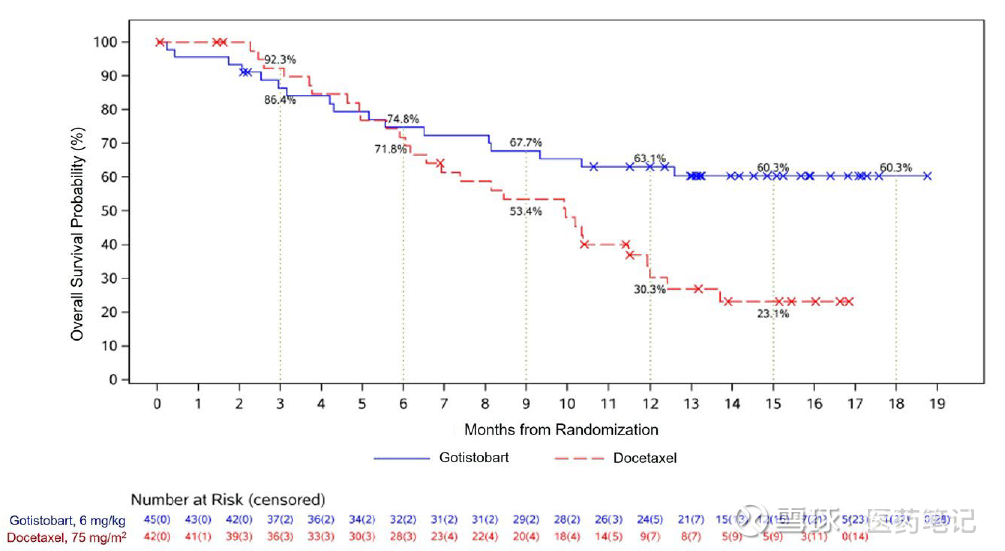
OS的显著阳性结果
12个月生存率对比:Gotistobart 63.1% vs Docetaxel 30.3%。
mOS对比:Gotistobart NR vs Docetaxel 9.95 m
两个组别有显著统计学差异p=0.0102, HR = 0.46 (95% CI: 0.25, 0.84),对照组生存表现和其他临床以前报道的结果高度一致,试验组的有效性相当可靠。
Gotistobart的OS曲线有非常典型的拖尾效应,18个月的OS rate仍是60.3%。目前mOS结果仍不成熟,预计相比标准疗法会有突破性地大幅提升(至少翻倍)。
安全性方面,和标准疗法Docetaxel在3级以上TEAE和TRAE的发生率基本类似。具体的副作用类别在摘要中并未报道,推测和对照组是有所差异的。
解读1:攻克2L+肺鳞癌
非小细胞肺癌(NSCLC)约占所有肺癌病例的85%,其中鳞状NSCLC(sqNSCLC)约占30%~35%。sqNSCLC患者的治疗选择远少于non-sqNSCLC患者,主要源于其独特的临床特征以及缺乏匹配靶向治疗的可作用致癌驱动基因。
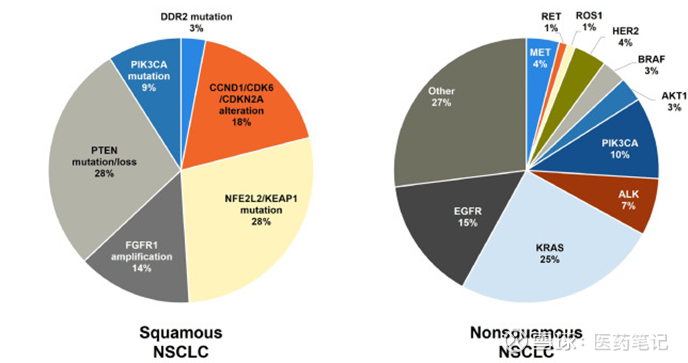
鳞状NSCLC中,“IO 耐药后的二线治疗”长期以来都是肿瘤治疗领域的未解难题,可选治疗有限、疗效提升受限。随着一线IO治疗的普及,这一人群的规模正在持续扩大。
遗憾的是过去几年,多款早期有积极数据的新药或新药组合,在随机对照试验中都未能带来显著获益。
例如,2025年的ASCO报道了PRAGMATICA-LUNG III期研究,联用ramucirumab(VEGFR2抑制剂)和pembrolizumab(PD-1抑制剂),对照标准疗法(化疗)。整体结果显示,鳞癌亚组mOS的结果:联用10.8 vs 化疗8.2,HR=0.82(0.56-1.22),p=0.17,无统计学差异。
参考阅读:晚期 NSCLC「雷莫西尤 + K 药」靶免联合方案疗效如何?
Trop2 ADC (Dato-DXd, Sacituzumab govitecan)、联用TKI和PD-(L)1抑制剂等尝试,也都宣告失败。目前,标准疗法(化疗)的中位生存时间大约是9个月左右。
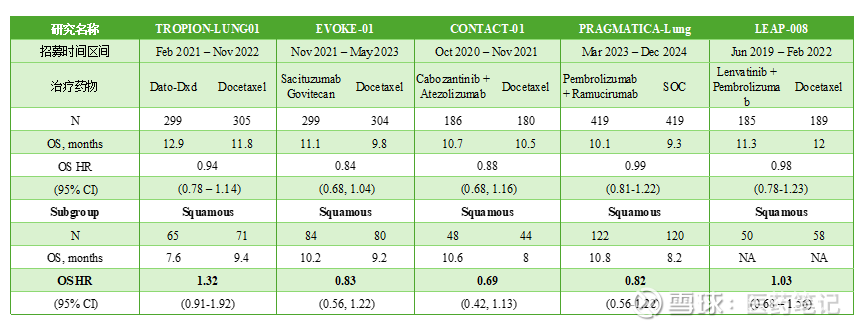
因此,Gotistobart的临床结果,是免疫耐受肺鳞癌这一高难度适应症的重要突破。回顾2025年,PD-1/IL-2、PD-L1 ADC的产品在这个领域都曾报道过积极的1/2期结果。值得关注的是后续随机对照结果。
解读2:高剂量、单药治疗
第一代CTLA-4抗体Ipilimumab已经获批上市超过10年,获批10个适应症。2024年销售额达25亿美元,同比增长13%。研究结果和销售数据充分验证CTLA-4是一个有效的肿瘤治疗靶点。
但是,众所周知,CTLA-4的安全性问题饱受诟病,Ipilimumab受限于安全性问题无法提高给药剂量,获批的给药剂量主要是1mg/kg和3mg/kg,并且几乎全都是和PD-1抗体联用治疗。

那么Gotistobart是否提高了安全性?是否能够提高剂量、加强疗效?
Gotistobart是目前给药剂量最高的CTLA-4抗体,说明安全性获得了大幅提升(所以才支持提高剂量)。3期确定的剂量是先给2个loading dose 10mg/kg,然后6mg/kg Q3W,而Ipilimumab的给药剂量多为1mg/kg和3mg/kg,药物暴露量会提高数倍。
Gotistobart是目前唯一挑战单药治疗且拿到阳性结果的CTLA-4抗体(除Ipilimumab治疗黑色素瘤)。它不仅在CTLA-4抗体这个赛道中独树一帜,并且攻克的是前人屡屡失败的高难度适应症(如前文所述,免疫耐受的sqNSCLC),因此,此项临床数据的含金量不言而喻。
解读3:更广阔的适应症和市场
Gotistobart目前由BioNTech和OncoC4共同开发。正在开展的临床试验包括鳞状非小细胞肺癌、卵巢癌、前列腺癌和多种实体瘤。
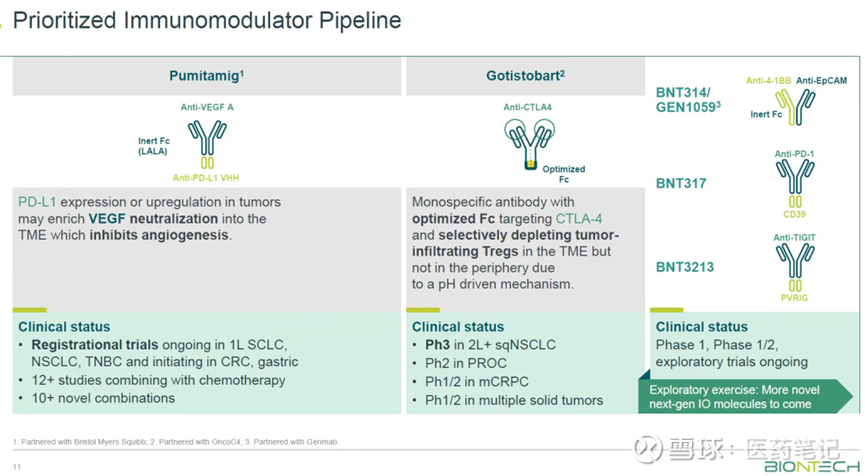
值得一提的是,Gotistobart联合核药Lu 177治疗雄激素受体通路抑制后进展的mCRPC患者,是一项非常创新且想象空间很大的适应症。
随着Gotistobart获得3期临床结果的POC,未来有望积极探索开展更多适应症的临床研究。
联用方面,BioNTech公司已集齐PD-L1/VEGF双抗、CTLA-4抗体、ADC、mRNA等丰富的在研管线,并且现金充裕。考虑到市场对PD(L)1-VEGF类双抗是否能带来OS获益仍有一定疑问,pumitamig和能够带来明显OS获益的gotistobart联用应该是一个很有意思的组合。BioNTech在最近的研发日也暗示了在前线适应症探索这一组合的可能。未来如何拓展Gotistobart联用的治疗方案,联用什么产品、首选何种适应症,将会非常有看点。
小结
Gotistobart 的3期第1阶段数据,不仅证实了其在免疫耐药肺鳞癌中的显著疗效与良好安全性,更标志着CTLA-4靶点的再度进化。
通过精准清除肿瘤微环境中的Treg,gotistobart在提升剂量、单药治疗方面突破了此前CTLA-4抗体的瓶颈,为后续联用与拓展适应症奠定了坚实基础,有望重新定义CTLA-4在肿瘤治疗中的地位。未来BioNTech / OncoC4的数据读出和进一步开发进展,值得业界重视。
相关资料下载:
[1] NACLC 2025 Abstract. Phase 3 Stage 1 Randomized Controlled Trial of Gotistobart vs. Docetaxel in Patients With Metastatic Squamous Cell Lung Cancer who Have Progressed on PD-(L)1 Inhibitors
[2] BioNTech R&D Day 2025
[3] Paul K. Paik, Jianjun Zhang, Howard (Jack) West, Jonathan W. Riess, Squamous Non-Small Cell Lung Cancer: Current and Emerging Treatment Options, Clinical Lung Cancer, 2025, ISSN 1525-7304
Armstrong技术全梳理系列
GPRC5D靶点全梳理;
CD40靶点全梳理;
CD47靶点全梳理;
补体靶向药物技术全梳理;
补体药物:眼科治疗的重要方向;
Claudin 6靶点全梳理;
Claudin 18.2靶点全梳理;
靶点冷暖,行业自知;
中国大分子新药研发格局;
被炮轰的“me too”;
佐剂百年史;
胰岛素百年传奇;
CUSBEA:风雨四十载;
中国新药研发的焦虑;
中国生物医药企业的研发竞争;
中国双抗竞争格局;
中国ADC竞争格局;
中国双抗技术全梳理;
中国ADC技术全梳理;
Ambrx技术全梳理;
Vir Biotech技术全梳理;
Immune-Onc技术全梳理;
亘喜生物技术全梳理;
康哲药业技术全梳理;
科济药业技术全梳理;
恺佧生物技术全梳理;
同宜医药技术全梳理;
百奥赛图技术全梳理;
腾盛博药技术全梳理;
创胜集团技术全梳理;
永泰生物技术全梳理;
中国抗体技术全梳理;
德琪医药技术全梳理;
德琪医药技术全梳理2.0;
和铂医药技术全梳理;
荣昌生物技术全梳理;
再鼎医药技术全梳理;
药明生物技术全梳理;
恒瑞医药技术全梳理;
豪森药业技术全梳理;
正大天晴技术全梳理;
吉凯基因技术全梳理;
基石药业技术全梳理;
百济神州技术全梳理;
百济神州技术全梳理第2版;
信达生物技术全梳理;
信达生物技术全梳理第2版;
中山康方技术全梳理;
复宏汉霖技术全梳理;
先声药业技术全梳理;
君实生物技术全梳理;
嘉和生物技术全梳理;
志道生物技术全梳理;
道尔生物技术全梳理;
尚健生物技术全梳理;
康宁杰瑞技术全梳理;
科望医药技术全梳理;
岸迈生物技术全梳理;
礼进生物技术全梳理;
康桥资本技术全梳理;
余国良的抗体药布局;
荃信生物技术全梳理;
安源医药技术全梳理;
三生国健技术全梳理;
仁会生物技术全梳理;
乐普生物技术全梳理;
同润生物技术全梳理;
宜明昂科技术全梳理;
派格生物技术全梳理;
迈威生物技术全梳理;
Momenta技术全梳理;
NGM技术全梳理;
普米斯生物技术全梳理;
普米斯生物技术全梳理2.0;
三叶草生物技术全梳理;
贝达药业抗体药全梳理;
泽璟制药抗体药全梳理;
恒瑞医药抗体药全梳理;
齐鲁制药抗体药全梳理;
石药集团抗体药全梳理;
豪森药业抗体药全梳理;
华海药业抗体药全梳理;
科伦药业抗体药全梳理;
百奥泰技术全梳理;
凡恩世技术全梳理。