对CAR-T行业的一些研究学习(三)
新人学习,多多交流$科济药业-B(02171)$
前言
CAR-T行业在自体CAR-T方面的投资研究可以说是非常详细了,所以作为新人,我主要是做体内CAR-T和通用型CAR-T的开荒工作。
上一篇文章是10天前完成的对CAR-T行业的一些研究学习(一)这篇,今天怎么突然就(三)了?是因为期间有个(二)是讲的体内CAR-T的,而正好涉及到一项一级市场BP的评估指导工作插入进行,出于保密原则体内CAR-T的内容就取消雪球分享了,仅给出其最终的众多结论中的几个主要结论供参考:
①通用型CAR-T与体内CAR-T是市场分层,两者理论上不需要直面竞争。
②LNP-mRNA载体体内CAR-T适合自免,病毒-DNA载体体内CAR-T适合血液瘤,技术进一步优化前不考虑实体瘤。
③体内CAR-T的本质是基因疗法,大厂积极布局且早期极少数数据表现不错,但还处于无确定性阶段,太早期了,不建议二级市场投资。
④体内CAR-T的获批会极快,但是获批后实际需要慢病毒载体15年随访,LNP载体5年随访的严格程度大于普通CAR-T,且存在孕期伦理问题。
⑤IIT属于学术探索,是归卫健委的,而实际临床是归药监局的,两者均需要数据完整、独立且分离。
注:本次研究核心目的是搭建了行业逻辑-技术路线-重点标的-核心矛盾的认知体系,在短时间(一个月)内完成从0到1的知识储备。后续研究需要在此框架下按一产品一策略的原则进行,需要具体公司具体药物补充分析具体靶点、适应症、临床方案以及价值量化、监管评价、动态跟踪等。
通用型CAR-T介绍
基本概念
通用型CAR-T(UCAR-T)是指从健康供者而非患者自身获取T细胞,经基因编辑改造后制成的现货型细胞治疗产品。
制备路线:
l 从健康志愿者采集T细胞
l 通过基因编辑技术(CRISPR/Cas9或TALEN)敲除关键免疫排斥基因
l 转入靶向肿瘤抗原的CAR基因
l 扩增后冷冻保存,患者需要时可立即使用
核心创新是打破传统自体CAR-T一患一批次的个性化制备模式,实现批量生产、标准化质控的通用产品。
技术原理
通用型CAR-T需要解决两大免疫排斥问题:
l GVHD(移植物抗宿主病):供体T细胞攻击患者组织
l HVG(宿主抗移植物反应):患者免疫系统清除供体CAR-T细胞
基因编辑策略:
l 敲除TCR基因:消除供体T细胞识别患者组织的能力
l 敲除HLA I类基因:避免被患者免疫系统识别为外来物
l 敲除CD52:使CAR-T细胞对免疫抑制剂 (如阿仑单抗)产生抗性,深度清淋重塑免疫以避免排异
l 其他创新策略:如SPPL3编辑(保留TCR功能但增强免疫耐受)等
基因编辑方面与体内CAR-T的区别
不考虑LNP递送CAS9插入CAR基因这样可行但八字还没一撇的体内CAR-T思路。
体外CAR-T如通用型CAR-T可用CRISPR/Cas9、TALEN 或 SPPL3等基因编辑工具,敲除相关基因,而体内CAR-T不这样进行。
体外CAR-T可通过CRISPR/Cas9技术精确切割DNA从而配合慢病毒技术做到基因的精准插入,而体内CAR-T仅有插入功能,无法做到精准插入,会错误插入,因此从错误插入的几率来说其实体内CAR-T更大。
体外CAR-T可选择更健康的细胞进行基因编辑,且可进行多基因同时编辑(如 TRAC+B2M+CAR),并且可在编辑后筛选成功编辑的细胞,确保质量,而体内CAR-T做不到,所以无论是疗效上限还是潜在的安全风险,现阶段技术水平下看,其实均更佳。
发展历史靠基因编辑技术的推动
早期历史
概念萌芽与 CAR 技术奠基(1980s-1990s)
l 1982年:科学家首次发现TCR能识别MHC呈递的肿瘤抗原,为免疫治疗奠定理论基础。
l 1987年:Kuwana首次报道嵌合受体概念,将抗体可变区与 TCR 恒定区结合。
l 1989年:以色列科学家Zelig Eshhar和Gideon Gross首次将完整CAR结构导入T细胞,创建第一代CAR,即仅包含抗体单链可变片段 (scFv) 和CD3ζ信号结构域,标志着CAR-T技术正式诞生。
CAR-T 技术迭代与通用化构想(2000s-2010s初)
l 2002年:Michel Sadelain团队在CAR中引入CD28共刺激因子,开发第二代CAR-T,显著提升T细胞增殖和持久性。
l 2010年:CAR-T 之父Carl June教授团队在《新英格兰医学杂志》发表突破性成果,首次用自体CAR-T治愈复发难治性急性淋巴细胞白血病患者,引发全球关注,也催生了通用型CAR-T研发。
l 2012年:两大关键突破,首例儿童ALL患者被CAR-T彻底治愈,确立CAR-T在血液肿瘤治疗中的地位;CRISPR/Cas9 基因编辑技术问世,为通用型CAR-T解决免疫排斥提供革命性工具。
通用型CAR-T的技术突破与临床探索(2014-2018)
l 2014-2015年:通用型CAR-T概念正式成型,核心思路是,使用健康供体 T 细胞替代患者自体T细胞,通过基因编辑技术敲除关键排斥基因,实现现货型治疗。
l 2017年2月7日:法国Cellectis公司的UCART123获美国FDA批准开展临床试验,成为全球首款获FDA IND批准的通用型CAR-T,靶向CD123,用于治疗急性髓系白血病(AML)和母细胞性浆细胞样树突状细胞肿瘤(BPDCN)。
l 2017年8月:首个自体CAR-T产品(诺华 Kymriah)获FDA批准上市,CAR-T疗法正式进入商业化时代,也为通用型CAR-T铺平道路。
l 2017年9月:UCART123临床试验因一例患者死亡被FDA暂停,暴露早期通用型CAR-T安全性挑战,推动技术优化。
技术路线靠基因编辑技术推进
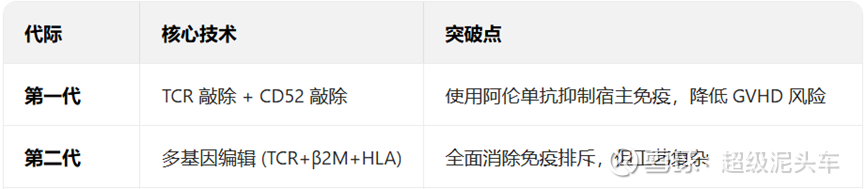
l TCR敲除是避免移植物抗宿主;CD52是结合阿仑单抗清淋来避免宿主抗移植物,并在宿主淋巴细胞恢复的时间段内将其视为自身细胞;β2M或HLA敲除是进一步完善避免宿主抗移植物,防止NK细胞的攻击。
l 第一代技术就是上文提及的法国Cellectis公司的早期产品,最早是2015年的UCART19(CD19 靶向)和UCART123(CD123靶向),首次证明异体CAR-T可行性,但是仅敲除CD52靠阿伦单抗(CD52)也并不能完全防护免疫排异,依旧是有安全风险的,并且早期的技术敲除效率低,细胞活性差,疗效也不高。
l 第二代技术是进一步敲除β2M或HLA或PD-1等进行多基因编辑,做到消除免疫排异等,同时避免CD52深度清淋的负面影响,这是现在较为主流的思路,唯一的缺陷是复杂度增加。
l 后续技术则没有定论,均有不同的发展方向,比如单基因编辑突破(北京大学魏文胜团队发现SPPL3单基因敲除即可实现免疫隐身,同时保留TCR功能)、模块化设计(SUPRA CAR系统和UniCAR系统)进行简化生产流程、降低成本、提高安全性。
l 不管是第一代技术还是第二代技术均为基因编辑技术推进的,Cellectis公司能成为通用CAR-T的先驱是因为其拥有TALEN技术的核心专利,而后续出现的CRISPR/Cas9技术则进一步给出了大规模、快速、通用、难度更低、成本更低而运用广泛的基因编辑技术,从而成为革命性工具(但是理论上CRISPR/Cas9技术不如TALEN的安全性与精准能力高)。
l 不过TALEN技术与CRISPR/Cas9技术均远优于更早的传统基因编辑技术,是明确的技术迭代。
后期历史
血液肿瘤领域突破:
l 2023年:科济药业CT0590 (靶向 BCMA)在多发性骨髓瘤临床试验中,首例患者低剂量治疗28天即达完全缓解且MRD阴性,展示优异疗效。
l 2025年初:成都优赛诺UC101 (脐血来源)获美国FDA和中国NMPA双批准,成为全球首个获批临床的脐血通用型CAR-T,为通用型CAR-T提供新思路。
自身免疫疾病新领域:
l 2024年:邦耀生物TYU19在《Cell》发表全球首例通用型CAR-T治愈系统性红斑狼疮(SLE)的临床结果,被Carl June誉为自身免疫病治疗范式变革,并获《Cell》年度最佳论文。
l 2024-2025年:徐沪济团队完成全球首例通用型CAR-T治疗系统性硬皮病与炎性肌病,进一步扩展应用范围。
产业爆发:
l 2024年11月:罗氏以15亿美元收购Poseida,诺华、武田也相继布局,全球进入通用型CAR-T时间,产业规模迅速扩大。
l 2025年:多款通用型CAR-T产品进入III期临床。
结论
通用型CAR-T从意义有限发展到临床实验可行,主要是因为CRISPR/Cas9 基因编辑技术等新一代技术的使用,这是由新技术工具推进的医学革命,但这也是体内CAR-T的短板,体内CAR-T虽然可及性更高,但是其本身能力与使用病毒载体路径的安全性的上限在现阶段的技术下确实不如含通用型CAR-T在内的体外CAR-T。
同时,进一步来说,参考通用型CAR-T的严格基因编辑步骤,再次对体内CAR-T的慢病毒路径的长期安全性与稳定性提出风险提示,也对LNP载体路径的自免差异化的可行性更加认可。
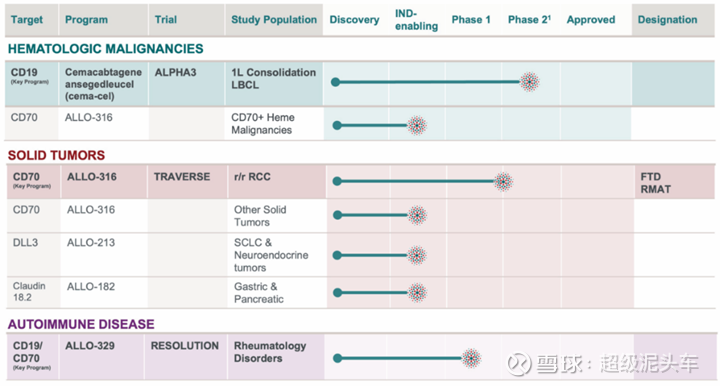
通用型CAR-T产品及公司整理
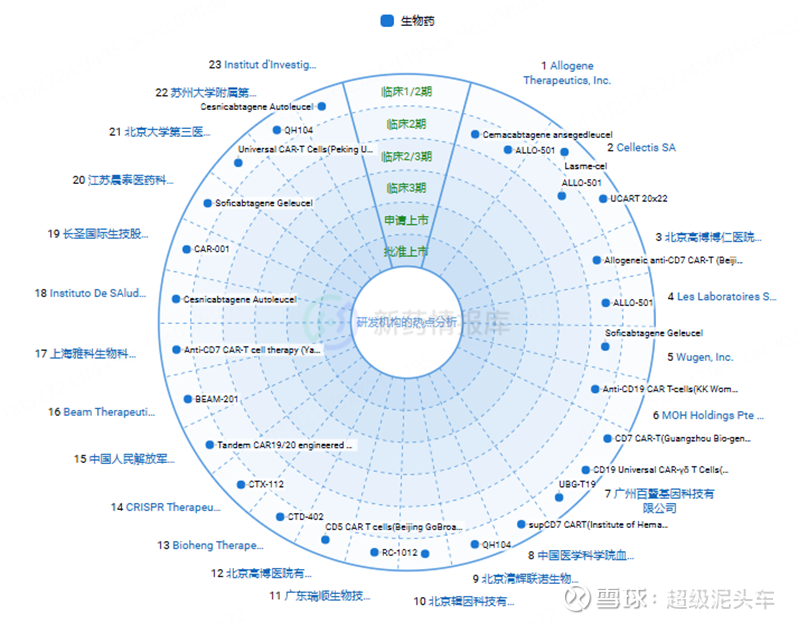
从智慧芽数据库看,全球的通用CAR-T为363款,临床1b/2期及以上的如上图所示,具体涉及的公司为:Allogene、Cellectis、北京高博博人医院、Les Laboratoires Servier SAS、Wugen, Inc.、MOH Holdings Pte Ltd.、广州百暨基因科技有限公司、中国医学科学院血液病医院、北京清辉联诺生物科技有限责任公司、北京辑因科技有限公司、瑞创生物技术有限公司、Bioheng Therapeutics Ltd.、CRISPR Therapeutics AG、中国人民解放军总医院、Bambino Gesu Hospital、上海雅科生物科技有限公司、Instituto De SAlud Carlos Iii De Madrid、长圣国际生技股份有限公司、江苏晨泰医药科技有限公司、北京大学第三医院、苏州大学附属第四医院、Institut d'Investigacions Biomèdiques August Pi i Sunyer。
经过AI进一步筛选,保留有相关数据信息的,并添加一些有名的国内其他企业:Allogene、Cellectis、CRISPR Tx、清辉联诺、博雅辑因、百暨基因、301医院、Wugen、Cellectis、高博医院、科济药业、邦耀生物、优赛诺、亘喜生物、Caribou、启函生物、北恒生物。同时,各大MNC也在积极布局。
完整整理

该图将能看的企业也整理了七七八八,后续计划挑选详细的几家展开说说,分别是:①Cellectis(CAR-T先驱,平台壁垒高,产品数据多,进度三期)、②Allogene(技术承接授权自Cellectis,商业化路径清晰,有 3 年长期生存数据支撑,且和Cellectis存在差异化,同时和吉利德与辉瑞关联)、③Caribou Biosciences(MNC辉瑞投资布局,主流CRISPR技术),这些基本都有1-2期数据可以看,其他数据较早期。
同时其他MNC的布局,如④罗氏、阿斯利康,虽然阶段早无详细数据,但可以简单看看怎样的技术是他们看好的。
最后,⑤Wugen、科济、传奇,这些市场上热度较高的也值得研究评价。
因此需要分为五部分进行介绍。
Cellectis
Cellectis是一家总部位于法国巴黎的临床阶段生物技术公司,是通用型CAR-T领域的先驱,且经历了早期产品的失败和后续迭代,值得一说。
技术:
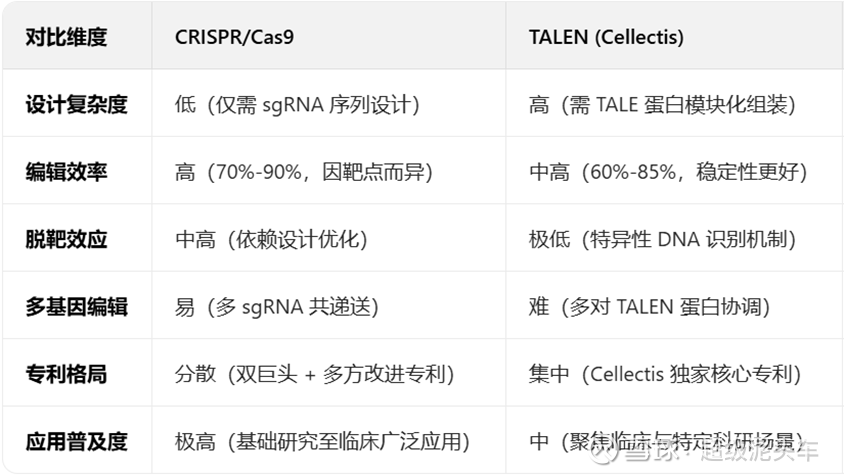
Cellectis的通用型CAR-T技术建立在其TALEN®(转录激活因子样效应物核酸酶)基因编辑技术之上,这是一种比CRISPR更早的基因编辑技术。两种基因编辑技术具体原理不做介绍,因为均已经成熟,直接视为两种完整工具介绍其效果即可。
虽然比更通用且直接推动行业进展的CRISPR技术更早,但TALEN技术本身并不差,不是上一代技术。
其后续出现的CRISPR/Cas9技术成为革命性工具主要是给出了大规模、快速、通用、难度更低、成本更低、更易多基因编辑而运用广泛的基因编辑技术,但是理论上来说,广泛使用的CRISPR/Cas9技术并不如TALEN技术的安全性与精准能力高。
不过其专利更集中,所以专利壁垒也更高,在这方面具有一定的优势。
产品:
该公司作为通用型CAR-T的先驱且现在一直迭代,其产品值得详细介绍。
UCART19(第一代通用型CAR-T,失败)
基本信息:
l 该通用型CAR-T与Servier还有辉瑞均有合作,但是辉瑞后续退出,这是最早的通用型CAR-T之一,和另一款UCART123一起是2017年FDA批准临床,属于先驱者。
l 该通用型CAR-T靶向CD19即B细胞,因为CAR结构有4-1BB共刺激所以相当于第二代传统CAR-T,但是其仅敲除TRAC+CD52,所以属于第一代通用型CAR-T,依旧有潜在的宿主抗移植物风险。
l 设计时存在RQR8(CD34+CD20 融合蛋白)安全开关,即可被利妥昔单抗快速清除失控 CAR-T 细胞。
临床结果:
l 成人CALM研究,入组12例r/r B-ALL,缓解率58%(7/12),3级CRS为33%(4/12),4级神经毒性为17%(2/12)。2例治疗相关死亡(1例严重CRS+多器官衰竭,1例神经毒性+脑水肿)。
l 儿科 PALL 研究,入组5例r/r B-ALL,缓解率60%(3/5),3级CRS为40%(2/5),无 GvHD。3例治疗相关死亡(均为严重感染+免疫抑制)。
l 2019年1月,Pfizer/Servier宣布终止UCART19全球临床开发,原因是疗效未达预期,且安全性风险高于自体CAR-T。辉瑞后续终止合作将其权益转授给Allogene并继续迭代该药(2025年12月仲裁确认Allogene对该药的控制权,具体迭代数据在Allogene展示),2023年辉瑞以2500万美元投资Caribou Biosciences,聚焦其通用BCMA CAR-T疗法CB-011,进行了新布局。
失败分析:
l 作为先驱者,其CAR设计亲和力过高,毒性大且不持久,所以疗效差的同时安全性也不佳。
l 安全开关RQR8 在高肿瘤负荷患者中清除效果不佳,无法快速控制致命毒性。
l 基因编辑虽然和传统的方案比是迭代了,但早期还是不完善且该技术的难度大,所以效率还是不足,导致药物本身也存在移植物抗宿主和宿主抗移植物的风险。
l 预处理方案清淋过强,免疫抑制和感染的风险极大。
l 也存在剂量递增不合理和患者基线太差的情况。
UCART123(第一代通用型CAR-T,首个临床致死案例)
基本信息:
l 该通用型CAR-T是最早获得FDA批准临床的通用型CAR-T,在2017年与UCART19一样,属于先驱者。
l 该通用型CAR-T靶向CD123,可治疗复发/难治性急性髓系白血病(AML)与母细胞性浆细胞样树突状细胞肿瘤(BPDCN)。
l 因为CAR结构有4-1BB共刺激所以相当于第二代传统CAR-T,但是其仅敲除TRAC+CD52,所以属于第一代通用型CAR-T,依旧有潜在的宿主抗移植物风险。
l 设计时比UCART19还原始,未设计安全开关。
临床结果:
l 2017年8月,1例BPDCN患者接受最高剂量(1×10⁸细胞 /kg)后出现致命CRS+毛细血管渗漏综合征,多器官衰竭死亡。
l FDA紧急暂停全球临床试验,行业震动。
失败分析:
l CD123在正常造血干细胞和内皮细胞表达,导致脱靶毒性。
l 缺乏安全开关,无法快速控制。
l 剂量过高。
l 后续即使优化CAR亲和力且增加安全开关,但是2022年重启后CR依旧仅35%,不过确实无严重安全事件。
UCARTCS1A(第一代通用型CAR-T,多发性骨髓瘤失败案例)
基本信息:
l 该通用型CAR-T靶向CS1(CD2 subset 1),用于复发/难治性多发性骨髓瘤(MM)。
l 因为CAR结构有4-1BB共刺激所以相当于第二代传统CAR-T,但是其不仅敲除TRAC+CD52,还敲除CS1这一其本身靶向的靶点,所以虽然属于第一代通用型CAR-T,但也有进一步的优化,不过依旧有潜在的宿主抗移植物风险。
l 有安全开关RQR8。
临床结果:
l 2020年7月,1例接受最高剂量患者出现心脏骤停死亡,伴随严重CRS与噬血细胞综合征。
l FDA暂停试验,Cellectis终止该产品线。
失败分析:
l CS1 在 NK 细胞 / 部分 T 细胞表达,导致免疫细胞交叉杀伤,引发系统性炎症。
l 预处理方案过强,与 CAR-T 毒性叠加。
Lasme-cel(UCART22)B-ALL 的突破性产品(临床2期)
基本信息:
l 该通用型CAR-T靶向CD22,用于复发/难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。
l 依旧是相当于第二代传统CAR-T的第一代通用型CAR-T。
l 有安全开关RQR8。
临床结果(2025年ASH):
l ORR=68%(22/32),其中MRD阴性率82%,远超历史疗法,尤其对CD19 CAR-T治疗失败患者有效。
l 3级及以上CRS为12%,无4-5级CRS;无GvHD。
l 难治患者中,11名经3线以上治疗(含CD19 CAR-T)患者中,8名缓解,7名MRD阴性。这解决CD19逃逸问题,成为B-ALL后线治疗新选择。
成功分析:
l 优化CAR亲和力,降低脱靶毒性,提升肿瘤特异性。
l 清淋根据患者状态决定是否使用阿伦单抗,增加了安全性,剂量递增也合理。
l 明确是总结了之前的失败。
Eti-cel(UCART20x22)双靶点产品(临床1期)
基本信息:
l 该通用型CAR-T靶向CD20+CD22双靶点,用于复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)。
l 依旧是相当于第二代传统CAR-T的第一代通用型CAR-T,但进行了双靶点的优化。
l 有安全开关RQR8。
临床结果(2025年ASH):
l 首批15例患者中,ORR达73%,完全代谢缓解率(CMR)达53%。
l 无4-5级CRS,仅1例1级GvHD,安全性优异。
l 双靶点设计有效防止抗原丢失,缓解持续时间显著延长。
成功分析:
l 优化CAR亲和力,降低脱靶毒性,提升肿瘤特异性。
l 清淋根据患者状态决定是否使用阿伦单抗,增加了安全性,剂量递增也合理。
l 明确是总结了之前的失败。
结论和思考
l 之前研究认为,通用型CAR-T因为无需考虑患者本身T细胞状态,所以可以新开一道线的治疗,但需要避免选择和上市药物同靶点,这点在该公司的靶点选择上非常明确的体现。
l 虽然早期靶点的选择太激进了,使得肿瘤特异性不够,叠加CAR-T的高强度,所以早期安全风险不断,但该思路是必须的逻辑,否则最终产品适用范围有限。
l 该公司并未按主流思路从第一代通用型CAR-T进一步敲除β2M或HLA迭代为第二代通用型CAR-T进一步完善避免宿主抗移植物,防止NK细胞的攻击。但后续成功案例来说,从安全性上看,第一代通用CAR-T与第二代通用CAR-T似乎影响有限,这需要进一步验证,可以比较被授权技术的Allogene的第二代通用CAR-T来判断。
l 该公司作为先驱,其技术本身具有极高壁垒且技术的专利保护完备,虽然简单程度和编辑效率不如更广泛使用的CRISPR/Cas9技术,但是其理论上错误编辑的概率小于CRISPR/Cas9技术,从而安全性和精准性更高,有自己的价值,但是股价依旧在早期跌跌不休,辉瑞的合作也慢慢退出,仅3.5亿美元,说明一家公司光有技术也是不够的,需要产品管线实打实的数据来验证。
补充说明CRISPR/Cas9技术最大的痛点:
CRISPR/Cas9技术与TALEN技术各有侧重,但CRISPR/Cas9技术最大的问题在于专利,2012年6月:Jennifer Doudna和Emmanuelle Charpentier在《Science》发表论文,首次证明CRISPR-Cas9系统可在试管环境中切割DNA,同年5月提交专利申请(PCT/US2012/038762),但仅涵盖无细胞系统应用;2013年1月:张锋团队在《Science》发表论文,首次证实CRISPR-Cas9可在真核细胞(人类和小鼠细胞)中进行基因编辑,也提交专利。
两者的官司的最终结果是:美国专利审判和上诉委员会裁定张锋团队胜诉,拥有真核细胞CRISPR编辑专利,Doudna团队仅保留无细胞系统专利。
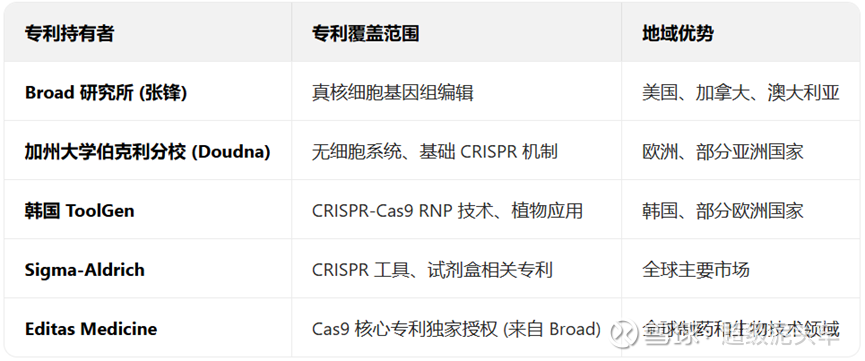
进一步来说,因为该技术本身与同样迭代性的技术比,其高效低门槛的特点使得其具有基石地位,从而有潜在的百亿美元市场,使得大量企业竞速布局,全球CRISPR相关专利已超12000项,形成密集专利丛林,使技术应用复杂化。
虽然学术研究免费,但是商业化开发则需要多重授权,不仅繁琐耗时,还需要较高的授权费用,或者通过技术互补形成专利联盟,以及进行技术优化规避以及区域性规避(如某些欧洲国家不授予基因编辑方法专利)等方案进行内卷。
这个情况需要持续到2034年左右,各CRISPR相关专利陆续到期才行。
Allogene Therapeutics
Cellectis是CAR-T行业的先行者,而该公司则是紧追其后,同时该公司2018年由吉利德前高管团队创立,核心团队来自吉利德旗下Kite Pharma,具备自体CAR‑T(Yescarta)商业化与临床开发经验,快速迁移至通用 CAR‑T 领域,所以获TPG、辉瑞等 3 亿美元首轮融资。
从辉瑞承接16项临床前CAR‑T资产与Cellectis授权权益,包括UCART19(cema‑cel 前身)的美国权益。
技术:
Allogene的技术来自于Cellectis的授权,依旧是早于CRISPR/Cas9技术但各有千秋的TALEN®(转录激活因子样效应物核酸酶)基因编辑技术。
产品:
临床及申请临床阶段管线如下:
ALLO‑501A(cema‑cel)
基本信息:
l 该药即UCART19的V1版本(ALLO‑501)在Cellectis临床失败后进一步迭代的结果,现在处在临床2期。
l 靶向为CD19,敲除TRAC+CD52。
迭代方式:
l 降低了CAR的亲和力,防止过度激活和快速耗竭。
l 早期的技术是TALEN或者CRISPR‑Cas9精准敲除后用慢病毒随机插入,因此CAR的位置不精准,细胞能力不足,而此时技术进一步迭代,做到了精准插入。
l 早期的CAR设置有控制开关,在失控时可用利妥昔单抗快速清除,但也使得CAR结构不稳定,此时删除了开关,但是还是技术的迭代,采用了可直接靶向CAR的抗体作为清除的方式。
l 完善了给药方案和入组条件。
临床结果:
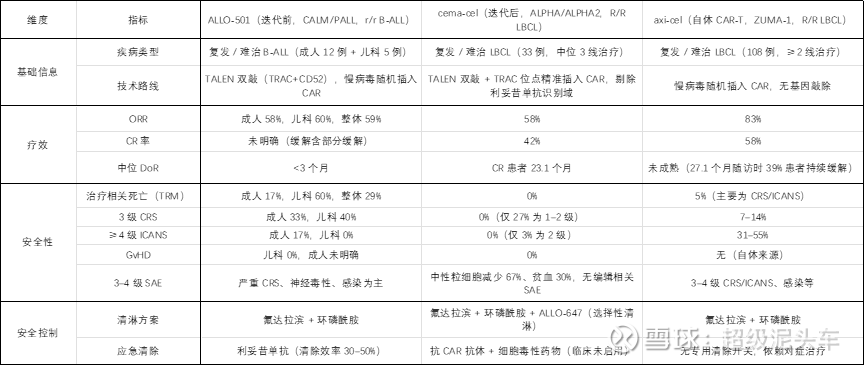
如图,和迭代前因为适应症改变所以无法直接比较,但和已有传统CAR-T比较则可以发现,虽然疗效不如,但确实解决了之前的痛点。持续性提高,且安全性极佳,确实具备一定的价值。
思考:
l 疗效与持续时间均不如自体CAR-T,这是意料之中,因为通用型CAR-T还在完善且理论上最多也就是非劣于自体CAR-T。
l 但实际上,早期通用型CAR-T的问题被解决,其安全性持续性和疗效均不差,考虑其对体内T细胞无要求,确实有新开一线的潜力。
l 这是第一代通用型CAR-T的完善,似乎安全性很好,迭代到第二代继续敲除β2M或HLA等进行多基因编辑,做到消除免疫排异等似乎意义不大?
ALLO-316(临床2期)
基本信息:
l 该药是CD70靶点药物,适应症为复发/难治性晚期/转移性肾细胞癌(ccRCC为主,占RCC的80%以上),也有CD70阳性血液瘤(急性髓系白血病、非霍奇金淋巴瘤)及其他实体瘤(胶质瘤、骨肉瘤、头颈鳞状细胞癌)的潜在适应症。
l 现有肾细胞癌的适应症中,针对免疫检查点抑制剂(ICIs)和酪氨酸激酶抑制剂(TKIs)治疗失败的患者,填补末线治疗空白(此类患者既往中位生存期仅数月)。
l 授权使用 Cellectis 公司的 TALEN® 技术,因为CAR结构有CD28共刺激所以相当于第二代传统CAR-T,但是其仅敲除TRAC+CD52,所以属于第一代通用型CAR-T。
l 与4-1BB共刺激不同,4-1BB共刺激的信号持久但温和,所以Cellectis 公司主要用这个。CD28共刺激信号强度高且快速,但会因scFv结构不稳定导致非抗原依赖性持续激活,引起T细胞耗竭,不过实体瘤缺氧、低pH、营养匮乏的微环境更适合糖酵解代谢偏好的CD28 CAR-T细胞,所以肾细胞癌的ALLO-316会选择这个。
l 整合CD20模拟表位,作为开关可通过利妥昔单抗快速清除异常激活的CAR-T细胞。这其实是对早期开关的优化,早期开关干扰抗原结合和信号传导的问题进一步解决,也比抗CAR抗体的临床应用成熟。且其含有实体瘤的适应症,需要长期抗肿瘤活性,对CD20开关来说也比抗CAR抗体更合适。
l 对CD70靶点采用Dagger技术,隐藏本身CD70靶点防自相残杀,且CD70靶向还能清除Treg等细胞。
临床结果:
TRAVERSE研究(NCT04696731):多中心I期剂量递增研究,评估ALLO-316在晚期或转移性透明细胞肾细胞癌(ccRCC)患者中的安全性和有效性。
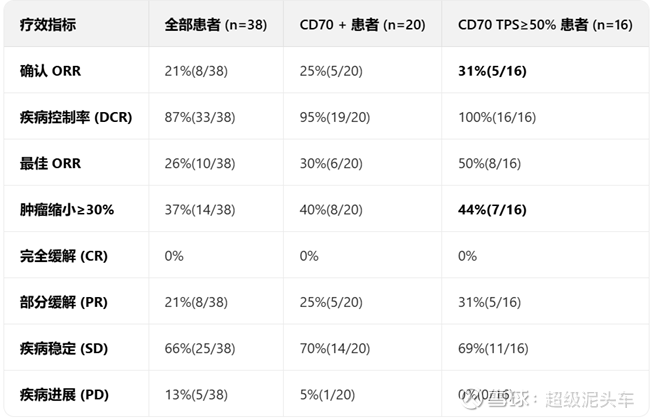
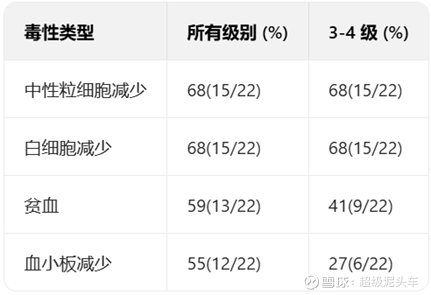
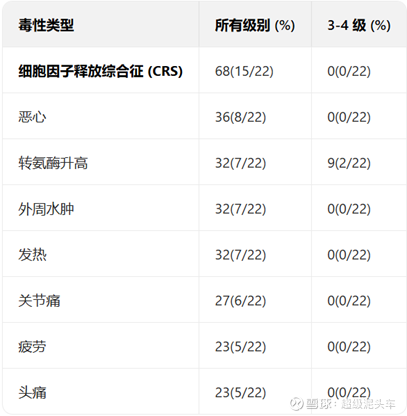
安全性较高。血液毒性高是合理的,因为此类疗法因清淋和短期间接的骨髓损伤均存在短期的血液毒性;非血液毒性极低,基本无严重不良反应。而这一点是传统疗法如IO或者TKI或者化疗的持续损伤不能比的。
从数据看具有一定的疗效但难以定量,如果进一步比较其他的后线方案则可以发现,数据确实优于现有方案,有较高的潜力:

成功分析:
l 基于早期Cellectis的失败经验和合适标志物的患者筛选,能有较好数据是合理的。
一个反逻辑的问题:
l CAR-T疗法多用于血液瘤,实体瘤还在探索中,该药甚至只相当于普通CAR-T的第二代,为什么能解决实体瘤?这其实具有特殊性。
l 核心原因一是:CD70靶点在肾细胞癌中意义很大,高表达且持续表达,但是也在活化的T细胞表面表达,所以普通的CD70靶点CAR-T会互相攻击(回输时的CAR-T本身就是活化态,持续高表达CD70),如果敲除CD70则无法正常发挥作用,所以这个靶点本身就难以被考虑,但是该公司采用Dagger技术通过CAR分子的特殊空间构象隐藏了自身的CD70靶点,从而不会被自己杀伤。同时CD70也在Treg等细胞表达,清除后也可防止自己被抑制,可持续发挥作用。
l 核心原因二是:普通CAR-T因为未考虑免疫抑制,所以清淋效果一般,只能清除循环T细胞,目的是为回输的自体CAR-T腾出增殖空间,对肿瘤微环境中的抑制性细胞网络(Tregs、MDSC等)效果有限。而异体CAR-T需要考虑免疫抑制采用了深层的CD52单抗清淋,清除了所有免疫细胞,包括肿瘤微环境中的抑制性细胞网络。
l 核心原因三是:肾细胞癌的血管丰富、基质松散,更易浸润。
ALLO-329(临床1期)
基本信息:
l ALLO-329 是Allogene Therapeutics 公司开发的首款双靶点 (CD19/CD70) 异体 CAR-T 细胞疗法,专为治疗自身免疫性疾病设计。
l ALLO-329 已获美国 FDA 三项快速通道资格认定 (FTD),用于治疗:系统性红斑狼疮、特发性炎症性肌病、系统性硬化症。
l 并未描述是否有开关处理失控问题,对共刺激组件也未描述。
l 该药是Allogene Therapeutics的首个CRISPR-based通用型CAR-T产品。
无具体临床数据所以分析技术转变:
l 已知在技术上后续出现的CRISPR/Cas9技术成为革命性工具主要是给出了大规模、快速、通用、难度更低、成本更低、更易多基因编辑而运用广泛的基因编辑技术,但是理论上来说,广泛使用的CRISPR/Cas9技术并不如TALEN技术的安全性与精准能力高。
l TALEN特异性更高,但是更适合少的基因,多基因可做但是它的难度和成本大,CRISPR 显著降低成本,提高产能,所以对于自免这种大适应症且还是双靶向的复杂编辑采用CRISPR/Cas9技术更合适。
结论和思考
l 采用同样的技术,Cellectis最大的意义是技术的源头,而Allogene Therapeutics则是踩在其巨人的肩上进一步对产品的完善,这也是吉利德和辉瑞背景的加持,确实对药物的理解能力比普通企业更强,主要的两款核心产品均有值得重点关注的上市可能性。
l 两款核心产品进一步验证了,通用型CAR-T迭代进一步敲除β2M或HLA等进行多基因编辑,做到消除免疫排异等安全性的提升似乎意义有限。
l 后续产品的技术变化可以看出,对于大适应症如自免,或者更复杂的编辑需求,TALEN的成本和难度问题会是其天然的缺陷,所以有侧重且同级别的CRISPR/Cas9技术会是真正的主流。
l 其市值3亿美元似乎确实存在低估。
Caribou Biosciences(驯鹿)
因为Cellectis的TALEN®(转录激活因子样效应物核酸酶)基因编辑技术起步更早,所以现阶段最有数据的大多是该技术的药物,但实际运用最广泛的CRISPR/Cas9技术也是可圈可点的,连Allogene Therapeutics后续也开始使用。另外比如Caribou Biosciences公司采用的就是CRISPR/Cas9技术,在2011年,由CRISPR先驱、诺贝尔奖获得者Jennifer Doudna博士与Martin Jinek、Rachel Haurwitz (现任 CEO) 和James Berger共同创立。
技术特点:
Caribou Biosciences公司还是CRISPR 基因编辑领域的通用型CAR-T领导者,并且对CRISPR/Cas9技术有自己的优化与规避,基于CRISPR/Cas9技术相比于TALEN技术的精准编辑不足的痛点,通过在CRISPR引导序列中融合RNA和DNA,与非目标位点的亲和力大幅降低,实现更高的基因组编辑精度和特异性,也叫chRDNA技术。
同时,Caribou Biosciences公司采用的是第二代通用型CAR-T,通过敲除B2M等编辑进一步增加安全性,或许通过Cellectis和Allogene的产品临床显示第一代通用型CAR-T可能在安全性上已经够了,但在编辑技术更简单且低成本的情况下,进一步的敲除PD-1也能显著减少CAR-T细胞耗竭,延长体内抗肿瘤活性。
辉瑞投资:
Caribou Biosciences有MNC辉瑞的投资布局,在辉瑞将Cellectis的权益交给其与吉利德的关联公司Allogene后,进一步投资了Caribou Biosciences,于2023年6月29日签订协议,6月30日完成交易,投资金额2500万美元,以每股5.33美元价格购买4690431股普通股,约占约其7.1%-7.64%,同时辉瑞研发高管Sriram Krishnaswami博士加入Caribou科学顾问委员会。
这说明辉瑞考虑两条路线的差异与早期临床的失败,同时布局降低单一技术路线风险,但其直接与间接的区别可能显示辉瑞认为优化版的CRISPR/Cas9技术会比TALEN技术更具发展潜力。
产品:
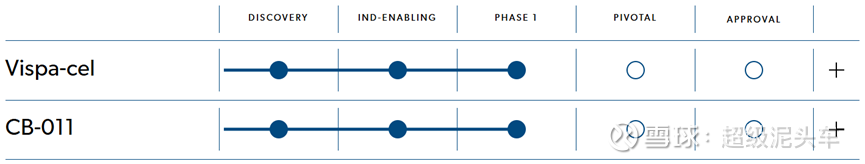
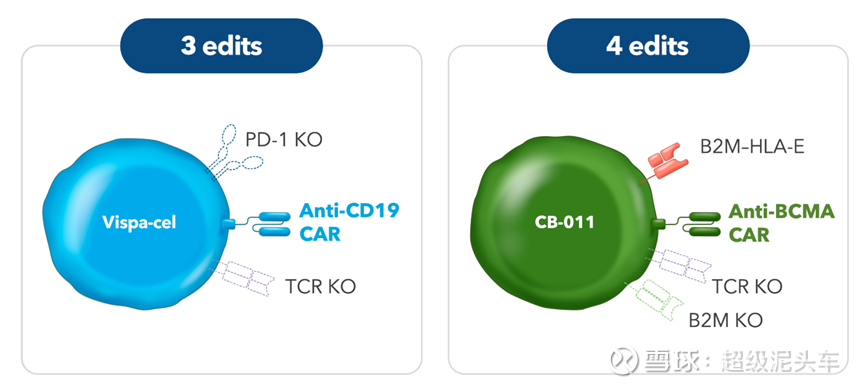
Vispa-cel(临床1期)
基本信息:
l 该药物是CD19靶点,适应症为复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)患者。
l 获得FDA的再生医学高级治疗(RMAT)、快速通道、孤儿药认定。
l 技术上采用CRISPR/Cas9技术,敲除TRAC基因和PD-1基因,再增加CD19靶向的CAR。
l 技术上存在一个反逻辑的地方,敲除CD52再配合CD52单抗深度清淋是为了重置免疫,使得宿主T细胞的TCR识别CAR-T表面的非己MHC分子从而产生异体移植排斥反应的问题得以解决。但是该通用CAR-T未敲除CD52,所以不能用CD52抗体清淋,此时虽然清淋,但不算是深度的,其还是存在潜在的免疫排异风险,且无敲除B2M来避免。
临床结果:
l 将其1期临床ANTLER实验(N=22+35)2025.11.3数据和其他同靶点同适应症的自体CAR-T进行对比,数据如下,疗效确实做到了非劣。
l 安全性方面除了血液相关的为:零GvHD(移植物抗宿主病)、<5%患者出现≥3级CRS、无≥3级ICANS(免疫效应细胞相关神经毒性综合征)、感染和长期血细胞减少可控。

成功分析:
l 不敲除CD52而不用CD52抗体深度清淋重置免疫,也无敲除B2M来避免,临床结果看似乎对免疫排异风险的影响不大,且57例样本的可靠性也不算差,预计该药有一些其他未直接说明的方案优化如配合免疫抑制剂等,但是其核心目的是防止深度清淋的损伤。
l 其下一代产品CB-011的思路倒是B2M敲除后插入B2M-HLA-E策略,相当于直接避免了宿主T细胞的TCR识别CAR-T表面的非己MHC分子从而产生异体移植排斥反应的问题,且无需CD52,这也说明公司核心目的是防止深度清淋的损伤是不变的,且不敲除CD52确实还是存在潜在风险,否则不会对后续的CB-011进行复杂的优化。
l 敲除PD-1的第二代通用型CAR-T的思路确实和第一代通用型CAR-T比其安全性提升的影响不大,但对通用型CAR-T的持续性影响还是较大的,从12个月PFS看,其实已经很接近自体CAR-T了。
CB-011(临床1期)
基本信息:
l 该药物是BCMA靶点,适应症为复发或难治性多发性骨髓瘤(r/r MM)患者。
l 获得FDA的快速通道、孤儿药认定。
l 技术上采用CRISPR/Cas9技术,敲除TRAC基因、插入BCMA靶向CAR、B2M基因敲除(消除所有HLA-I类分子表达,使CAR-T无法被T细胞识别,避免了CD52的使用)、B2M-HLA-E 融合基因插入(防止NK细胞无差别攻击不含HLA分子的细胞)。
l 技术上来说是对Vispa-cel潜在的免疫排异风险的避免。
临床结果:
l 将其1期临床CaMMouflage 试验(N=30,截至2025.9已有12名患者数据)2025.11.3和同靶点同适应症自体CAR-T产品的3L临床比较,数据如下:

l 疗效上甚至可以超过普通自体CAR-T产品Ide-cel达到BIC药物Carvykti的水平。
l 持续性上数据不足,但可能不如普通自体CAR-T产品,也表现不如Vispa-cel的持久,或许一方面还是缺乏PD-1的敲除的原因;另一方面是多重基因编辑可能干扰细胞代谢和能量供应,缩短CAR-T寿命,影响长期存活,且增殖潜力受限。
l 下图则是安全性数据,自体CAR-T安全性再次验证不如通用型CAR-T。

结论和思考
l Caribou Biosciences公司确实体现出了CRISPR/Cas9技术在多基因编辑上的优势,与Allogene对ALLO-329的技术转化的逻辑一致,CRISPR/Cas9技术(特别是其优化版本)确实值得称为基因编辑技术历史和通用型CAR-T历史的里程碑。
l Vispa-cel和CB-011两款产品来看,虽然第一代通用型CAR-T的安全性也没问题,但是第二代通用型CAR-T的持续性更好,至少用敲除B2M替代敲除CD52是更安全的,说明迭代还是有意义的,TALEN技术迭代不积极确实是其虽然能做多基因编辑但难度和成本太大不合算。
l 不过第二代通用型CAR-T的持续性也需要看具体的基因编辑内容,PD-1剔除的Vispa-cel直追普通CAR-T,CB-011则是疗效更好且理论上更安全,但是持续性倒退。这不止和敲除的内容有关,也和更多重的基因编辑可能干扰细胞代谢和能量供应,缩短CAR-T寿命,影响长期存活,且增殖潜力受限有关。
l 或许通用型CAR-T的优化中,编辑太多对所有东西都防患于未然不是好事,重要的是编辑的合适,当然未来添加IL-15装甲等方案的思路力大砖飞也行,但是其成本和难度还有毒性则又不一样了。
l 总体来说,通用型CAR-T的迭代也是需要疗效、经济、安全、持续平衡的,不是越迭代越好。
l 清淋是个很有预期差需要具体问题具体分析的东西,普通CAR-T的清淋只是给CAR-T的增殖腾出空间;通用型CAR-T的清淋(含CD52抗体)是为了深度清除免疫细胞使得免疫重塑时避免排异;但Caribou Biosciences放弃深度清淋是因为防止其对人体以及后续CAR-T的损害影响持续效果;而Allogene Therapeutics的ALLO-316通过深度清淋也避免了免疫抑制,给部分实体瘤CAR-T一个新的方向。
其他MNC对通用型CAR-T的布局
阿斯利康(收购亘喜生物)
2023年12月26日宣布,2024年2月22日完成,约12亿美元现金,成为首家被跨国药企全资收购的中国Biotech,其最主要的平台为FasTCAR自体CAR-T次日生产技术平台与TruUCAR通用型CAR-T平台,且有完整的生产线,对阿斯利康来说,获取从自体到异体的全套CAR-T技术,弥补领域空白。
技术:
FasTCAR自体CAR-T次日生产技术平台(简单介绍):
l 传统CAR-T生产流程需要T细胞采集→激活(1-3天)→转导(1-2天)→体外扩增(7-14天)→收获(1-2天)。
l FasTCAR技术将三大核心步骤(激活、转导、扩增)整合为一个同步激活-转导的步骤且无需扩增,该步骤仅需1天。
l 核心是使用亘喜专有的XLenti病毒载体,该载体表面修饰有CD3/CD28双特异性抗体可先完成激活步骤,再直接转导,无需额外步骤,同时其转导效率达传统方法的2-3倍,减少了体外操作,且该载体同时转入高亲和力IL-2受体基因,使T细胞表达高亲和力IL-2受体让其敏感性更强,干细胞记忆型T细胞(TSCM)比例更高,从而使得细胞状态更年轻,体内增殖能力更强,无需体外扩增,仅需少量体内扩增即可。
l 核心自体CAR-T产品AZD0120 (BCMA/CD19 双靶点)在临床试验中,仅使用传统CAR-T剂量的1/10-1/5即可达到100%的客观缓解率,细胞回输后,体内峰值扩增时间为13天,持续效应可达数月。
TruUCAR通用型CAR-T平台(详细介绍):
l 和其他通用型CAR-T平台比,技术上最大差别是IL-15共表达增加持续性。
l 其他方面,设计上使用CRISPR/Cas9 技术敲除TRAC是通用型CAR-T的入门证;两款主要产品为CD7的CAR-T和CD7/CD19的CAR-T,所以均敲除了CD7基因防止CAR-T的自相残杀,同时靶向CD7除了正常治疗外,也可以清除可能产生排异的T细胞与NK细胞,同时采用芦可替尼预防和管理CRS,所以没敲除CD52靶点也对排异影响不大。
l 普通清淋加CD7杀伤其实也相当于一次接近深度清淋的清淋足够做到免疫系统重建认可CAR-T,然后除了CAR-T的扩增,还有一开始仅占极少部分的CD7阴性的宿主T细胞也扩增并在后续成为免疫主力,从而避免CAR-T对普通免疫细胞的杀伤。
l 双靶点的CAR-T的串联CAR设计,和两个CAR的设计比激活效果更好。
临床数据(通用型CAR-T)
GC027(CD7 靶向通用型 CAR-T)vs T-ALL 适应症 CAR-T 产品

CD7单靶点通用型CAR-T,短期看有高于同适应症其他同靶点自体CAR-T的治疗效果和安全性,但是数量太少无说服力,也无长期数据验证持久力。不过从数据看,确实值得期待,有潜力不比同靶点自体CAR-T差。
不过其不是最快进度,Wugen的WU-CART-007是同靶点通用CAR-T中最快的,已经完成了1b/2期,不过疗效和安全上看两者近似,但是持续性理论上不如GC027。
GC502(CD19/CD7 双靶向通用型 CAR-T)vs B-ALL 适应症上市 CAR-T 产品

和ELIANA 研究、ZUMA-3 研究、FELIX 研究进行比较,相比于其他CD19靶点上市的CAR-T产品,疗效取得了非劣,安全性也是明显更佳的,但是依旧是数量太少无说服力,也无长期数据验证持久力。
结论
l FasTCAR自体CAR-T次日生产技术平台有明确的差异化,阿斯利康因为这个平台的可能性更大。
l TruUCAR通用型CAR-T平台注重IL-15共表达增加持续性,此外最大的亮点是CD7靶点的使用策略避免了直接的深度清淋对身体和CAR-T的损伤,理论上提高了疗效、安全性、持久性,但这属于策略层面的优秀而不是技术层面的特殊性。
l 但是对阿斯利康来说还是可以快速补齐从自体到异体的全套CAR-T技术,弥补领域空白。
l 再次验证了通用型CAR-T安全性发展到了明确超越普通CAR-T,疗效也能做到理论上非劣,就是持久性这一之前的硬伤,虽然有各种方案优化,但还是需要进一步验证和完善。
罗氏(收购Poseida)
2024年11月26日宣布,2025年1月8日正式完成,每股9美元现金(约10亿美元股权价值),加上或有价值权(CVR)(最高每股4美元),总交易价值高达15亿美元。通过Blue Giant Acquisition Corp.与Poseida合并,无需股东投票,Poseida成为罗氏全资子公司,从纳斯达克退市。
技术:
l 非病毒基因编辑平台:独家开发的Cas-CLOVER技术,精准度高、脱靶率低(<1%),优于传统CRISPR/Cas9。但其实也是与驯鹿的chRDNA技术一样,均属于CRISPR/Cas9的技术优化版,它借鉴了TALEN技术的核心二聚体切割原理,同时融合了CRISPR的RNA引导优势。
l Cas-CLOVER技术说明CRISPR/Cas9是基石地位,TALEN也是重要技术,但均有缺陷可优化,也有专利需规避。
l 干细胞记忆T细胞(Tscm)技术:产生长效记忆性T细胞,延长治疗效果持续时间这和敲除PD-1这样增加持续性的方案比更加根源。
l Tscm是比普通记忆T细胞更具有持久记忆的细胞,可不断分化产生效应T细胞和记忆 T 细胞,形成完整免疫应答网络。高表达抗凋亡蛋白,抵抗肿瘤微环境抑制,维持长期抗肿瘤活性。
l DOI: 10.1002/ctm2.70264的文献和我之前实际的工作均显示CAR-T 产品中 Tscm 比例与患者无进展生存期 (PFS) 和总生存期 (OS) 呈正相关。
l 做到这一步的原因是其piggyBac非病毒载体系统优先感染原始T细胞和Tscm细胞,且避免传统载体的过度激活,同时特殊培养条件(IL-7+IL-15 组合)促进Tscm增殖,抑制效应分化(和普通CAR-T在激活T细胞中编辑不同),使得最终产品中 Tscm 比例可达30-40%(传统 CAR-T<10%),理论上显著提升持久性。
产品介绍
敲除TRAC+B2M,因为敲除B2M而不存在MHC,从而避免 GVHD 和宿主排斥,实际相当于第二代通用型CAR-T。

整体来看较为成熟,P-MUC1C-ALLO1太早期暂时不看,P-CD19CD20-ALLO1虽然有血液瘤和自免适应症均布局,但血液瘤的临床1期都尚未完成,所以也不评价,主要看获FDA孤儿药/RMAT认定的1b期的P-BCMA-ALLO1。
临床数据
P-BCMA-ALLO1

同样,依旧是安全性更优、疗效非劣、持久性不如。
结论
l 罗氏看中的是该公司的技术,基因编辑技术和转入技术均有明确的差异化。
l 其干细胞记忆T细胞(Tscm)技术的核心是针对通用型CAR-T的持久性问题,因为通用型CAR-T的安全性更高,疗效也能做到稍差或者非劣,最大的瓶颈还是持久性不足。
l 从临床数据看,和自体同靶点CAR-T比,确实也是安全性更高,疗效非劣,持久性还是缺乏进一步数据,但现有数据看,预计虽然提升,不过还是会劣于自体同靶点CAR-T的表现。
l 持久性还是需要更多的研究优化,但其本身的疗效与安全足够算一种新疗法,同时也和现有疗法不冲突,不存在TCE和自体CAR-T之间冲突的情况,所以确实也值得再开一线,同时以P-BCMA-ALLO1为例,可用于PCMA耐药的情况,即T细胞耗竭依旧可用,再次验证了之前的判断,通用型CAR-T的核心价值(除了成本外)是对T细胞无要求的增加一道线的治疗方案。
Wugen、科济、传奇
Wugen是除上面研究外讨论较多的公司,科济则是港股能直接投资且国内技术领先的公司、传奇则是早期和强生合作且积累丰富的公司。
技术
Wugen:
技术上看,Wugen是普通的CRISPR/Cas9基因编辑技术,靶点选择是CD7靶点,和阿斯利康收购的亘喜生物的GC027(CD7 靶向通用型 CAR-T)一样且进度更快属于FIC,不过进一步增加了敲除B2M但是初步看疗效与安全两者几乎无差异。
无差异很好理解,敲除B2M是为了在没有深度清淋的情况下防止宿主T细胞攻击CAR-T,但是GC027可以显示出其CD7靶点的免疫细胞清除能力和CD7阴性宿主T细胞后续的扩增并配合芦可替尼使用,可以使免疫系统重建适应CD7,所以无需敲除B2M。
不过WU-CART-007的敲除更彻底,为了防止一个对CD7靶点通用CAR-T来说理论上影响不大的敌人,而进一步损伤CAR-T,同时β2M 维持 NK 抑制信号也受到影响,还没有亘喜生物的的IL-15共表达,预计持续性上还是阿斯利康收购的亘喜生物的GC027的会更好一些。
科济:
技术上看,科济的基因编辑也是普通的CRISPR/Cas9基因编辑技术,但是相比普通二代通用CAR-T,其增加了敲除NKG2A再表达NKG2A-CAR的步骤。
敲除B2M是为了在没有深度清淋的情况下防止宿主T细胞攻击CAR-T,敲除TRAC是防止CAR-T攻击宿主,而敲除NKG2A再表达NKG2A-CAR是独特的。
NKG2A是T细胞表面的抑制性受体,与HLA-E结合后降低T细胞杀伤活性,敲除NKG2A使CAR-T细胞摆脱自身抑制,增强抗肿瘤杀伤力,动物实验显示其IFN-γ分泌和肿瘤杀伤能力显著提升2-3倍,且有利于肿瘤微环境中起效。所以敲除NKG2A类似于敲除PD-1一样可增加杀伤和持续性。
再转入NKG2A-CAR,这是一种特殊设计的CAR 结构,其抗原结合域靶向NK细胞表面的NKG2A蛋白,当NK细胞试图攻击CAR-T时,NKG2A-CAR识别NK细胞表面NKG2A,触发CAR-T的杀伤机制反杀NK细胞。
总体来说,通过敲除NKG2A再表达NKG2A-CAR的步骤,进一步对疗效和持续性都得到了多重的提升。该思路非常优秀且方向契合MNC的整体行业大方向,值得通过进一步实验数据验证。
传奇:
重点不是双靶点,而是采用非基因编辑技术,通过非敲除,而是沉默技术使得TCR无法成型,达到TRAC敲除相同的效果,但少了敲除只有插入,也是更安全。
采用γδT细胞,天然低表达MHC分子,免疫原性更低,减少宿主排斥风险,达到B2M敲除的相同效果,也更安全;同时该细胞具有固有抗肿瘤活性,可直接杀伤肿瘤细胞,对实体瘤微环境的耐受性更强,更有潜力。
传奇的技术具有明确的差异化,虽然进度还早,但也值得进一步跟踪确认。不过也有潜在的缺陷:比如γδT细胞的量少,体外培养困难,异质性高产品一致性难以保证,并且更易耗竭,细胞因子分泌也不稳定;而且TCR沉默有可能随后续失效,进一步使得产生对宿主的攻击。
所以其疗效、持续性、安全性以及成本和CMC均因为γδT细胞和TCR沉默的技术而面临不确定性,虽然技术具有明确的差异化,但风险还是很大,需要谨慎的进一步跟踪,并可以持一定期待。
临床
基于对各大MNC的分析,我们明显可以发现科济和传奇的技术存在明确的差异化,将两者核心产品数据进行整理。
科济(CT0596):
BCMA靶点,仅有8位患者数据,数据可靠性极低,但还是需要和其他自体CAR-T的临床数据进行对比。
其他同靶点同适应症自体CAR-T数据如下:
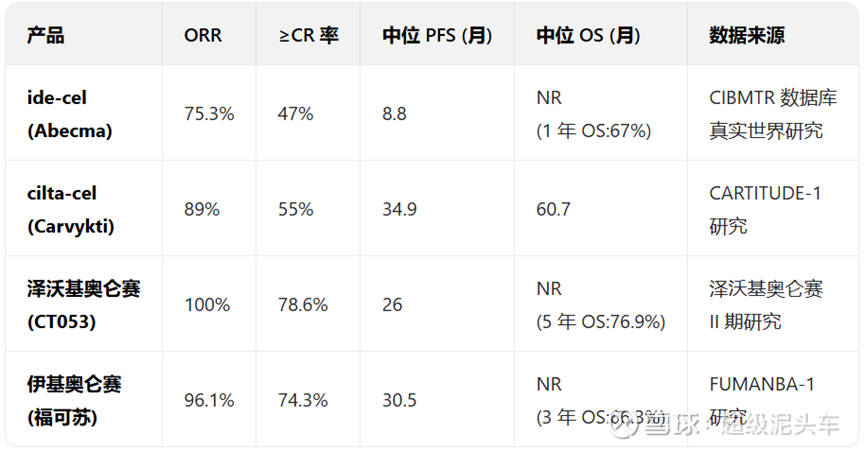
与CT0596对比如下:
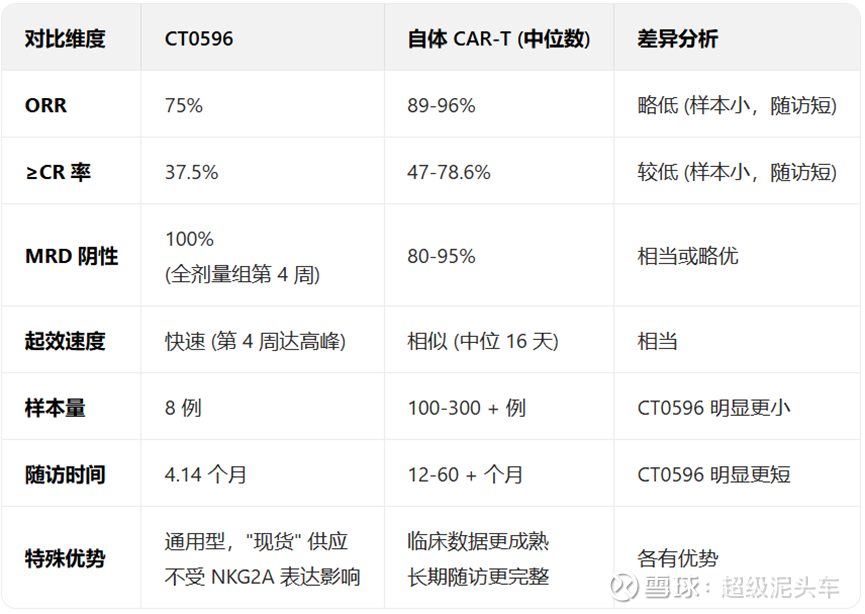
安全性上来说和以往的通用型CAR-T一样极高,细胞因子释放综合征 (CRS)发生率可控,无≥3 级 ICANS 报告;血液学毒性属于常见问题,经支持治疗可恢复;未观察到显著器官毒性。
虽然样本量小,但疗效上来说似乎显示了非劣于自体CAR-T的效果,在意料之中;而持续性虽然无法判断,但是MRD阴性率的较高,说明了如果其后适当的续避免耗竭,确实有潜力获得接近自体CAR-T的长期持续性,甚至达临床治愈。值得进一步观察与验证。
注:IMWG 2024 年荟萃分析显示,MRD⁻患者的3年复发风险比MRD⁺患者降低60%-70%,5年OS率提升35%-40%。
传奇(LUCAR-G39D):
对16例复发/难治性B细胞NHL患者,覆盖多种亚型,接受5个不同剂量水平(DL1-DL5) 治疗,未尝试最高剂量,中位随访时间6.1个月。

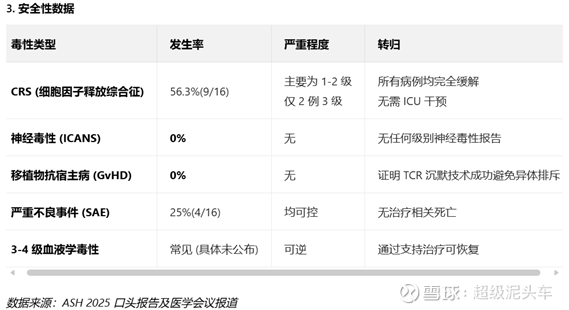
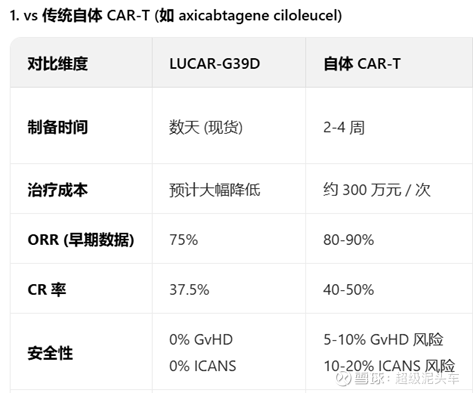
经过整理,传奇的技术在疗效和安全性均符合预期,是比自体CAR-T来说,更高的安全性和接近的疗效。
不过持续性依旧无法验证,且传奇的技术步子迈得太大,又存在潜在的风险,需要更长期数据验证持续性和长期安全性。需要谨慎的进一步跟踪,并可以持一定期待。
超过最大字数,后续内容以图片展示:




