天坛生物云南昆明血制产品审批情况及投资随想
最近发现很多股友对这家企业有很大怨气,无端攻击,我一个小散花费大量时间免费分享自己的一点研究看法,惹了谁?写了几点友情提示:
1、不认同价投的股友就别浪费时间了,请绕行!
2、这只股票上亏了钱的股友也别生气埋怨了,没有任何意义,既对自己身体不好,影响心情,这种负面情绪又对自己的朋友亲人非常不友善,没有谁愿意整天面对一个充满负能量的人。这支股票不套人啊,您亏损主要原因还是您自己认知不够,买在了价格高于价值的位置,没有留够安全边际。我自己对套牢的股票就两种操作,基本逻辑没有变的,在不影响基本生活的前提下想尽一切办法找钱分批加仓(最不可取的就是在有加仓资金的前提下持股不动,苦等解套),如果基本逻辑发生变化或者根本就搞不懂这家企业,立马就止损,很赞成大道的一句话,发现错误马上就改正的代价是最小的!
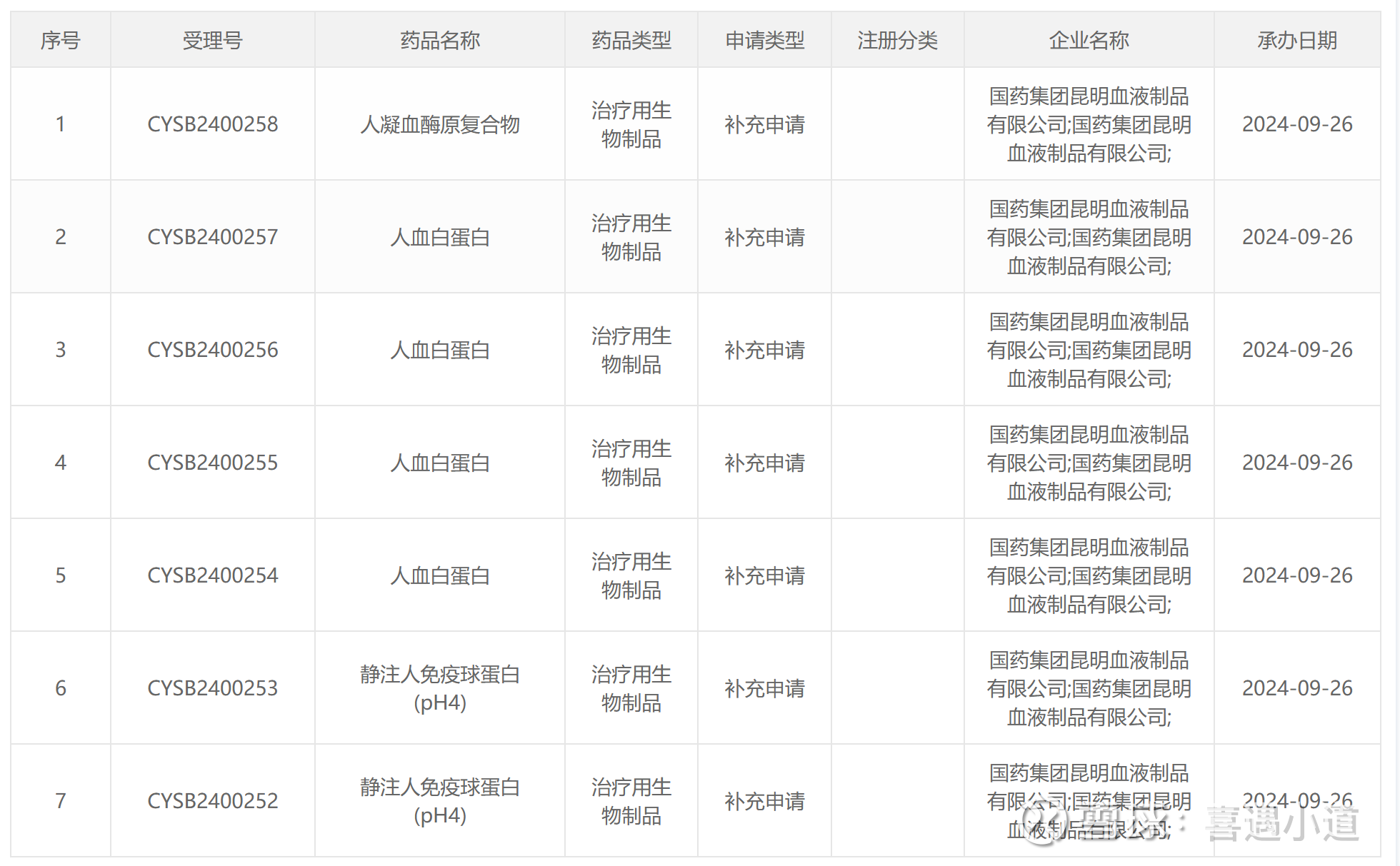
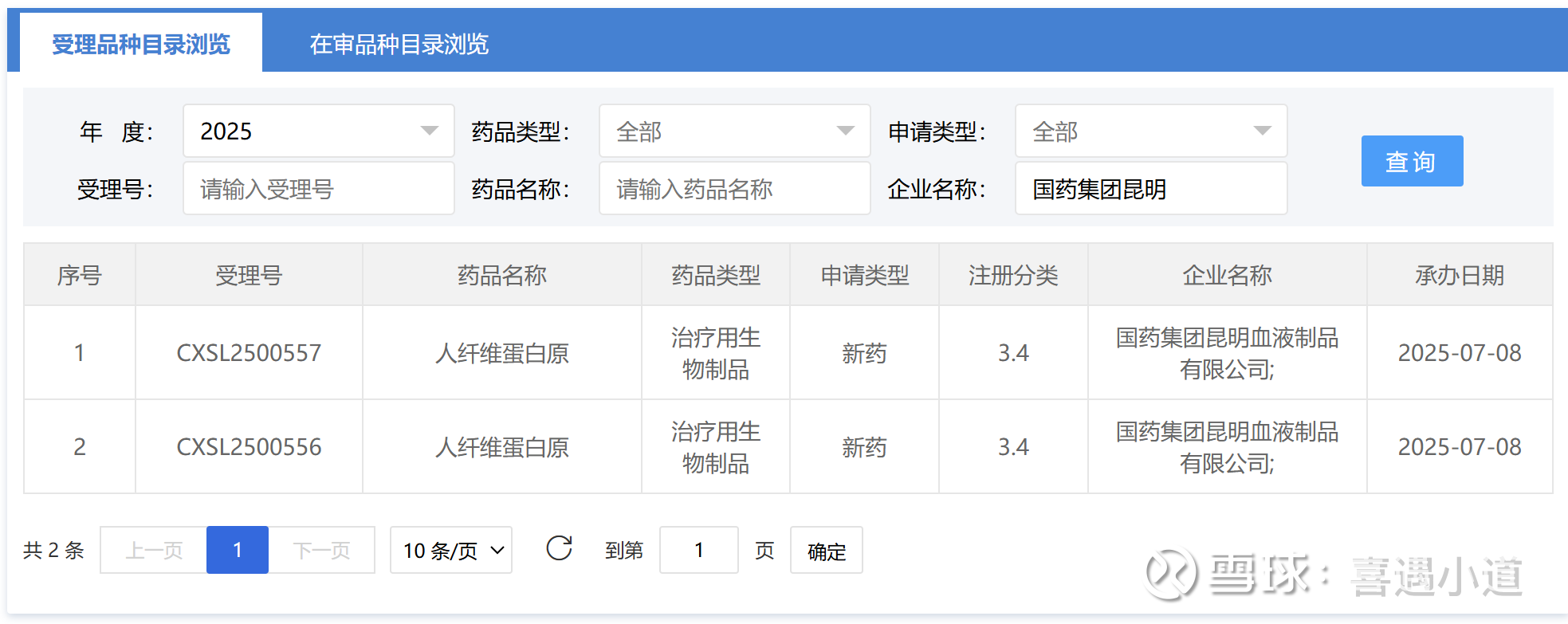
昆明血制三大类9个规格产品在国家药监局申请审评,其中7个产品是补充申请,我逐一查询发现没有一个产品在审评任务公示栏能查询到,这很可能意味着这些补充申请的产品都已经完成审评,就等批文了,而公司公众号文章显示计划2026年投产,如图:

这样看来,昆明基地正式投产快的话就在下半年了,最迟明年年初,这个提升业绩的预期因素正在兑现。
按照大道的说法,研究一家公司最主要的就是两个方面:生意模式和企业文化,而这其中企业研发能力也是生意模式中重要一环,以前以为天坛下属各家子公司的研发都是各自为政,重复研发浪费很大,实际上公司研发还是很令人放心的,至少处于行业领先:
1、2018年1月,国药天坛研发中心(简称“研发中心”)正式成立,统筹开展公司及下属企业的研发工作。研发中心通过建立完善的组织机构,整合研发技术和人才资源,构建了较为完善的血液制品科研创新体系。
2、国药天坛秉持自主创新与协同创新并重的理念,整合旗下各子公司研发团队和相关资源,在统筹研发管理、提升研发效率上下功夫。
3、产品开发方面,统筹布局研发品种,加快研发进度;加强对标研究,深化产学研合作,持续提升产品临床、质量和产业化水平。
4、临床运营方面,建立多维度质量控制体系,保障临床试验的进度和质量;对临床有效性和安全性数据进行持续的跟踪和分析,为临床决策提供坚实的数据支撑。
5、注册管理方面,注册团队与研究团队紧密合作,对产品开发全流程合理规划,对技术层面精准把控,对审评流程科学管理,有力推动产品研发注册各阶段工作稳步前行。
最后再来谈谈行业政策问题,国内清华大学、国家药监局和天坛等共同写了一篇论文《提升血液制品生产效率的模式优化策略》,我就直接摘抄最后结论建议:
1、探索血浆冷沉淀和中间组分的常规调拨 《中华人民共和国药品管理法》(2019年修订)规定,血液制品等不得委托生产,国家药品监督管理部门另有规定的除外。在当前血液制品供应短缺、微量蛋白等血液制品品种匮乏的大背景下,应当探索允许符合条件的企业采用冷沉淀调拨或者中间组分转移的方式提高血液制品的生产效率。 探索血浆和血浆分离组分在符合条件的企业场地集中分离后转移至下游生产场地。由药品上市许可持有人根据血液制品的需求,统筹原料血浆分配,在部分具备血浆分离能力的场地集中开展原料血浆的冷沉淀、组分分离纯化工艺,并将冷沉淀、分离组分等转移到特定血液制品生产场地用于制品的后续生产。对于已经上市的血液制品,应当按照国家药品监督管理局药品审评机构的要求,提出特定血液制品使用调拨冷沉淀或者中间组分的变更申请。
2、实现集团内血液制品品种优化
按照品种、质量标准、生产工艺相似性,对血液制品上市许可持有人的品种和批准文号进行归类,原则上相同品种保留注册标准最高的品种批件,减少批准文号数量。由药品上市许可持有人准备变更方案、中间产品分离及转移方案、最终血液制品生产场地分配方案、生产场地变更的补充申请文件,一并提交药品审评机构审评。
3、预留血浆资源加快研发新型血液制品 在允许冷沉淀调拨或者血浆组分转移的情况下,药品上市许可持有人的单采血浆分离后的微量血浆组分可以汇集在一起,根据研发新型血液制品所需组分,预留一部分血浆资源和分离组分开展新型血液制品研发,特别是国内临床亟需的罕见病血液制品研发填补国内空白。
结论:这些建议政策如果能兑现实施,作为龙头的天坛无疑是最受益的,生产管理效率和效益将大幅提高,而我更关注到的是这篇论文不但有最顶级的院校清华大学和国内这个行业龙头天坛生物、蓉生参与,还有行业管理部门国家药监局参与,至少说明从上至下高层已经注意到血液制品行业存在效率低下、法律法规已经跟不上行业发展需求这个问题了,作为一名多年的法治工作者,感觉管理部门根据血液制品行业实际情况和发展需要修改、完善相关法律法规应该不远了。如果这一天到来,这才是行业真正的大利好!
如果觉得好,请随手点赞!