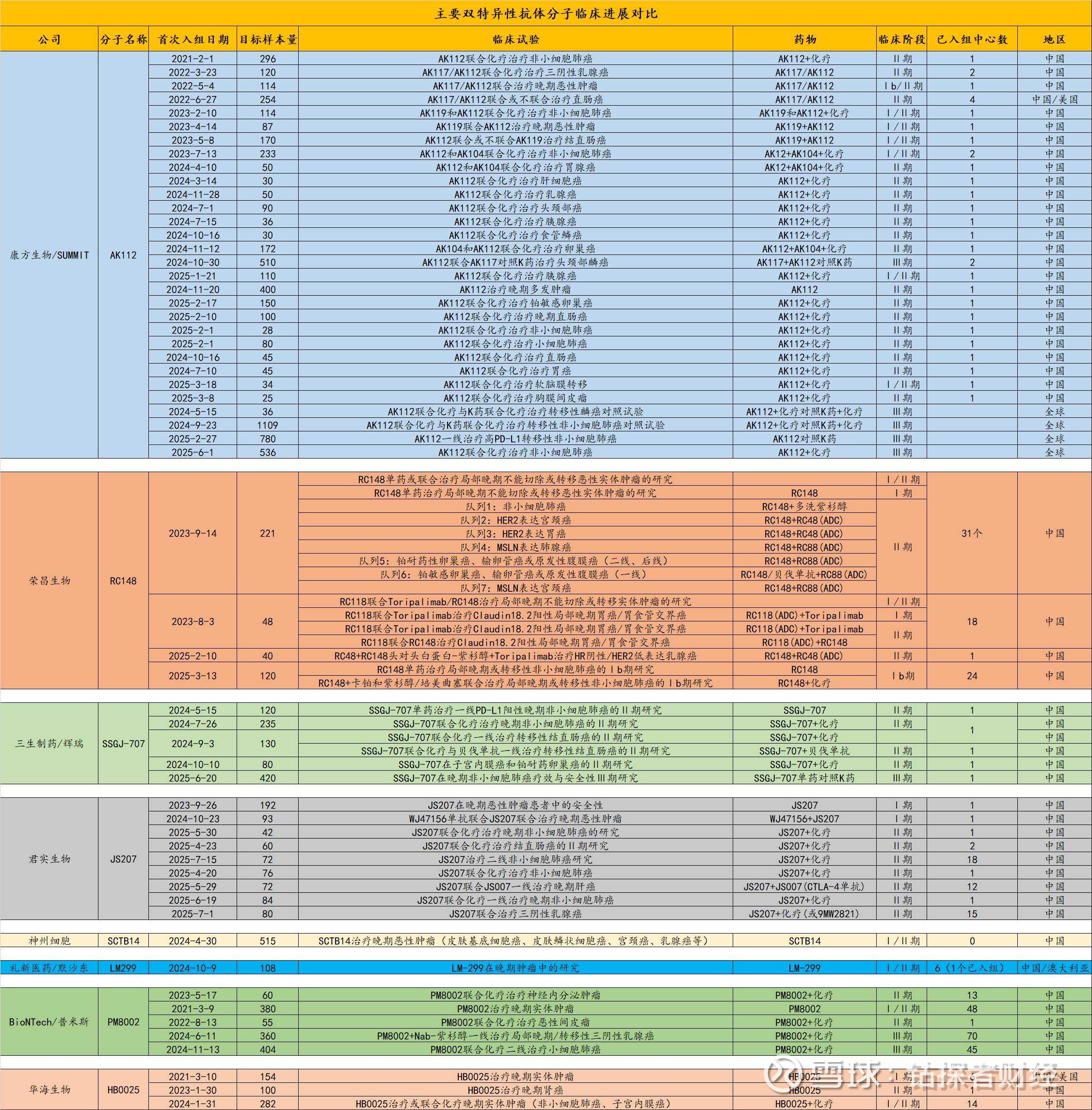
荣昌生物RC148连续密集出现利好消息
一、8月8日,荣昌生物原研的新型双特异性抗体RC148获得美国食品药品监督管理局(FDA)新药临床试验(IND)许可,在美国开展针对多种晚期恶性实体肿瘤的Ⅱ期临床研究。
这说明了RC148基于中国Ⅰ/Ⅱ期研究积累了剂量、安全性及联合治疗方案的关键数据,并且数据很好,FDA认可其疗效数据,因此批准直接启动Ⅱ期临床。
RC148国际化进度领先,是全球第二个获批FDA二期的PD-1/VEGF双抗,第一个是康方AK112。
此前辉瑞购买的SSGJ-707与默沙东购买的LM299均仅获得的是美国FDA的一期许可。
另外获批FDA二期的还有普米斯的PM8002,那是PD-L1/VEGF,靶点不同。
二、8月11日,CDE官网显示,荣昌生物RC148注射液拟纳入突破性疗法品种,联合多西他赛治疗经PD-1/PD-L1抑制剂和含铂化疗(联合或序贯)治疗失败的驱动基因阴性局部晚期或转移性非小细胞肺癌受试者。
仅仅隔了一个周末,国内获批突破性疗法。
根据药监局《突破性治疗药物审评工作程序》,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。
药物临床试验期间,申请适用突破性治疗药物程序的,应当同时满足以下条件:
……
与现有治疗手段相比,该药物具有更显著或者更重要的治疗效果(如:该药物治疗可获得完全应答,而现有治疗仅可获得部分应答;或者该药物治疗对比现有治疗可显著提高应答率,该应答率的提高具有重要临床意义)。
……
现有治疗手段是指在境内已批准用于治疗相同疾病的药品,或者标准治疗方法(药械组合治疗等)。通常,这些治疗手段应为当前标准治疗。附条件批准上市的药品,在临床获益未经证实前不作为现有治疗手段。
考虑到AK112已获批单药一线治疗PD-L1阳性非小细胞肺癌,可以推测RC148的一期数据有显著的治疗效果。
RC148国内国际临床进度靠前,IO双抗+ADC联用进度第一,已开启美国二期临床迈入国际化进程,已获得CDE纳入突破性疗法认定,疗效数据获得监管机构背书。
对于PD-1/VEGF,全世界药企蜂拥而动,AK112前有K药+ADC联合疗法誓死抵抗,后有新双抗快速追击,如果刻舟求剑认为AK112要像K药一样,独占绝大部分市场,是不现实的。
既然还有很大部分市场,荣昌生物RC148将是最有可能吃到大肉的分子。
$荣昌生物(09995)$ $荣昌生物(SH688331)$ $Vor Biopharma(VOR)$