DCR 达 100%,首款无预处理通用 CAR-NK 潜力迸发,门诊 CAR-T/NK 将「出线」

免费早鸟票,200 张限量领取
2026 年 1 月 23 日
医麦客新闻 eMedClub News
近期,ImmunityBio 公布了一项关于 QUILT-106 的临床试验的最新疗效与安全性数据,该试验旨在评估一款同种异体 CD19 CAR-NK 疗法联合利妥昔单抗治疗华氏巨球蛋白血症的疗效和安全性。

该公司的 CD19 CAR-NK 搭载了高亲和力 CD16 受体(即 FcγRIIIa 158V),具有双重抗肿瘤机制:一方面通过 CAR 介导的细胞毒性作用直接杀伤肿瘤细胞;另一方面与抗 CD20 抗体利妥昔单抗联用时,可增强抗体依赖性细胞介导的细胞毒性作用。因此,当二者联用时,可实现对 CD19/CD20 淋巴瘤细胞的靶向杀伤,进而提升肿瘤细胞清除效率。
数据显示,已经有 4 名患者入组,实现 100% 疾病控制率(DCR)。其中,2 名患者目前正在接受长期随访评估,分别在治疗结束后 7 个月和 15 个月时仍保持完全缓解(CR),无需进一步治疗。这两名患者在基线时病情均较为严重,其中一名患者的骨髓受累范围约为 95%,另一名患者存在多发性淋巴瘤骨病灶,但仅经过四剂治疗后即达到缓解。
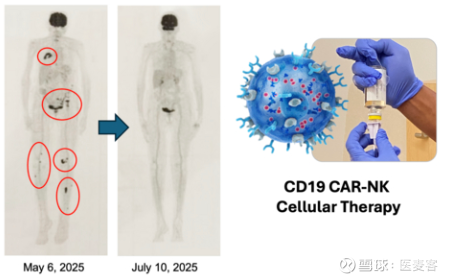
▲ 图片来源:官网
值得一提的是,据 ImmunityBio 新闻稿称,这是首款无需化疗、无需淋巴细胞清除预处理的 CAR-NK 细胞疗法,并且 ImmunityBio 还手握一款已经获批上市的 IL-15 超级激动剂 Anktiva,其能够有效刺激和扩增 NK 细胞,能够与 CD19 CAR-NK 管线形成协同优势。
ImmunityBio 创始人、执行主席兼全球首席医疗与科学官 Patrick Soon-Shiong 表示:“这次更新的后续进一步验证了恢复和激活免疫系统可以在不使用化疗或淋巴细胞耗尽的情况下实现持久的疾病控制。在已用尽可用治疗方案的患者中,治疗停止后一年内仍能持续完全缓解,这对罕见的华氏巨球蛋白血症患者来说是一项有意义的进展,也验证了 CAR-NK 作为潜在下一代免疫治疗平台的潜力。”
门诊细胞疗法
ImmunityBio 的 QUILT-106 试验成果,不仅为复发难治性华氏巨球蛋白血症患者带来了潜在治疗手段,更以 「无需化疗、无需淋巴细胞清除预处理」 的突破性特征,颠覆了传统细胞疗法的治疗范式,推动细胞疗法向「门诊可及」的模式转变。而目前,这也是细胞疗法发展的一大趋势,已经有多家企业进行了探索。
CAR-NK/NK
Artiva Biotherapeutics 开发了一款脐带血来源、同种异体、冷冻保存、非转基因、ADCC 增强的 NK 细胞治疗候选药物 AB-101(AlloNK),可在门诊与单克隆抗体或先天细胞接合剂联合使用,针对自身免疫性疾病。
该候选管线早在 2023 年即获得 FDA 批准开展临床,是同种异体 NK 细胞疗法首次用于治疗自身免疫性疾病。目前,其正在进行 II 期篮式试验,涵盖类风湿关节炎、干燥综合征、特发性炎症性肌病和系统性硬化症患者。
在 2025 年的 ASGCT 第 28 届年会上,Artiva 公布了 AB-101 联合利妥昔单抗在复发/难治性 B 细胞非霍奇金淋巴瘤的 1/2 期临床研究数据:在既往未接受 CAR-T 治疗的 14 名患者中,CR 达到 64%,截止 2025 年 3 月 7 日数据截点,缓解持续时间至少为 19.4 个月,大多数接受治疗的患者维持完全缓解状态。
Artiva 公司首席执行官曾表示,这是目前所有异体细胞治疗中针对重度预处理侵袭性 B 细胞 NHL 患者最具活性和持久性的数据之一,与已批准的部分自体 CAR-T 细胞治疗效果相当。据悉,今年上半年,Artiva 计划将公布 15 例以上难治性类风湿关节炎患者的初步临床反应数据。
CAR-T
相较于门诊 CAR-NK/NK,CAR-T 基于技术积累和迭代,成为门诊细胞疗法竞争的核心阵地之一。 门诊 CAR-NK/NK 的探索多聚焦于异体通用型技术路径,以安全性突破为核心抓手,门诊 CAR-T 的研发则呈现技术路线多元化特征——既有通过基因编辑优化 CAR-T、降低免疫原性与毒副作用以适配门诊场景的方向,也有以体内 CAR-T 为代表的颠覆性技术,实现类似常规药物的门诊静脉输注给药。
上市的 CAR-T 细胞疗法已经在进行门诊可行性的探索,如 Yescarta、Tecartus、Kymriah 等。2025 年,一篇题为「Feasibility of axicabtagene ciloleucel in the outpatient setting: primary analysis of prospective trial」的文章报道了一项单中心非随机开放标签前瞻性临床试验(NCT05108805),评估了利用可穿戴设备和远程医疗,评估门诊使用 Yescarta 治疗复发/难治性弥漫性 B 细胞淋巴瘤(R/R DLBCL)的可行性和安全性。

2021 年 11 月至 2023 年 10 月期间,本研究共入组 25 例患者,实际接受治疗的患者为 20 例,中位随访时间为 374 天。研究中,患者的淋巴细胞清除化疗及 CAR-T 输注均在门诊完成。19 例因 CRS 住院(中位住院 5.5 天,历史住院数据为 15 天),1 年无进展生存率(PFS)和总生存率(OS)分别为 68% 和 74%。研究表明,门诊 Yescarta 管理可行且安全性可控,显著减少住院负担。
在研疗法中,Immix Biopharma 的 NXC-201 是一款靶向 BCMA 的 CAR-T 疗法,拟用于治疗 AL 淀粉样变性。其 CAR 结构经过优化设计,使得 NXC-201 具有高转导率、高持久性、低脱靶率的特点,能够以更低的剂量达到更好的效果,降低由剂量导致的毒性,同时这一候选产品的持久性也得到提升,能够长时间在体内发挥作用,减少细胞耗竭的发生,这些特点也支持患者在门诊中使用。
2025 年 12 月,Immix Biopharma 公布了 NXC-201 治疗复发/难治性轻链型淀粉样变性的 II 期临床试验试验结果:20 例患者中有 15 例达到完全缓解(CR 为 75%),5 例疗效待评估患者中,4 例骨髓微小残留病检测阴性,这一指标预示其后续有望达到完全缓解,或将使该疗法远期完全缓解率提升至 95%。据悉,该公司计划在今年提交 BLA。
另外,Mustang Bio 的 MB-106 是一种全人、第三代、CD20 靶向 CAR-T 细胞疗法,含有 4-1BB 和 CD28 共刺激结构域、改良的 IgG1 间隔区消除了 FcR 结合,可支持通过门诊给药。此前,Mustang Bio 公布的数据显示,MB-106 治疗的华氏巨球蛋白血症(WM)患者的 ORR 高达 90%,其中一位患者持久完全缓解达 31 个月。
总结
过去,传统细胞疗法因需住院严密监测并管理 CRS、ICANS 等严重副作用,既加重了患者经济负担,又导致患者生活质量下降。而门诊细胞疗法的发展,无论是无需化疗预处理的 CAR-NK、经结构优化降低毒性的 CAR-T,还是依托远程监测技术实现风险管控的已上市 CAR-T 门诊探索,都在从技术革新与模式创新双向突破这一困境。
未来,细胞疗法将呈现 「技术多元化、场景泛化、疗效与安全性双提升」 的趋势,同时,有望重构细胞治疗临床服务模式。
责任编辑丨浔
校对丨浔
参考资料:
1.企业官网及公开资料
精彩活动
推荐 1
1 月 29 日 19:00-20:30
TFF 膜包清洁重复验证与新版 PDA TR26 技术报告解读
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:欢迎个人转发文章至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。如需转载请在文章下方留言获取授权。
封面来源网络,如有侵犯版权,请联系删除

点点“分享”、“点赞”和“在看”
给我充点儿电吧~