医药生物系列025:阿尔尼拉姆Cemdisiran最新数据梳理
一个韭菜的醒悟
· 广东
01-事件
2025年8月26日,再生元(Regeneron)宣布Cemdisiran治疗全身型重症肌无力(gMG)的III期NIMBLE研究取得了积极结果。基于此,再生元计划在2026年一季度向FDA递交Cemdisiran的上市申请。
02-用法用量
NIMBLE研究是一项随机、双盲、安慰剂对照临床试验(n=190),评估了Cemdisiran(600mg,每12周1次,皮下注射)单药或Cemdisiran(200mg,每4周1次,皮下注射)。
03-BD
根据新协议,Alnylam 收到 1000 万美元首付款,并在 cemdisiran 单药获批时有机会获得额外付款;此外,如 cemdisiran 作为联合疗法上市销售,Alnylam 最高可获得 3.25 亿美元的商业里程碑付款。
04-适应症
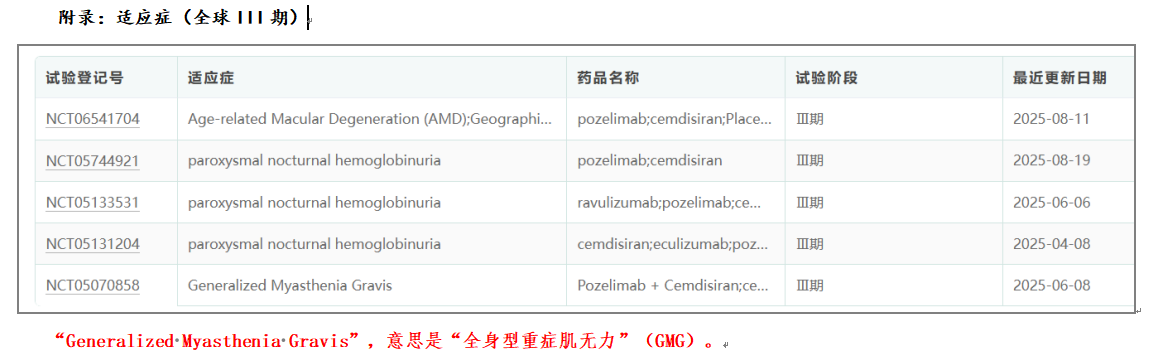
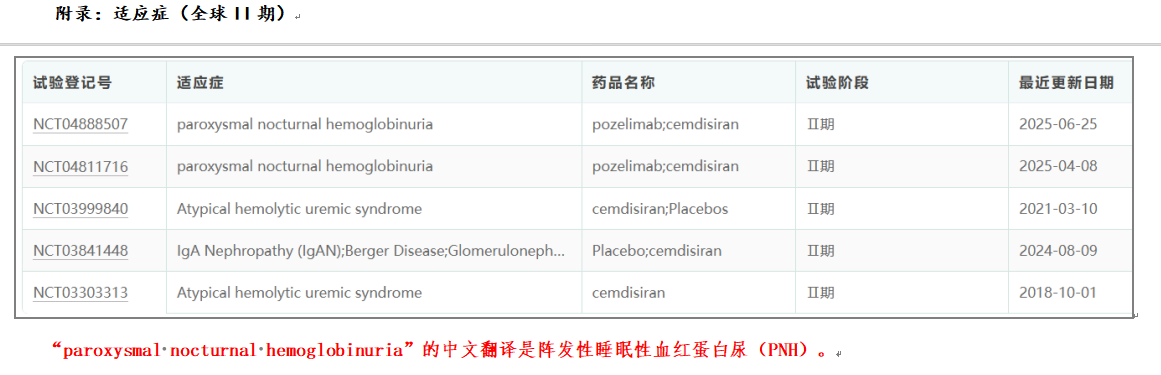
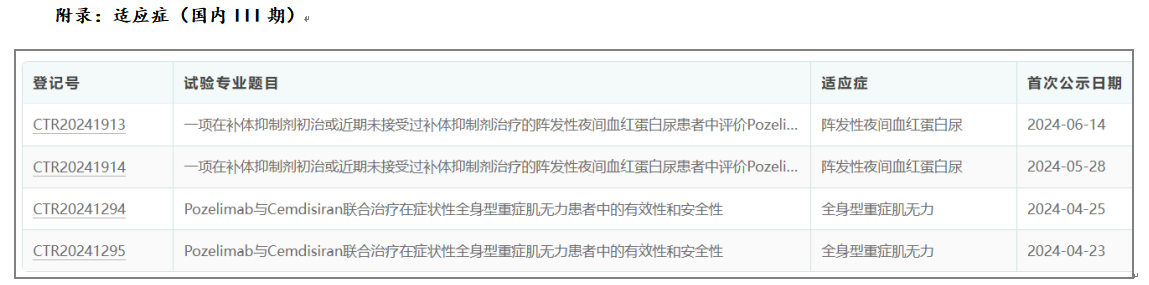
05-临床数据
NIMBLE研究是一项随机、双盲、安慰剂对照临床试验(n
点击查看全文