再鼎-ZL1310-DLL3 ADC
小细胞肺癌美国现状
美国每年新发3万小细胞肺癌(SCLC)患者,分为局限期(1万人)与广泛期(2万人)。局限期(LS):大致对应 TNM 的 I–III 期,疾病范围能被一个可耐受的胸部放疗野完整覆盖。广泛期(ES):超出上述范围或已有远处转移。
SCLC 的独特性:1. TP53 与 RB1 的双等位失活极常见,驱动其高度增殖和转移。2.副肿瘤综合征发生率高:SCLC 更常见 SIADH 低钠(发生率20%左右)与异位 ACTH(库欣)(发生率5%),以及Lambert-Eaton 重症肌无力样综合征(LEMS)上腔静脉综合征(SVCS),都是很难管理的。3.复发快、耐药快。4. 2年脑转移比例超过50%。
局限期(LS-SCLC):同步放化疗:顺铂/卡铂 + 依托泊苷 联合胸部放疗,为标准一线。巩固免疫治疗:度伐利尤单抗 在 cCRT 后无进展患者中获 FDA 于 2024-12-04 批准 用于巩固治疗(ADRIATIC 研究),已写入最新实践更新。免疫巩固时代(ADRIATIC)中位 OS 55.9个月 vs 33.4个月,PFS 16.6个月 vs 9.2个,“出现腔外转移”= 度伐利尤单抗19.7% vs 29.7%,首次进展为脑/中枢:6.8% vs 12.4%。在局限期里,2–5 年内发生远处转移的比例不低(I/II 期约 24–28%,Ⅲ 期约 48–55%)。2 年脑转移累积发生率:Ⅲ期 21% vs I/II 期 10%;总体约 17%。复发后的治疗乏力:二线/复发期疗效与生存有限,复发患者远处转移占多数;系统综述与指南型综述一直把复发 SCLC列为高未满足领域。
广泛期(ES-SCLC):PD-L1 抑制剂 + 铂类 + 依托泊苷 为公认一线标准,写入ASCO 证据指南,诱导期4个周期后停止化疗维持免疫治疗:阿替利珠单抗(Tecentriq) + 铂/依托泊苷(IMpower133)— FDA 2019年批准,初始mOS≈12.3月,5年OS率约12%;度伐利尤单抗(Imfinzi) + 铂/依托泊苷(CASPIAN)— FDA 2020年批准,mOS≈12.9月,3年OS率约17.6%。起诊时真实世界多中心报告脑转移可达 ≈28%,SCLC 诊断后 2 年内中枢神经系统受累可接近 80%。
广泛期疾病进展后的二线及以后(2L/3L+),只有约 20%–42% 的 SCLC 患者能进到二线;也就是说,超过一半在一线后就因为疾病迅速进展、体能变差或毒性累积而无法再承受治疗,一旦进展,窗口很短。按化疗无治疗间隔(CTFI)/复发间隔分层(指南与综述一致):1.<90天或耐药/难治:优选非铂类: – Lurbinectedin(加速批准的单药,ORR≈35%,mOS≈9.3月;但III期ATLANTIS的“联合多柔比星”版本未改善OS)。 – Topotecan(静滴或口服;与CAV疗效相当,较BSC延长生存;典型mOS约6–8月)。– Tarlatamab(Imdelltra):DLL3/CD3双特异T细胞连接剂,2024年获加速批准用于“铂类后进展”的ES-SCLC。分步递增给药(C1D1 1 mg→D8/15 10 mg→此后每2周10 mg),需警惕CRS/ICANS。II期DeLLphi-301 ORR 40%、中位缓解持续9.7月;随访/发布会与综述提示mOS约14–15月;正在进行III期验证。2.≥90天(常用阈值;有处方会把≥6个月视作“敏感”):可重新使用铂类方案(铂类再挑战),或选单药。
DLL3靶点
85% 的 SCLC 肿瘤表达 DLL3,目前进度最快的是Tarlatamab。
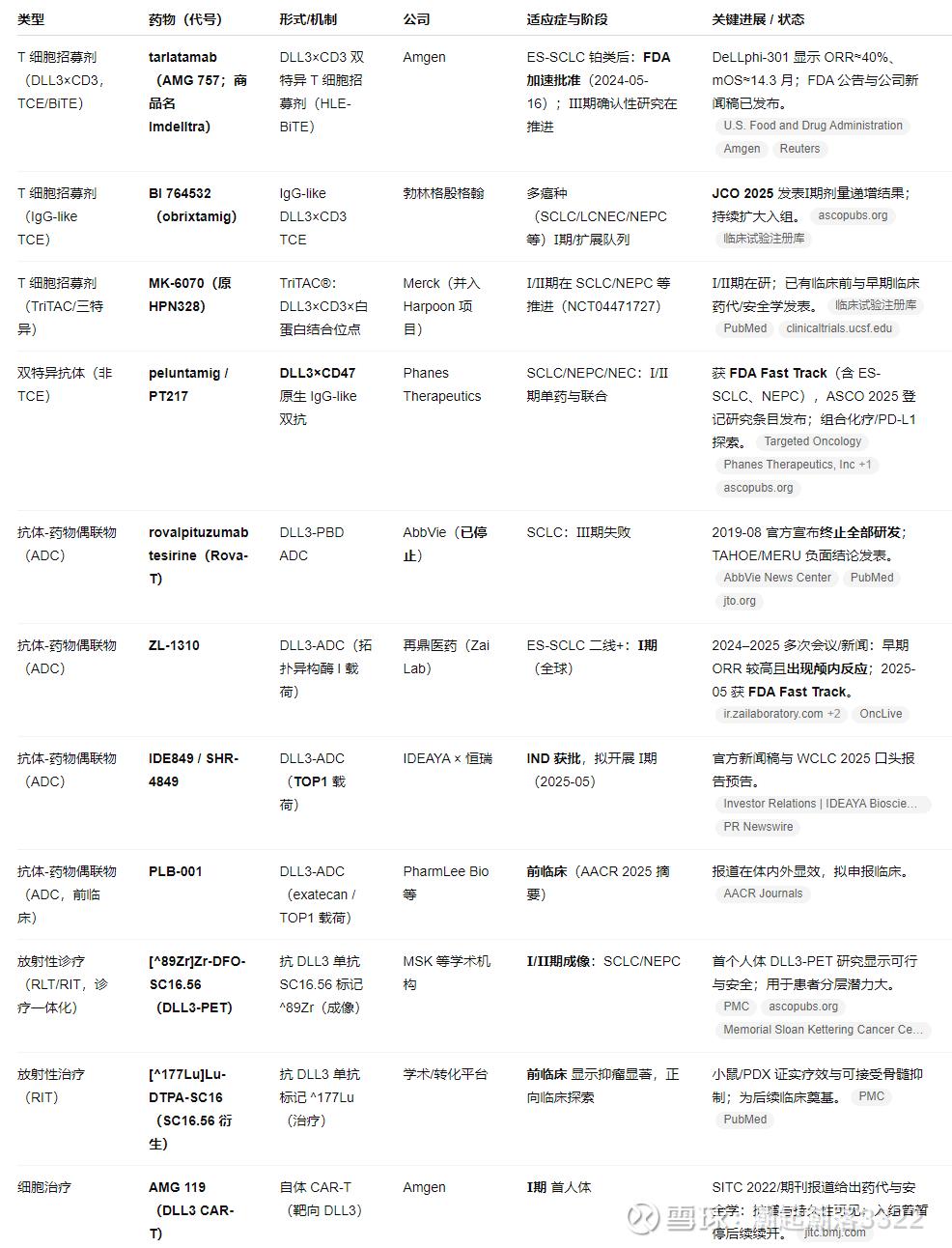
Tarlatamab:FDA 加速批准(2024-05-16):用于ES-SCLC 铂类后进展(二线及以后),依据 DeLLphi-301 的 ORR 与 DOR。处方信息含阶梯给药与首两次给药 22–24h 监护要求,并给出盒装警示:CRS 与 ICANS。
Tarlatamab推荐用法用量(核心要点):步进给药(Cycle 1):D1 1 mg → D8 10 mg → D15 10 mg;此后 10 mg Q2W 维持;每次 1 小时静滴。预处理/并用药:C1 的 D1、D8 给予 地塞米松 8 mg IV 于输注前 1 小时;D1、D8、D15 于输注后给予 1 L 生理盐水 4–5 小时,降低 CRS 风险。 监护要求:C1 的 D1 与 D8 需在医疗机构自输注起监测 22–24 小时;D15 与 C2 起缩短为 6–8 小时,后续进一步缩短,除非既往出现 ≥G2 CRS/神经毒性。tarlatamab 是 T 细胞连接器(TCE),一上来就把患者自身 T 细胞“拉到”肿瘤旁强力激活,最怕的是 CRS 和神经毒性(ICANS)。为了把这两类风险压下去,给药被设计得很繁琐但更安全。
Tarlatamab已经公布的临床(FDA获批依据)
DeLLphi-301(Ⅱ期,注册性单臂;NEJM 发表+长期随访)
开放标签、国际多中心,设置 10 mg Q2W 与 100 mg Q2W 两个剂量队列。广泛期小细胞肺癌(ES-SCLC),既往治疗进展/复发的患者;需既往含铂化疗,并且至少还接受过 ≥1 条其他系统治疗(即三线及以后人群)。NEJM 首次公布的核心读数:10 mg 组 ORR 40%(95%CI 31–51),CR 2%/PR 38%;mDOR 9.7 月;并报道了mPFS 4.9 月等次要终点。后续长期随访在会议/综述中给出mOS 约 14.3–15.2 月的更新。安全性方面,10 mg 队列,n≈133:CRS 51%。CRS 主要发生在首两针(首针 41%,次针 29%),3级 CRS 仅 1 例(1.4%)。ICANS(含相关神经事件)约 8–10%; 未见 ≥3级 ICANS。 ≥3级“治疗相关”不良事件(TRAE): 26%。停药率 3.0%。
DeLLphi-304(Ⅲ期,二线随机对照;ASCO 口头报告 + NEJM 发表)
确诊小细胞肺癌,且在一线含铂方案(可伴随或不伴随PD-(L)1抑制剂)治疗期间或之后进展/复发(二线场景)。一线含铂治疗后进展的 SCLC 随机分配 tarlatamab 10 mg Q2W vs 医师选择化疗(拓扑替康/阿莫柔比星/鲁比替定),主要终点 OS 达成:mOS 13.6 vs 8.3 月,HR 0.60(95%CI 0.47–0.77;P<0.001);mPFS 4.2 vs 3.7 月,HR 0.71(95%CI 0.59–0.86);ORR 35% vs 20%;安全性:≥3级 TRAE:27% vs 62%;严重 TRAE:28% vs 31%;因 TRAE 中断/减量:19% vs 55%;因 TRAE 停药:3% vs 6%;5级 TRAE:0.4% vs 2%。CRS:总体56%(142/252),多数为 1 级;在首两周期更常见。分监护亚组看:首两针48 h 监护人群(n=209):总 CRS 60%(1级 45%、2级 13%、3级 1%);6–8 h 门诊监护人群(n=43):总 CRS 37%(1级 28%、2级 9%,无 3级),未导致停药。神经毒性/ICANS:ICANS ~6%(Ⅲ期报道),多为低级别。
Tarlatamab目前正在做的临床
总结:1.DeLLphi-306,从局限期放化疗后做巩固疗法,防止复发和转成广泛期。2.DeLLphi-312,进入广泛期后,把目前一线标准治疗替代了,目前一线是先化疗+免疫4周期后,再单用免疫维持。而这个临床是在这个标准治疗基础上再加上tarlatamab。3.DeLLphi-305,把目前一线标准治疗的后半部分替代了,目前的一线是先化疗+免疫4周期,之后把单用免疫替换为tarlatamab+免疫。4.DeLLphi-303 是Ⅰb期,是探索305和312可不可行。5.DeLLphi-308是探索皮下制剂用于二线治疗。6.DeLLphi-309是探索给药方式,Q2W、Q3W或Q4W。7.DeLLphi-310,是探索与宜联(B7-H3 ADC)合作,最后要做一个一线治疗方案出来,看宜联的安全性数据,这个方案感觉风险很大。以上临床,安进几乎把一线二线能做的都覆盖了。以下为具体临床进展:
DeLLphi-305(NCT06211036)—一线维持,ES-SCLC III期、开放、全球多中心、1:1 随机:在完成含铂/依托泊苷+durvalumab 的一线诱导且未进展的 ES-SCLC 患者中,比较tarlatamab 10 mg Q2W + durvalumab Q4W对比durvalumab Q4W;主要终点 OS,次要终点含 PFS、PRO 等。目标样本量≈550。FPI=2024-06-05;入组状态:Recruiting。注册库追踪显示预计主要完成 2027-07-05;多方情报盘点显示研究完成约 2028 年。
DeLLphi-306(NCT06117774)—cCRT 后巩固,LS-SCLC
III期、双盲、安慰剂对照、1:1 随机:同步放化疗(cCRT)后未进展 的 LS-SCLC 患者,tarlatamab 10 mg Q2W 对比 安慰剂;主要终点 PFS,关键次要终点含 OS、安全性与生活质量。目标样本量=400。FPI=2024-02-20;入组状态:Recruiting。主要完成 2029-10-31。
DeLLphi-303(NCT05361395)—一线“联合/仅维持”探索,ES-SCLC
Ib 期、多队列、开放标签,评估两条路径:其一为诱导期“tarlatamab + PD-L1 抑制剂 + 铂/依托泊苷”→维持“tarlatamab + PD-L1”;其二为完成标准化疗+PD-L1 后在维持期仅加用 tarlatamab + PD-L1。目标样本量=184;FPI=2022-08-24;状态:Active, not recruiting;预计主要/研究完成 2028-08-28。
DeLLphi-308(NCT06598306)—皮下(SC)制剂,≥二线 ES-SCLC
Ib 期、两部分:Part 1 剂量探索 → Part 2 扩展,核心目标为SC tarlatamab 的安全性/PK 与初步疗效,以期降低输注与监护负担。目标样本量≈100。FPI=2024-10-07;入组状态:Recruiting。预计主要完成约 2027 年初、研究完成 2030 年 Q1
DeLLphi-309(NCT06745323)—静脉给药“剂量/给药程式”优化,复发/进展 SCLC
II期、开放、随机、多中心,比较不同 IV 剂量/给药程式 的 tarlatamab,主要目的为抗肿瘤活性与暴露-安全性平衡,为长期维持与更广泛人群使用优化方案。目标样本量=240。FPI=2025-02-26;入组状态:Recruiting。预计研究完成 2029-05-29。3 个静脉给药频率之一,分别为每 2 周(Q2W)、每 3 周(Q3W)或每 4 周(Q4W)输注 。
DeLLphi-307(NCT06502977)—中国桥接/Ⅱa,≥三线 SCLC
IIa 期、单臂,中国人群经二线及以上治疗后 的晚期/广泛期 SCLC,主要终点 ORR(BICR),同时观察安全性与 PK;旨在区域可及性与标签对接。目标样本量=32。FPI=2024-08-27;入组状态:Active, not recruiting。注册与药学数据库显示主要完成=2025-03-28(Actual),预计研究完成 2026-05-11。
DeLLphi-312(NCT07005128)—一线“起始即联合”,ES-SCLC(规划/未启动)
III期、开放、两臂并行 的计划性确证:tarlatamab + durvalumab + Carboplatin/Etoposide(诱导 4 周期)→ tarlatamab + durvalumab 维持,对比durvalumab + Carboplatin/Etoposide(诱导)→ durvalumab 维持;主要终点 OS。行业数据库显示目标样本量约 330,招募状态:Not yet recruiting;媒体与分析稿件称计划于 2025 年年中启动。
DeLLphi-310 是 Ⅰb 期、开放标签、非随机、顺序分配的多中心研究,评估 tarlatamab + YL201 的联用,并在第三部分加入 抗 PD-L1(atezolizumab 或 durvalumab) 的三联策略。按方案分为三段:Part 1 剂量探索(在固定剂量 tarlatamab 的基础上探索 YL201 多个剂量,并注明 tarlatamab 采用 one-step dosing)、Part 2 剂量扩展(在组合的 MTCD/RP2D 上扩展)、Part 3 三联组合(在选定的 YL201 剂量上,与 tarlatamab + 抗 PD-L1 进行三联)。研究主要目标为安全性/耐受性与药代(PK),并观察初步抗肿瘤活性。计划入组约 200 例 ES-SCLC。关键入排:Part 1/2 需铂类治疗后进展;Part 3 为一线场景(允许仅做过 1 个周期化疗+依托泊苷+PD-(L)1);允许无症状或稳定脑转;排除既往 DLL3 或 B7-H3 靶向治疗、拓扑异构酶Ⅰ类 ADC 暴露、活动性/需激素 ILD 等。2025年5月首例入组。
DeLLphi-311 是安进(Amgen)发起的Ⅰb期多中心开放研究,评估 tarlatamab(DLL3×CD3 T 细胞连接器,Imdelltra)与 AB248(学名 etakafusp alfa,Asher Bio 的CD8 定向 IL-2)在广泛期小细胞肺癌(ES-SCLC)中的联用。主要目标:在两部分均以安全性/耐受性为主;剂量探索阶段还要确定最大耐受的联用剂量(MTCD)/扩展推荐剂量(RP2D);扩展阶段进一步观察初步抗肿瘤活性(如 ORR 等)。还未入组。
宜联(MediLink)YL201(B7-H3 ADC)在小细胞肺癌(SCLC)(经标准治疗失败)的临床疗效与安全性:入组与基线:总入组 312 例多肿瘤患者,其中 ES-SCLC 约 79 例;数据截止 2024-09-26,中位随访 7.5 个月。 客观缓解率(ORR, BICR):ES-SCLC ORR 63.9%(在 2.4 mg/kg 组),2.0 mg/kg 组 ORR 67.7%;两组均显示高缓解率。无进展生存期(mPFS):2.4 mg/kg:5.7 个月;2.0 mg/kg:7.6 个月(ES-SCLC 亚组)。颅内活性:有基线脑转移且可评估者(跨肿瘤)颅内 ORR 28.5%,颅内 DOR 6.2 个月。SCLC 亚组(按剂量分层):≥3 级治疗相关不良事件(TRAE):2.4 mg/kg 71.1% vs 2.0 mg/kg 50.0%。全队列(n=312/可评效 n=287)≥3 级 TRAE 54.5%(以中性粒↓ 31.7% 为主)。给药相关 ILD 1.3%(4 例)、输注反应 0.3%(1 例)。治疗相关死亡 2.6%(8 例)。停药 5.4%、减量 17.0%、中断 36.2%。安全性不行。
tarlatamab上市后四个季度的爬坡$36M → $67M → $81M → $134M,美国医保是ES-SCLC 铂后进展人群,5个28天周期平均用药时长,15万美元,相当于一个季度9万美元,对应1500人。一线化免之后,ES-SCLC 患者约有 55%–70% 会在 6 个月内进展,约 82%–88% 会在 12 个月内进展。那么二线治疗差不多也有2万人的空间。目前一线标准治疗的PFS是5个月,tarlatamab如果把一线方案做出来,估计会超过5个月。
再鼎的1310,≥二线,单药
二线 ES-SCLC 单药(剂量探索/扩展),安全集 n=89;Q3W 给药;含爬坡+扩展期;年内更新将达 ≈110 例并延长4个月的随访,目前披露的数据是74例的疗效数据,38 名缓解者中 29 名仍在研。下半年推动二线注册性临床。
≥3级相关TEAE:23%,≥3级中性粒细胞减少 14%,贫血 11%,血小板减少 5%。因相关TEAE降剂量:7%;停药:6%;死亡:1%。这些统计均基于所有已接受至少1次给药的患者。
按剂量阈值分层(<2.0 vs ≥2.0 mg/kg)
<2.0 mg/kg(50例):相关TEAE 58%;≥3级 6%;降剂量 4%;停药 0%;死亡 0%。其中0.8mg有4例,1.2mg有11例,1.6mg有35例,因此可以认为大部分反应了1.6mg的安全水平。如果最后三期临床1.6mg能维持在10%+的水平,就很好了。
≥2.0 mg/kg(39例):相关TEAE 92%;≥3级 44%;降剂量 10%;停药 13%;死亡 3%。2.4 mg/kg 观察到1例DLT:可逆的4级中性粒细胞减少与血小板减少。
剂量爬坡安全可评集 n=25、≥3级TRAEs约20%,0.8、1.2、1.6、2.0、2.4、2.8 mg/kg 6 个 Q3W 剂量层级。
2线 1.6 mg/kg 组 ORR 79%(n=14),全二线ORR 67%。二线化疗的ORR是20%+。
1310脑转移且可评估者 n=22:ORR 68%。
二线单药竞品
tarlatamab,DeLLphi-304,ORR 35%。注册临床没有披露颅内数据,小样本真实世界队列(MD Anderson,ASCO 2025 海报)在14例可评估者中CR 14% + PR 7% → 颅内ORR ≈ 21%。宜联YL201有基线脑转移且可评估者(跨肿瘤)颅内 ORR 28.5%。≥3级 TRAE:27%。
泽璟制药ZG006(CD3×DLL3×DLL3):ORR:10 mg 62.5%;30 mg 58.3%。≥3 级 TRAE(按组):10 mg 组 5 例、30 mg 组 9 例(约 21% vs 38%,以组内 24 例估算)。剂量递增n=24含 1 例 3 级 CRS。
MK-6070:DLL3 靶向三抗,TCE,目标剂量疗效(SCLC):ORR ~39%(12/24 mg Q2W 人群,n=28)。安全性:CRS 三级3%。≥3级 TRAE 约 24.7%。目前还未开三期。
宜联YL201: ES-SCLC 79 例,2.4 mg/kg 组 ORR 63.9% ,2.0 mg/kg 组 ORR 67.7%,≥3 级治疗相关不良事件(TRAE):2.4 mg/kg 71.1% vs 2.0 mg/kg 50.0%。
勃林格殷格翰BI 764532:DLL3×CD3 T 细胞连接器(TCE),SCLC :ORR 21%。CRS≥3级 3%,ICANS≥3级 3%,TRAE≥3级 24%。
恒瑞/IDEAYA 的 DLL3-ADC:拓扑异构酶 I(TOP1), SCLC 患者 11 例,其中 8 例达到部分缓解(PR)→ ORR ≈ 73%。没有详细披露安全性数据。WCLC 2025(9月,巴塞罗那)口头报告:将公布中国 1 期试验中 >70 例 SCLC 患者的疗效与安全性(含爬坡与多个扩展剂量队列)。
还有正在一期的DLL3-ADC(IBI3009/RG6810、BL-M14D1、FZ-AD005),拓扑异构酶 I(Topo-I)类载荷,还没出数据。
再鼎的1310,一线,联用
与阿替利珠单抗(atezolizumab)联用、以及“诱导期卡铂+阿替利珠单抗,再转维持期ZL-1310+阿替利珠单抗”的组合队列。非随机、无并行对照组。二季度交流会显示,也在探索含 etoposide 的方案,以及 atezo+carbo 的组合,正在快速入组联合剂量递增部分的患者,此后将开展剂量优化,2026 年初披露数据。给我的感觉是一线有几个方案正在试,不一定对哦:1. 1310与atezo的adc+单抗方案,该方案直接去掉化疗。2. 诱导期atezo+carbo,维持期1310+atezo。3.诱导期atoposide+atezo+carbo,维持期1310+atezo。由于1310本身就有化疗,所以一线剂量的探索和联用的方式会比较复杂。
其他神经内分泌肿瘤目前全球 I/II 期研究正在入组中,计划在明年上半年某医学会议上展示初步数据。统计下美国新发人数,肺大细胞神经内分泌癌1200人,神经内分泌前列腺癌2000人,Merkel 细胞癌 3000人,膀胱小细胞癌500人,宫颈小细胞/神经内分泌癌200人,胃肠胰高分级神经内分泌癌1000人。
一线联用竞品
1.维立志博LBL-024(PD-L1/4-1BB 双特异性抗体) + 依托泊苷/铂(EP/EC)一线广泛期 SCLC(化疗初治;若由局限期转广泛期,需距上次根治性放/化疗 ≥6 个月),19 例可评估患者 ORR 84.2%,DCR 100%。由于没有024单药数据,但免疫疗法的效果肯定要好一些,os应该能长,不过数据不够无法基于ORR来判断。一线标准疗法的ORR也不低。单药的≥3 级治疗相关的TRAE 21%。一线联用化疗≥G3 TRAEs = 32.1%(17/53)(含其他肿瘤),单药15mg剂量(20/111)≥G3 TRAEs =18%。
2.目前一线的标准治疗:阿替利珠单抗 + 卡铂/依托泊苷(IMpower133):确证 ORR ≈ 60.2%(对照化疗 64.4%)。度伐利尤单抗 + 铂/依托泊苷(CASPIAN):确证 ORR ≈ 68%(对照化疗 58%)。SCLC 天生“缩得快、复发也快”。对含铂/依托泊苷初始高度敏感,反应率常达 ~70%,所以 ORR 常常高;但耐药来得早、复发快,导致中位 PFS 只有 5–6 个月。Mpower133(阿替利珠单抗 + 卡铂/依托泊苷):≥G3 TRAEs 57.1%(113/198);对照化疗 56.1%(110/196)。CASPIAN(度伐利尤单抗 + 铂/依托泊苷):≥G3 TRAEs 46%;对照化疗 52%。
3.ETER701 Ⅲ期 三臂临床,A臂 Benmelstobart(PD-L1)+ 安罗替尼(TKI,抗血管生成) + EC(化疗),B 臂:安罗替尼 + EC → 维持安罗替尼;C 臂:EC 单药 → 维持安慰剂。OS 19.3 vs13.3 vs 11.9 月,PFS 6.9 vs5.6 vs 4.2 月。ORR:81.3% vs 66.8%(A vs C)。≥3 级治疗相关不良事件(TRAE):93.1% / 94.3% / 87.0%(A/B/C)。毒性太大。
4.tarlatamab早期数据:ES-SCLC完成标准一线铂/依托泊苷+PD-L1后、无进展者进入维持;分两队列: tarlatamab 10 mg IV Q2W + durvalumab 1500 mg Q4W(n=40); tarlatamab 10 mg IV Q2W + atezolizumab 1680 mg Q4W(n=48)。允许维持期更换PD-L1抑制剂。疾病控制率(DCR):两臂均 62.5%,中位PFS:5.3 个月(durva臂);5.6 个月(atezo臂)。9个月OS率:91.8%(durva臂);86.7%(atezo臂)治疗相关不良事件致中断/停药:durva臂约15%/8%,atezo臂约17%/4%。按TEAEs统计的≥G3发生率:tarlatamab+阿替利珠单抗 54.2%(26/48);tarlatamab+度伐利尤单抗 52.5%(21/40);总体 53.4%(47/88)。G4 TEAEs:12.5%、15.0%、总体13.6%。致死TEAEs:阿替组2例(4.2%)、度伐组0例。最常见≥G3 TEAE 为低钠血症 10.2%**、中性粒细胞减少 6.8%、贫血 6.8%。tarlatamab+度伐利尤单抗:因TRAE中断 15%、停药 8%;tarlatamab+阿替利珠单抗:因TRAE中断 17%、停药 4%。
总结
从目前SCLC一线标准治疗来看,诱导期是免疫+化疗,维持期是免疫。从进展最快的tarlatamab三期的方案来看,诱导期化疗省不了,把原来的免疫再加上tarlatamab。1310的思路是诱导期用或者不用化疗,维持期就用免疫+adc。在免疫疗法里有很多竞争对手,感觉数据都不错,比如维立志博LBL-024、MK-6070的DLL3 三抗TCE、泽璟制药ZG006,tarlatamab、MK-6070的DLL3 三抗、泽璟制药ZG006三抗都属于TCE,给药方式都很复杂,需要剂量爬坡,如果维立志博后面数据能做出来,比较有前景。在ADC里,目前有临床数据的是再鼎的1310与恒瑞/IDEAYA 的 DLL3-ADC,但恒瑞的人数还比较少,安全性数据也没披露,所以不好判断,等年底的数据。B7-H3在约65%的SCLC肿瘤中为中-高表达。与DLL3 ADC的ORR数据差不多,但B7-H3 的≥G3 TRAE普遍大于50%,毒性大,后续联合用药有瓶颈。后面再鼎值得关注的数据是样本大后,1.6mg的安全性是不是还是这么好,PFS和OS数据能不能延长(虽然ORR很好,但SCLC刚开始对化疗敏感度高,但复发高,所以这个数据很重要),等下半年的单药数据披露。再鼎目前最大的优势是兼顾了疗效和安全性,尤其是脑转移优势,看能否把优势一直保持住。市场空间来看,主要取决于PFS,目前tarlatamab的二线PFS是4个月,实际用5个月左右,差不多15万美元,按2万人,30亿美元的市场。一线标准治疗的PFS目前是5个月,看哪家能把PFS做长。此外还有个市场,就是局限期SCLC的巩固期,目前是度伐利尤单抗,PFS 16.6月,OS 55月,局限期有1万人,防止局限期的巩固期变成广泛期。
$再鼎医药(09688)$ $再鼎医药(ZLAB)$ 感谢@做多的老白 本文有参考你的文章,结论可能略有不同。
附:
目前ADC或双抗在SCLC开二线的注册临床有:
二线 SCLC 的标准治疗仍按复发间隔(CTFI/TFI)分层:≥6 个月优先含铂再挑战;<6 个月或不可再挑战时,单药系统治疗(tarlatamab、lurbinectedin、topotecan 等)为主。tarlatamab 已被纳入指南作为二线/后续治疗的“优选(Preferred)”选项,且有随机Ⅲ期(DeLLphi-304)证据显示优于化疗。
1.默沙东Ifinatamab deruxtecan(I-DXd,DS-7300;靶点 B7-H3)— IDeate-Lung02(NCT06203210)复发 ES-SCLC,仅1线含铂后进展;全球多中心。12 mg/kg Q3W;目标入组≈460例。2024-08-01宣布首例给药。I-DXd vs 医生选择化疗(阿曲布星/鲁比替定/托泊替康)。双主要终点=BICR 评估的 ORR + OS。早期数据,12mg/kg,PFS 5.5月,OS 11.8月,≥G3 TEAE 50%。治疗相关 ILD/肺炎(独立判定):11.9%。因不良事件停药:16.7%。
2)宜联 YL201(B7-H3 ADC,MediLink)— NCT06612151。复发 SCLC。中国。主要终点:OS。N≈438;实际开组 2024-12-17。YL201 vs 静脉托泊替康。2.0 mg/kg:ORR 67.7%;mPFS 7.6 月;≥G3 TRAE 50.0%。脑转移亚组 ORR 52.2%、mPFS 5.3 月。整体治疗相关 ILD 1.3%。停药 5.4%;减量 17.0%。
3) HS-20093(又称 GSK’227,B7-H3 ADC,翰森/GSK)。临床A:一线含铂后进展的 LS/ES-SCLC。主要终点:OS。N≈460。中国。HS-20093 vs 托泊替康。招募中。临床B:(LS-SCLC 同步放化疗后巩固)HS-20093 vs 主动随访(观察)。尚未招募。8 mg/kg:ORR61.3%(n=31)mPFS5.9 月 ,mOS 9.8 月。≥G3 TRAE 中性粒细胞计数减少 39.3%,白细胞计数减少 33.9%,淋巴细胞计数减少 25.0%,血小板计数减少 17.9%,贫血 16.1% 。
4) MHB088C(B7-H3 ADC;明慧/齐鲁)— NCT06954246。复发 ES-SCLC(一线含铂后)。MHB088C vs 医生选择治疗(TPC:托泊替康/伊立替康/紫杉类等)。中国。主要终点:OS。招募中。2.0 mg/kg Q2W(n=33):ORR 57.6%(确证 42.4%),DCR 87.9%,mPFS 5.9 月;ASCO 2025(ES-SCLC n=91):最常见 ≥3 级治疗相关不良事件为中性粒细胞减少、血小板减少、贫血;1.6/2.0 mg/kg Q2W 两个剂量层这三项为“个位数比例”。
5.Sacituzumab govitecan(Trodelvy,TROP-2 ADC) vs 标准治疗(托泊替康);EVOKE-SCLC-04:III 期、全球、随机;目标:既往治疗后进展的 ES-SCLC;状态:招募中;NCT06801834。N=43,ORR 41.9%,PFS 4.40 月;OS 13.60 月,≥G3 TEAE 74.4%,1 例与治疗相关的致死事件。
6. BMS-986507(izalontamab brengitecan,EGFR×HER3 双特异 ADC) vs 拓扑替康|NCT06500026。2025 年招募中。早期数据58 例,ORR:55.2%。mPFS:4.0 个月,mOS:12.0 个月。≥3级 TRAE 71%。因 TRAE 停药率 12.1%。2 例感染相关死亡。20 例在既往治疗线数一次的 SCLC 患者亚组中, ORR 80%,mPFS 6.9 月、mOS 15.1 月。
7.BioNTech,BNT327/PM8002,双抗,二线 ES-SCLC 的Ⅲ期(NCT06616532:PM8002+紫杉醇 vs 研究者选择)。2024-11-13 实际开组,目标 404 例。多国/全球。PM8002 + 紫杉醇ORR 72.7%(16/22)、DCR 81.8%(18/22)、中位 PFS 5.5 个月。≥3 级治疗相关 AE 73.1%。TRAE 停药 1 例。
8.NCCN 已将 tarlatamab 列为复发 ES-SCLC 的**后续治疗(Category 2A)选项,安进,DeLLphi-304(Ⅲ期,二线随机对照;ASCO 口头报告 + NEJM 发表)确诊小细胞肺癌,且在一线含铂方案(可伴随或不伴随PD-(L)1抑制剂)治疗期间或之后进展/复发(二线场景)。一线含铂治疗后进展的 SCLC 随机分配 tarlatamab 10 mg Q2W vs 医师选择化疗(拓扑替康/阿莫柔比星/鲁比替定),主要终点 OS 达成:mOS 13.6 vs 8.3 月,HR 0.60(95%CI 0.47–0.77;P<0.001);mPFS 4.2 vs 3.7 月,HR 0.71(95%CI 0.59–0.86);ORR 35% vs 20%;安全性:≥3级 TRAE:27% vs 62%;严重 TRAE:28% vs 31%;因 TRAE 中断/减量:19% vs 55%;因 TRAE 停药:3% vs 6%;5级 TRAE:0.4% vs 2%。CRS:总体56%(142/252),多数为 1 级;
限制期SCLC的cCRT 后未进展的巩固期的注册临床有:
标准治疗:2024 年 ADRIATIC 研究证实 durvalumab 于 cCRT 后未进展的 LS-SCLC 显著改善 OS/PFS,并据此获 FDA 批准,把“cCRT 后免疫巩固”确立为新标准场景。mOS 55.9 vs 33.4 个月。mPFS 16.6 vs 9.2 个月。≥G3 不良事件(任何因):24.4% vs 24.2%(PBO)。
1.双抗康方AK112-311 / HARMONi-9(cCRT 后未进展的 限制期小细胞肺癌,做的是巩固市场,III 期、注册性、中国),2025年8月完成首例给药,对照组是安慰剂。下面是康方早期临床,非巩固期,AK112/ivonescimab+EP 一线 ES-SCLC 的 Phase Ib(N=35)。给药方式ivonescimab 3/10/20 mg/kg Q3W 静脉+卡铂/依托泊苷 4 个周期 → ivonescimab 维持。确证 ORR:80%;DCR:91.4%。各剂量 ORR:3 mg/kg 66.7% / 10 mg/kg 90.9% / 20 mg/kg 76.2%。mPFS ≈ 6.9 个月、mOS ≈ 14.5 个月、1 年 OS ≈ 72%。≥G3 TRAE:60%。TRAE 相关死亡:2 例(5.7%)。
2.复宏汉霖Serplulimab(HLX10,PD-1)+化疗+同步放疗 vs 化疗+同步放疗;III 期、双盲、全球多中心(NCT05353257),主要终点完成2025-07-30。之前做了广泛期 SCLC 一线,斯鲁利单抗 4.5 mg/kg Q3W + 卡铂AUC5 D1 + 依托泊苷100 mg/m² D1–3,化疗最多4个周期,随后维持斯鲁利单抗Q3W直至进展/不可耐受。OS:中位 15.4 vs 10.9个月,PFS中位 5.7 vs 4.3个月,≥3级 TRAE:33.2% vs 27.6%。
3.QL1706(齐鲁,PD-1/CTLA-4 双抗)或 QL1604(PD-1)。QL1706 vs QL1604 单药巩固(cCRT/顺序放化疗后未进展的 LS-SCLC)。目标样本量 636。首例入组2025-01。早期数据治疗初治的 ES-SCLC 患者:QL1706 5 mg/kg Q3W + 依托泊苷100 mg/m² D1–3 + 卡铂AUC5 D1,4–6个周期后维持QL1706 直至进展/不可耐受。ORR:89.7%,≥3级TRAE:37.5%。入组 40 例。在SCLC 队列(n=26)中,ORR 23.1%(6/26)≥3 级 TRAE 16%。
4.君实生物/TopAlliance,JS004-008-III-SCLC / NCT06095583 — Toripalimab(± BTLA抗体 Tifcemalimab)全球多中心,巩固 vs 安慰剂,入组时间:2023-11-15,cCRT后未进展LS-SCLC,三臂、双盲、安慰剂对照III期,A:tifcemalimab+toripalimab;B:toripalimab;C:安慰剂。之前临床,广泛期 SCLC(ES-SCLC)一线:中位 PFS 5.8 vs 5.6 个月,中位 OS 14.6 vs 13.3 个月,≥3 级治疗期不良事件(TEAE):89.6% vs 89.4%。
5.基石药业SUPPASS(NCT05623267)— Sugemalimab(PD-L1)巩固 vs 安慰剂(II/III期)中国。
6. 安进,DeLLphi-306(NCT06117774)— Tarlatamab 巩固 vs 安慰剂,入组时间:2024-02-20。
总结:限制期大都是之前pd-1+化疗治疗一线广泛期的药,现在用单药来治巩固期,只有安进的Tarlatamab属于新药也在做。
广泛期SCLC一线的注册临床:
标准治疗:Atezolizumab+EP(IMpower133)mOS 12.3 vs 10.3 月;Durvalumab+EP(CASPIAN)mOS 12.9 vs 10.5 月。
可能成为的新标准:Lurbinectedin + Atezolizumab 维持(诱导统一为Atezo+Carbo+Eto 4周期);对照:Atezolizumab 维持。Lurbinectedin是小分子烷化剂,化疗药。中位 OS 13.2 vs 10.6 月,中位 PFS 5.4 vs 2.1 月,ORR 19.4% vs 单药 10.4%。治疗相关(TRAE):≥3–4 级 25.6% vs 5.8%;5 级 TRAE 0.8% vs 0.4%。取代的是Atezolizumab+EP(IMpower133)这个临床,本质上是在维持期加了化疗。
1.BNT327/PM8002(BioNTech;PD-1×VEGF bsAb)+卡铂/依托泊苷 vs 阿替利珠单抗+卡铂/依托泊苷;III 期、全球、多中心、随机;主要看 OS/PFS;状态:招募中;NCT06712355。 首例入组为2025 年 2 月。完成 4 个诱导周期后进入Q3W 维持至最多 2 年。之前做过一线 ES-SCLC 的中国 II 期单臂研究(NCT05844150)共 50 例入组。确证 ORR:85.4%,中位 PFS:6.9 个月。6 月 OS 率 91.7%;12 月 OS 率 72.7%;报道中提及“当前观察到的中位 OS 16.8 个月,但仍未成熟”≥G3 TRAE:86%。因 TRAE 停药:6%;治疗相关死亡:0。
2.安进,如前文。