IOVA三季报简评
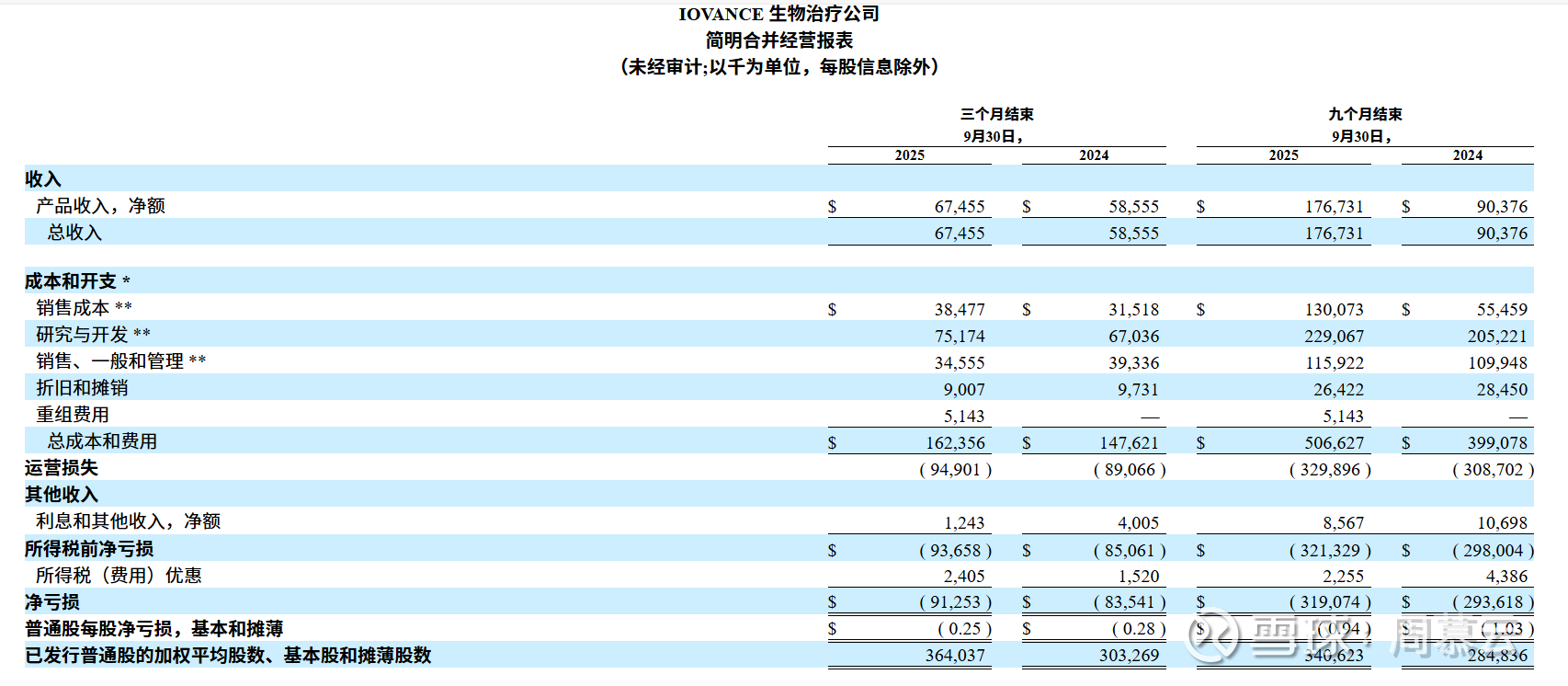
各季度列出来看:
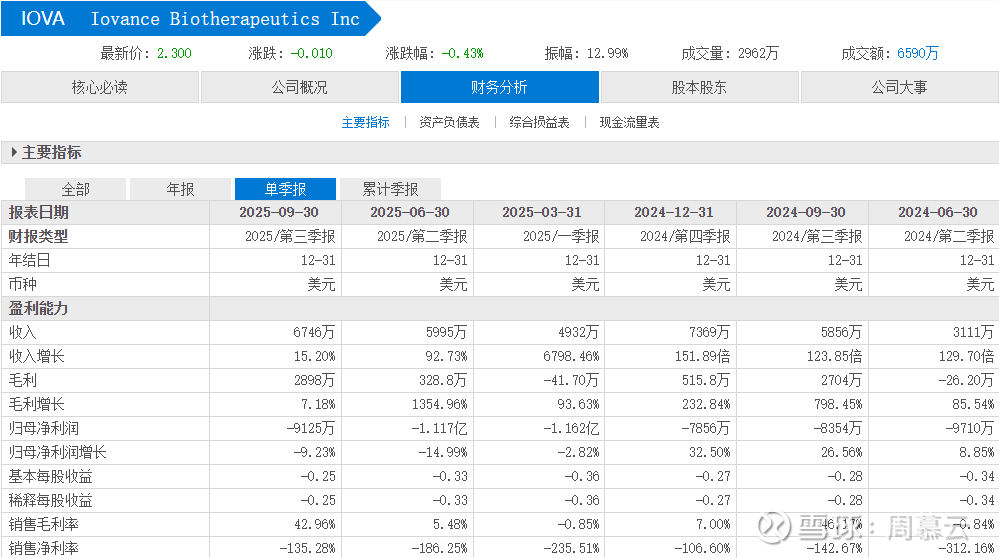
销售收入稳步增长的态势,没有爆发性增长但毛利有改善,从Q2的328万增加到2898万,亏损环比略有减少。看起来如果输注人数继续增加,亏损还会继续减少,这是实质性利好。
公司现在手里有3亿左右的现金,每个季度亏损1亿左右的话,还可以烧3个季度,看来还得继续增发股票融资续命。
关于产品推广,公司是这么说的:
公司计划推出Amtagvi®进入晚期黑色素瘤患病率较高的其他市场,包括加拿大、英国(“英国”)、澳大利亚、瑞士和欧盟(“欧盟”)。2025 年 8 月,加拿大卫生部发布了《遵守条件通知》(“NOC/c”),授权 Amtagvi®用于治疗抗PD-1和靶向治疗后的晚期黑色素瘤。澳大利亚治疗用品管理局授予 Amtagvi 优先审查权®预计将于 2026 年上半年做出决定,并计划于 2025 年第四季度向 Swiss Medic 提交,预计 2027 年在瑞士获得批准。2024年6月,公司向欧洲药品管理局(“EMA”)提交了lifileucel的集中上市许可申请(“MAA”),该申请于2024年8月受理进行审查。在与 EMA 的人用药品委员会 (“CHMP”) 进行互动后,Iovance 于 2025 年 7 月通知 EMA 其撤回 MAA 的决定,并正在努力确定重新提交策略。MAA 已提交给英国药品和保健品监管局,并有望在 2026 年上半年获得批准和推出。在美国和其他目标全球市场,Amtagvi®有可能解决超过 30,000 以前每年治疗过晚期黑色素瘤患者。
看起来还是雄心勃勃要继续推。对于未来的计划,公司管理层是这么吹的:
我们研究了 TIL 细胞疗法在全球多中心临床试验中,用于晚期黑色素瘤、宫颈癌、子宫内膜癌、非小细胞肺癌或 NSCLC 以及头颈部鳞状细胞癌或 HNSCC。通过持续的学术合作,以及政府和其他合作伙伴,我们正在研究 TIL 细胞疗法在其他肿瘤类型和治疗环境中的下一个前沿领域。
●晚期黑色素瘤:在未接受过抗 PD-1 治疗的一线晚期黑色素瘤患者中,我们正在 TILVANCE-301 中研究 lifileucel 与 pembrolizumab 的联合治疗,这是一项随机 3 期临床试验,旨在支持晚期一线黑色素瘤的注册。TILVANCE-301预计将招募约670名患者,并具有ORR和无进展生存期(PFS)的双重主要终点,由盲法独立审查委员会评估。我们还将队列 1D 添加到我们的 IOV-COM-202 试验中,以研究 lifileucel 联合 relatlimab 和 nivolumab 在一线晚期黑色素瘤患者中的疗效。一项新的潜在注册临床试验,名为 IOV-MEL 202,将研究 lifileucel 在先前接受过抗 PD-1 治疗的晚期黑色素瘤患者中的应用,主要是在美国境外。该试验包括在社区环境中门诊使用 Amtagvi,并将招募一亚组真正的二线 BRAF 突变阳性患者,既往未接受过 BRAF 抑制剂治疗。
●晚期非小细胞肺癌:在非小细胞肺癌中,我们正在研究两项针对需求未得到满足的非小细胞肺癌患者群体的临床试验。IOV-LUN-202 是 lifileucel 在化疗和抗 PD-1 治疗后进展的晚期 NSCLC 患者中的一项注册临床试验。实体瘤中的 IOV-COM-202 试验包括接受以下治疗的 NSCLC 患者队列利菲尤塞尔单一疗法和联合疗法。2025 年 11 月,我们公布了 IOV-LUN-202 试验的中期数据。晚期非鳞状非小细胞肺癌患者一次性接受lifileucel单药治疗后,RECIST v1.1的客观缓解率为25.6%。39例患者中有10例观察到客观缓解,其中完全缓解2例,部分缓解7例,未确认部分缓解1例(待确认评估),疾病控制率为71.8%。中位随访25.4个月后未达到中位缓解持续时间。
●晚期子宫内膜癌:IOV-END-201 是一项 2 期临床试验,研究 lifileucel 在子宫内膜癌中的应用,以潜在地解决先前接受过铂类化疗和抗 PD-1 治疗的患者未满足的需求,无论错配修复如何。
●下一代 TIL 细胞疗法:我们的首个转基因 TIL 细胞疗法 IOV-4001 正在一项首次人体临床试验 IOV-GM1-201 的多中心 2 期疗效部分进行研究,该试验针对既往接受过治疗的晚期黑色素瘤或 NSCLC 患者。IOV-4001 利用基因编辑 TALEN®技术,从临床阶段的生物技术公司 Cellectis S.A. 或 Cellectis 获得许可,以灭活编码 PD-1 的基因。第二种下一代 TIL 细胞疗法 IOV-5001 正在研究性新药 (IND) 中,使研究成为可能。IOV-5001 是一种基因工程、诱导和系留白细胞介素 12 TIL 细胞疗法,旨在增强 TIL 疗效,同时优化安全性。
●下一代 IL-2:一项 1/2 期临床试验正在进行中,以研究 IOV-3001,一种第二代改良的白细胞介素 2 类似物,用于 TIL 治疗方案。临床前数据表明,与白细胞介素相比,IOV-3001 可能具有更好的安全性,并且需要更少的给药频率。
●其他实体瘤癌症:Iovance TIL 细胞疗法已在 Iovance 和研究者赞助的临床试验中在其他实体瘤癌症中进行了研究。利菲尤塞尔在 2 期 C-145-03 和 IOV-COM-202 临床试验中,在多个转移性 HNSCC 患者队列中评估为单一疗法和与帕博利珠单抗联合使用,在 C-145-04 多中心 2 期临床试验中评估为晚期宫颈癌患者。在 Iovance 支持的研究者赞助的临床试验中研究的适应症包括软组织肉瘤、骨肉瘤、胰腺癌和结直肠癌、铂耐药卵巢癌、甲状腺未分化癌和三阴性乳腺癌。
—————————管线简评————————
TILVANCE-301 :为黑色素瘤提线而进行的III期临床,成功概率应该很高;
IOV-LUN-202:NSCLC末线,中期分析ORR 25.6%(在39例中10例有效),有2例CR,也就是肿瘤消失了,这些经过了PD1、化疗治疗的走投无路的患者居然有5%的概率痊愈(持续性有待观察),这是其他任何一种疗法无法提供的疗效。期待未来更多的数据,感觉这个末线治疗成功的概率很大,而且市场也很大(有钱的患者可以来碰碰运气,1/4概率能续命,5%概率重生);
其他管线看起来规划很好,但没有进一步的数据,只能说理想很丰满,现实很缺钱。
个人体会:
1、随着经验的积累,Amtagvi销售大概还会继续稳步增长,黑色素瘤提线和NSCLC末线这个2个适应症成功概率很高,如果获批,潜在市场规模将有巨大增长;
2、下一代的TIL疗法是未来突破性发展的关键所在,筹到足够的资金是当下的卡脖子问题;
$Iovance(IOVA)$ 作为TIL疗法的全球领军Biotech,首个产品疗效也还可以,至少是验证了TIL疗法的可行性,但在销售扩张、管线推进、产品迭代方面很明显是受到了资金的掣肘,也没有哪个MNC看他们一眼,相比之下国内的Biotech真是太幸福了。