少了1个b,亏了1个亿,长效干扰素冰火两重天
原创 raisepharm raisepharm 医药专利
2026年1月21日 20:18 安徽 3个月内,乙肝治疗领域上演了一场戏剧性的"冰火两重天":一边是10月份特宝生物的派格宾®(聚乙二醇干扰素α-2b)获批全球首个乙肝临床治愈适应症,31.4%的HBsAg清除率奠定其基石地位;另一边是2月20凯因科技的派益生®(培集成干扰素α-2)主动撤回乙肝适应症申请,计提1.11亿元减值。同样是长效干扰素α-2药物,为何结局迥异?难道是少了1个b。派格宾:十年磨一剑,登顶珠峰
2025年10月,特宝生物公告,国家药监局正式批准派格宾(聚乙二醇干扰素α-2b注射液)新增适应症:“本品联合核苷(酸)类似物用于成人慢性乙型肝炎患 者 的 HBsAg 持 续清除。适用于以下患者:核苷(酸)经治、HBsAg 1500 IU/mL以下、持续病毒学抑制、HBeAg阴性或HBeAg 10 COI以下的慢性乙型肝炎患者”。

这一获批基于一项多中心、随机对照III期临床研究CTR20191917——聚乙二醇干扰素α-2b注射液联合替诺福韦治疗慢性乙型肝炎患者的多中心、随机、对照研究。显示停药24周后31.4%的患者实现HBsAg转阴且HBV DNA持续抑制,达到功能性治愈标准。更关键的是,停药2年后约90%患者维持疗效,复发率极低。
研究纳入 NA 经治、HBV DNA < 100 IU/mL、HBeAg < 10 COI、HBsAg < 1,500 IU/mL 的慢乙肝患者,随机分配至三个治疗组:TDF(替诺福韦酯(Tenofovir disoproxil)) 单药治疗(组 1)、TDF 联合 PegIFNα-2b 180 μg/w(组 2)和 TDF 联合 PegIFNα-2b 90 μg/w(组 3);同时设有初治患者,接受 TDF 联合 PegIFNα-2b 180 μg/w 治疗(组 4)。为了确保更多患者获益,组 1 中的患者在第 48 周可选择继续 TDF 单药治疗(组 1a)或加用 PegIFNα-2b 180 μg/w(组 1b)。整个研究过程包括 144 周的治疗期(「用 8 周停 4 周」的给药模式。)和 24 周的随访期。主要终点也是唯一终点——治疗结束后随访24周时HBsAg阴转率。
该研究注册受理号CXSL1900018,于2019-11-18开始,纳入33个中心,475例受试者,2023-12-07结束,历时4年有余。2024年月申报上市,受理号:CXSS2400023、CXSS2400024、CXSS2400025、CXSS2400026。
治疗结束后随访 24 周时,组 2 实现 HBsAg 清除且 HBV DNA 检测不到的患者比例大于 30%。
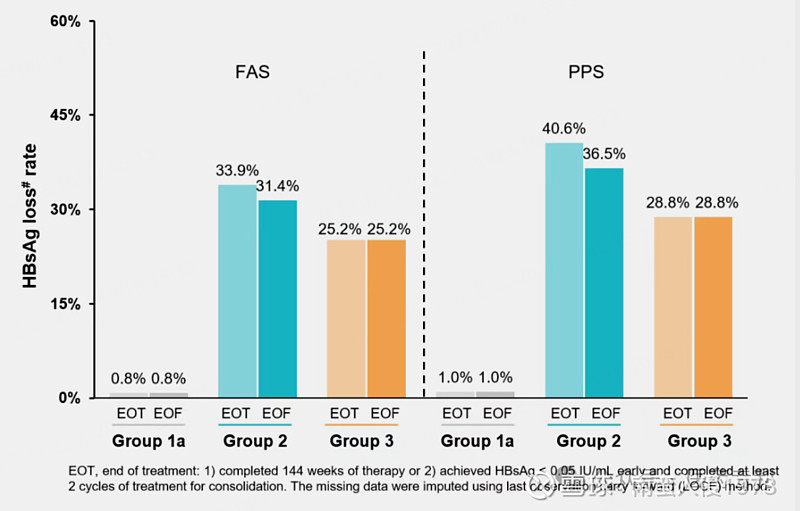
在 52 周延长随访(即完成治疗后停药 76 周)时,组 2 中已治愈患者的临床治愈状态维持率高达 100%。
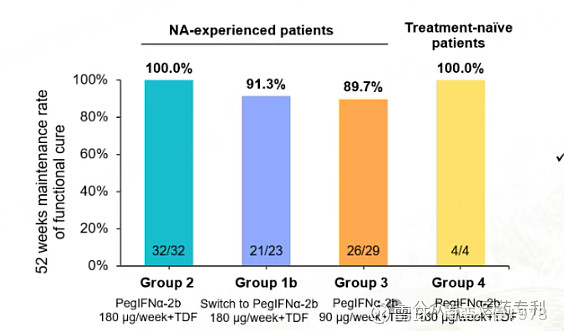
持续随访至 104 周时,这一比例仍稳定在约 90% 的高位。
派格宾是厦门特宝自主研发的全球首个40kD聚乙二醇长效干扰素α-2b注射液,是治疗用生物制品国家1类新药,是我国第一个国产上市的聚乙二醇(PEG)修饰干扰素品种。派格宾于2016年10月获批上市,获批适应症为治疗成人慢性丙型肝炎;2017年9月获批成人慢性乙型肝炎适应症。
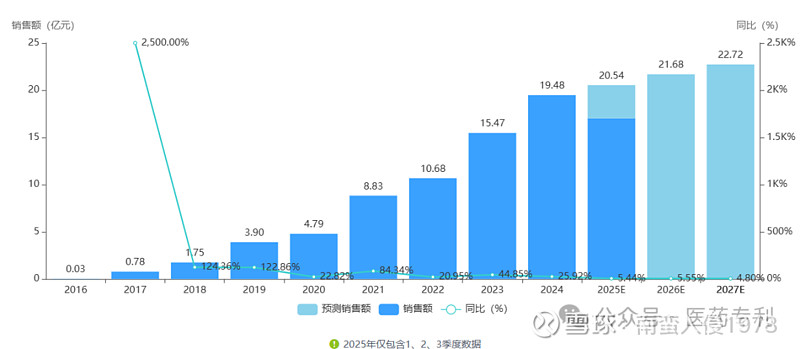
派格宾2024年销售额19.5亿元,2025年前3季度销售17亿,全年预计23亿元。累计销售83亿元。
派益生:全球首个注册研究,遗憾折戟
2025年1月20日,凯因科技发布公告,主动撤回派益生新增乙肝适应症(派益生联合富马酸丙酚替诺福韦片(TAF)用于治疗成人慢性乙型肝炎(HBV)优势人群)的注册申请。该研究本为"全球首个挑战长效干扰素48周联合核苷类,以HBsAg转阴为终点的注册临床研究",数据显示能将>50%低HBsAg人群降至10 IU/mL以下,超过20%患者实现HBsAg清除。

撤回原因:根据国家药监局最新审评建议,需"进一步补充临床病例研究"。公司基于谨慎性原则,对该项目1.11亿元开发支出全额计提减值。
培集成干扰素α-2注射液,原名聚乙二醇化重组集成干扰素变异体注射液,是经PEG修饰的重组集成干扰素,其中重组集成干扰素是通过对14种天然α-干扰素亚型进行序列同源性比对,遵循同源序列最高原则分析集成获得,活性比一般α型干扰素更高,半衰期长,适合一周一次给药,具有较好的便利性,其兼备抗病毒、免疫调节作用,是追求慢性病毒性乙型肝炎临床治愈的药物之一,为凯因科技自主研发的新型长效干扰素。该产品于2018年获得药品注册批件及新药证书,用于治疗成人慢性丙型肝炎(HCV),是已批上市药品。2024年9月,公司新增申报派益生联合富马酸丙酚替诺福韦片(TAF)用于治疗成人慢性乙型肝炎(HBV)的适应症。
该适应症临床研究CTR20213197——多中心、随机、 双盲、 安慰剂对照评价培集成干扰素α-2注射液治疗低复制期慢性HBV感染Ⅲ期临床试验,是全球第一个挑战长效干扰素48周联合核苷类,对照为单独核苷TAF,干扰素疗程48周,主要终点仅1个,转阴率——72周时血清HBsAg消失率(HBsAg低于定量检测下限LLOQ 0.05 IU/mL定义为消失)。时间2021-12-28~2023-12-01,入组376例。
研究结果证实长效干扰素具有使优势患者人群HBsAg转阴疗效,其中能将50%以上低HBsAg水平及干扰素应答等部分人群的HBsAg降至10IU/mL以下,超过20%患者的HBsAg实现清除,患者获益明显。
研究完成后2024年9月申报上市,并发布了受理公告。
 1月21日,凯因科技股票狂跌13.23%,利润减少1.1亿元,股票市值损失5.9亿元。
1月21日,凯因科技股票狂跌13.23%,利润减少1.1亿元,股票市值损失5.9亿元。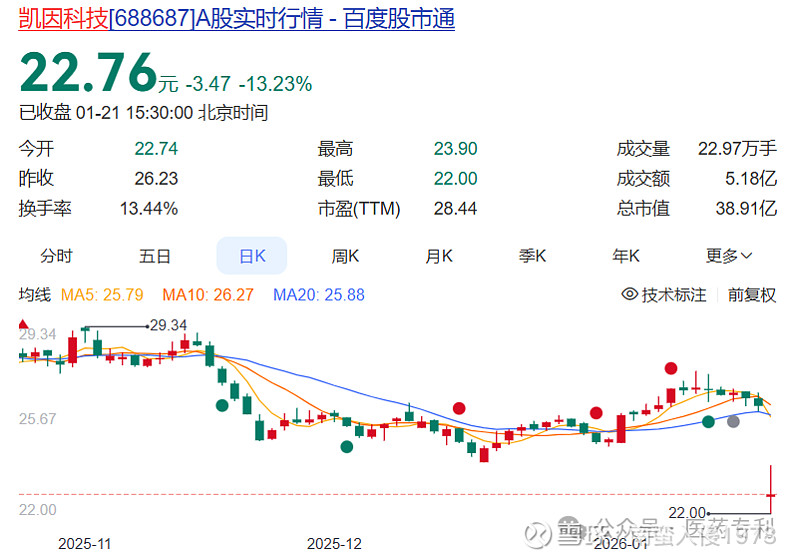
凯因科技的干扰素α-2b带来超50亿的收入,为啥不用α-2b,而是用集成的α-2来做PEG化呢?甚至是干扰素α-2b阴道泡腾片用的都是纯的α-2b,也是凯因主要收入来源。
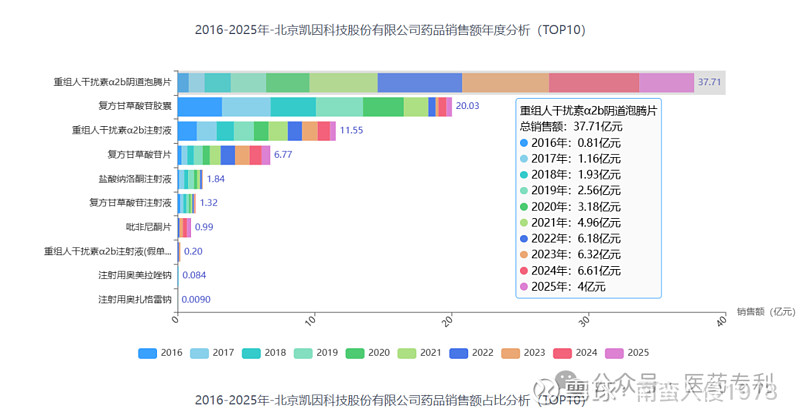
两者什么样的差异导致冰火两重天,大家来找茬
中国作为乙肝大国,慢性 HBV 感染人群高达 7,500 万,但 2022 年我国慢乙肝诊断率仅为 22%,治疗率仅为 15%,提示我国在肝炎诊治之路上仍「道阻且长」。2015 年,中国《慢性乙型肝炎防治指南》 首次明确将临床治愈作为治疗目标,定义其为停药后持续的病毒学应答及 HBsAg 清除、并伴有 ALT 复常和肝脏组织病变改善。
临床治愈对于慢乙肝患者意义重大。研究数据显示,未接受抗病毒治疗的慢乙肝患者肝癌发生率为 14.9%,接受抗病毒治疗者可降至 10.7%,而实现临床治愈的患者,这一风险显著降低至约 1%。
需要强调的是,实现临床治愈的核心关键在于「停止治疗后持续保持 HBsAg 阴性」,其中「HBsAg 持续清除」的关键要点。
2023 年,国家药品监督管理局药品审评中心(CDE)发布了《慢性乙型肝炎病毒感染治疗药物临床试验技术指导原则》,治疗周期至少48周,明确将「停止所有治疗药物后 HBsAg 清除且 HBV DNA 持续抑制 ≥ 6 个月」作为有限疗程的新药确证性临床试验的关键终点标准。
干扰素α2a是由165个氨基酸组成的单链多肽,干扰素α2ab的23 位氨基酸由赖氨酸替换为精氨酸。