【招商医药】2025 WCLC 肺癌大会:市场关注Summit亚组分析以及BD
■ 肺癌作为发病人数最多的癌种,是医学界和投资界最受关注的细分领域。阿斯利康和强生在1L EGFR驱动阳性NSCLC取得突破,晚期肺癌患者生存获益延长,生存期取得进展同时医生更关注亚组及长期安全性
■ AK112同样备受瞩目,此次展示的中期分析,存在亚洲和欧美人群的入组及数据成熟的时间差,短期市场回调反应其高预期的修复
■ 股票推荐:诺华制药(NVS US),礼来制药(LLY US),翰森制药(3692 HK),百济(6160 HK/ONC US),康诺亚(2162 HK)
EGFR突变型转移性非小细胞肺癌一线治疗:二龙戏珠
9月6-9日由国际肺癌研究协会(IASLC) 举办的世界肺癌大会 (WCLC 2025)在西班牙巴塞罗那召开,该会议聚焦肺癌、间皮瘤、胸腺瘤等所有胸部肿瘤领域,期间发布了多项改变临床实践的重磅研究。
我们之前6月份做过ASCO大会的系统性梳理,其中已经涉及到肺癌领域的最新临床突破。而在这次会议中,来自阿斯利康和强生的两项三期试验,都针对EGFR突变型转移性晚期mNSCLC人群的一线研究,均披露了最终的OS(整体生存期)数据。
阿斯利康支持的FLAURA2研究 (NCT04035486),是首个三代TKI+化疗的成功,揭示了奥希替尼联合化疗在治疗EGFR突变型NSCLC上的卓越疗效,奥希替尼(osimertinib)联合铂类化疗对比单药osimertinib,HR 0.77,3年OS率63% vs 51%。
强生支持的MARIPOSA研究(NCT04487080),是首个三代TKI+EGFR/cMET双抗联合,Amivantamab联合Lazertinib对比osimertinib,HR 0.75,3年OS率60% vs 51%。我们在正文对这两大三期结果做了进一步分析和研究。
HARMONi试验:二线EGFRm不同区域的亚组分析出现争议
从关注度来讲,HARHONi作为Summit公司第一个海外三期研究,初次披露了包含中国及海外受试者的临床数据。Summit公司此次公布的HARHONi三期,探究AK112双抗叠加化疗药物,对比安慰剂叠加化疗药物在针对2L EGFRm nsqNSCLC病人(EGFR突变型NSCLC患者此前用过三代TKI如osimertinib失败)中的疗效。
该三期研究入组438例患者,实验组及对照组各半,但从亚组的分布来看,来自亚洲的人群为273例,北美及欧洲为165例(北美93例)。HR作为代表总生存期(Overall Survival)的风险比的关键指标,在HARHONi三期亚组分析中,亚洲人群的HR 0.76,而北美及欧洲为0.84,从获益趋势上中国人和欧美人群一致。此外不同地区亚组在mPFS的长期跟踪(LTF, Long-term follow)的风险比上也有12%的差异。
期待之后更大样本量的一线三期试验提供更好OS显著性。
在愈演愈烈的肿瘤研发市场,不同的试验设计和结果带给我们的启示
在肿瘤新药研发和临床试验研究不断迭代的今天,我们看到中国的确涌现出许多创新型非常强的分子,寄希望于更新的治疗机制MoA来提升对肿瘤的应答和疗效。
同时我们也看到,监管方在不断提升对新药审批原则的标尺,从基于单臂疗效即可上市,到需要严格遵守随机对照临床试验,且取得针对PFS和OS双终点的优势,这都是国际上针对肿瘤新药审评原则提升的体现。
这些带给肿瘤研发企业更大的挑战,临床端对照组的设计以及样本人群背景的考虑。从阿斯利康和强生的例子,针对同一类mNSCLC肺癌人群,除了比较整体的临床数据,亚组分析也成为临床选择的侧重考量;疗效以外,医生及患者也更加关注安全性的平衡,比如化疗药物的使用时长及不良反应的管理。
EGFR突变型转移性非小细胞肺癌一线治疗的两个重要三期临床试验分析:亚组人群分析的重要性
关于肺癌的分类(组织学及驱动基因分型)以及不同生物标志物下的1L和2L标准疗法的最新医疗学术共识,我们曾经在2025年6月份ASCO整理报告已经写过,不赘述。

而此次WCLC大会上,针对1L mEGFR肺癌治疗的两个大型三期临床研究备受关注:
1. FLAURA-2试验(NCT04035486):三代TKI+化疗联合奥希替尼(osimertinib)联合铂类化疗对比单药osimertinib,HR 0.77,3年OS率63% vs 51%。
2. MARIPOSA试验(NCT04487080):三代TKI+EGFR/cMET双抗联合,无化疗方案Amivantamab联合Lazertinib对比osimertinib,HR 0.75,3年OS率60% vs 51%。
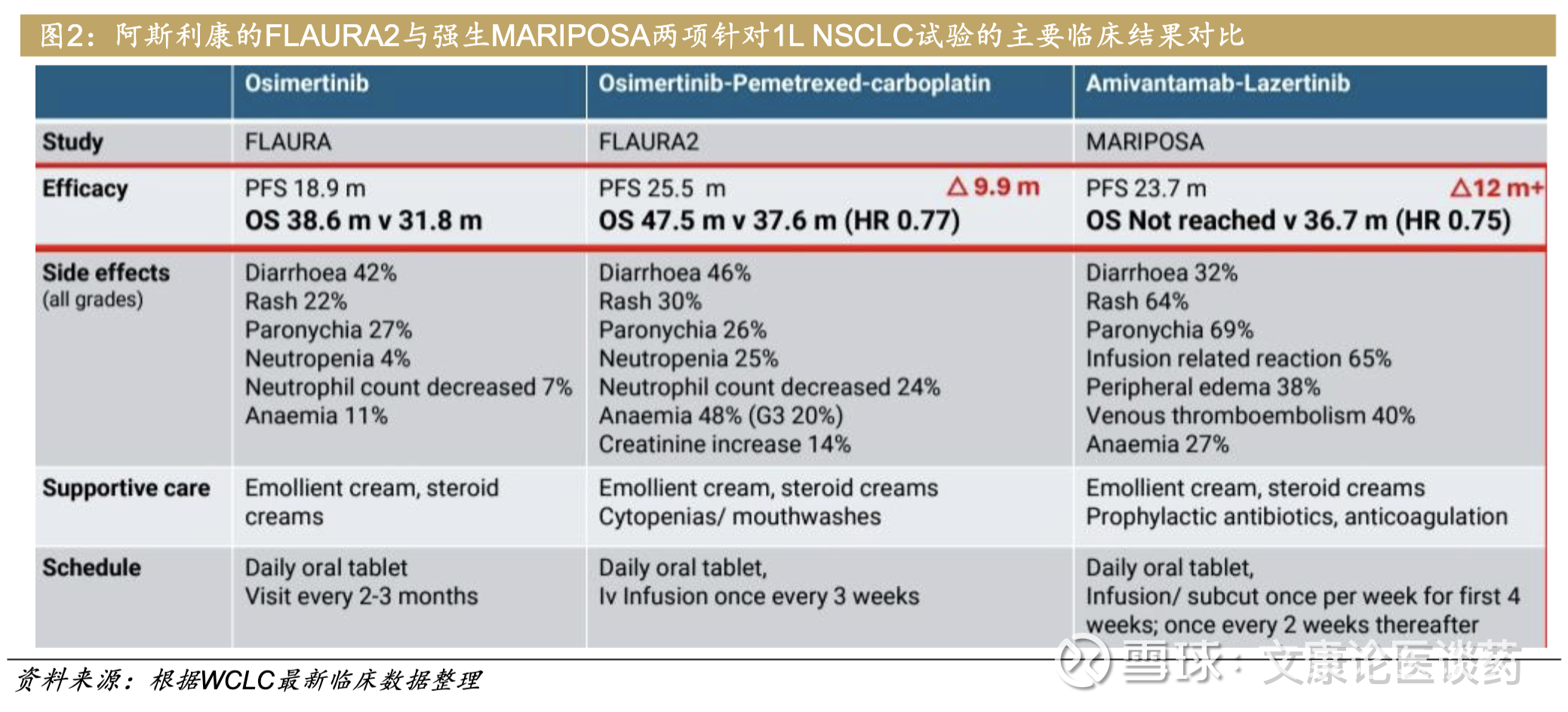

如此长的OS数据,的确让医生眼前一亮。但在临床医生眼中,OS的延长更像是锦上添花。比如FLAURA-2的PFS(无进展生存期)早已在早期临床报告中显示出获益,如今OS的确认是水到渠成。更重要的是医生会考虑以上的组合疗法是否能带来长期的生存获益?从临床特征、分子标志物和ctDNA动态监测上该如何整合?这些问题凸显了肿瘤学个性化医疗的复杂性。联合疗法潜力巨大,能延迟耐药、改善中枢神经系统控制(如脑转移管理),但挑战同样严峻:毒性增加、成本飙升、复杂耐药机制(如C797S突变或MET扩增)。针对耐药人群的CNS转移,也是未来肺癌后线研究的重点之一。
针对1L肺癌人群,安全性也不容忽视。部分医生对强生的Ami双抗的毒性问题,心有余悸。在大会讨论环节,有医生也针对三代TKI+化疗联合的FLAURA-2试验组方案,患者与FLAURA-2一起服用培美曲塞多长时间提出了讨论:
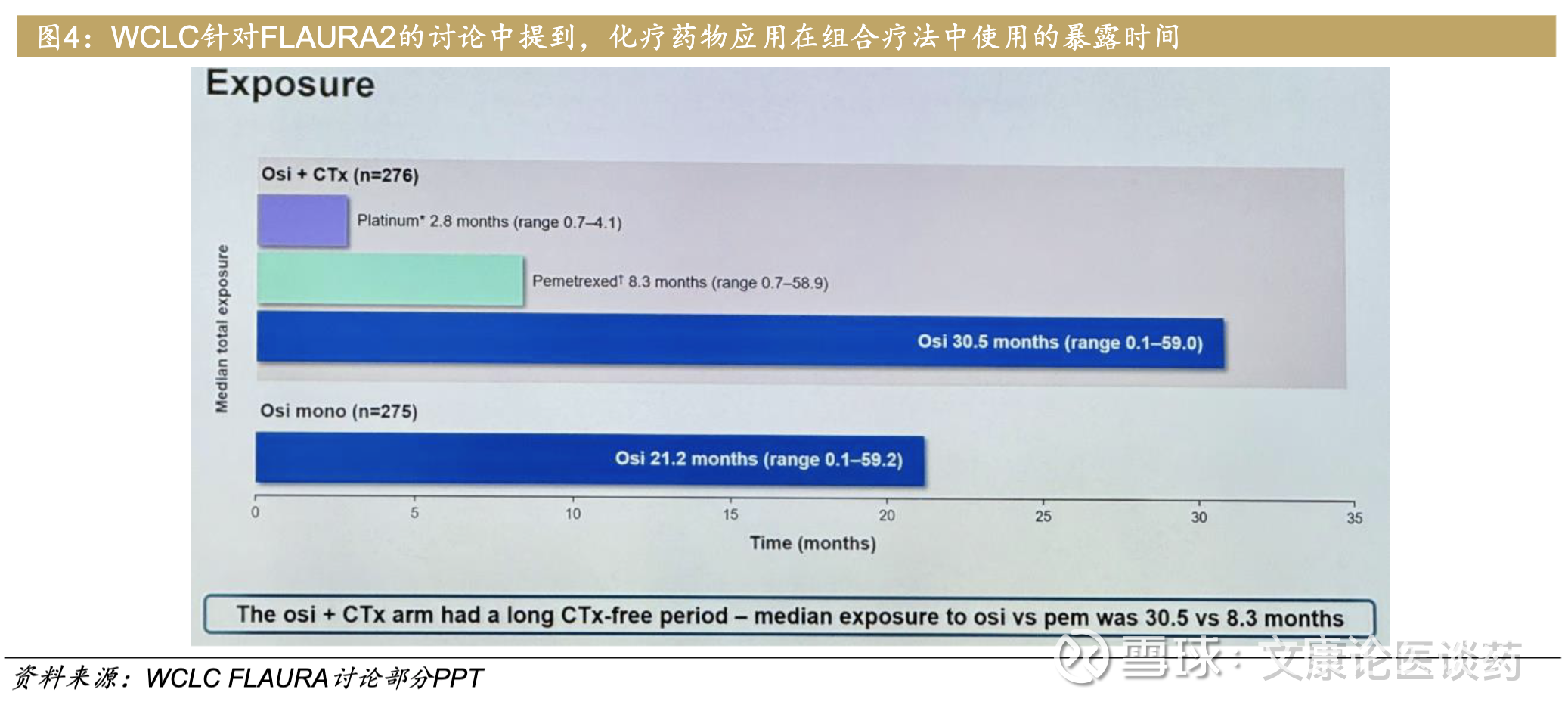
在FLAURA-2试验中,患者的平均培美曲塞暴露时间仅8.3个月,50%因副作用停药。这种组合依然存在一定的毒性,时可能对用药的长期维持带来影响,如身体毒性(化疗副作用)和精神毒性(患者负担)。
拿MARIPOSA研究与FLAURA-2进行比较,数据很难直接给结论,部分医生认为,患者个体化的治疗才是未来方向。双靶点策略带来显著PFS和OS获益,但额外毒性、输注负担和财务冲击不容忽视。成本影响尤为关键:化疗+TKI或抗体+TKI虽提升疗效,却推高了负担。临床医生需要工具来平衡疗效 vs 毒性 vs 负担;公司应投资生物标志物研究和QOL评估。这就是精准医学的格局:FLAURA-2的实质改进,凸显了肿瘤反应、脑转移管理和后续策略的重要性。
HARMONi:OS亚组分析出争议,但欧美人群入组效率低于东亚,目前OS数据依然不够成熟
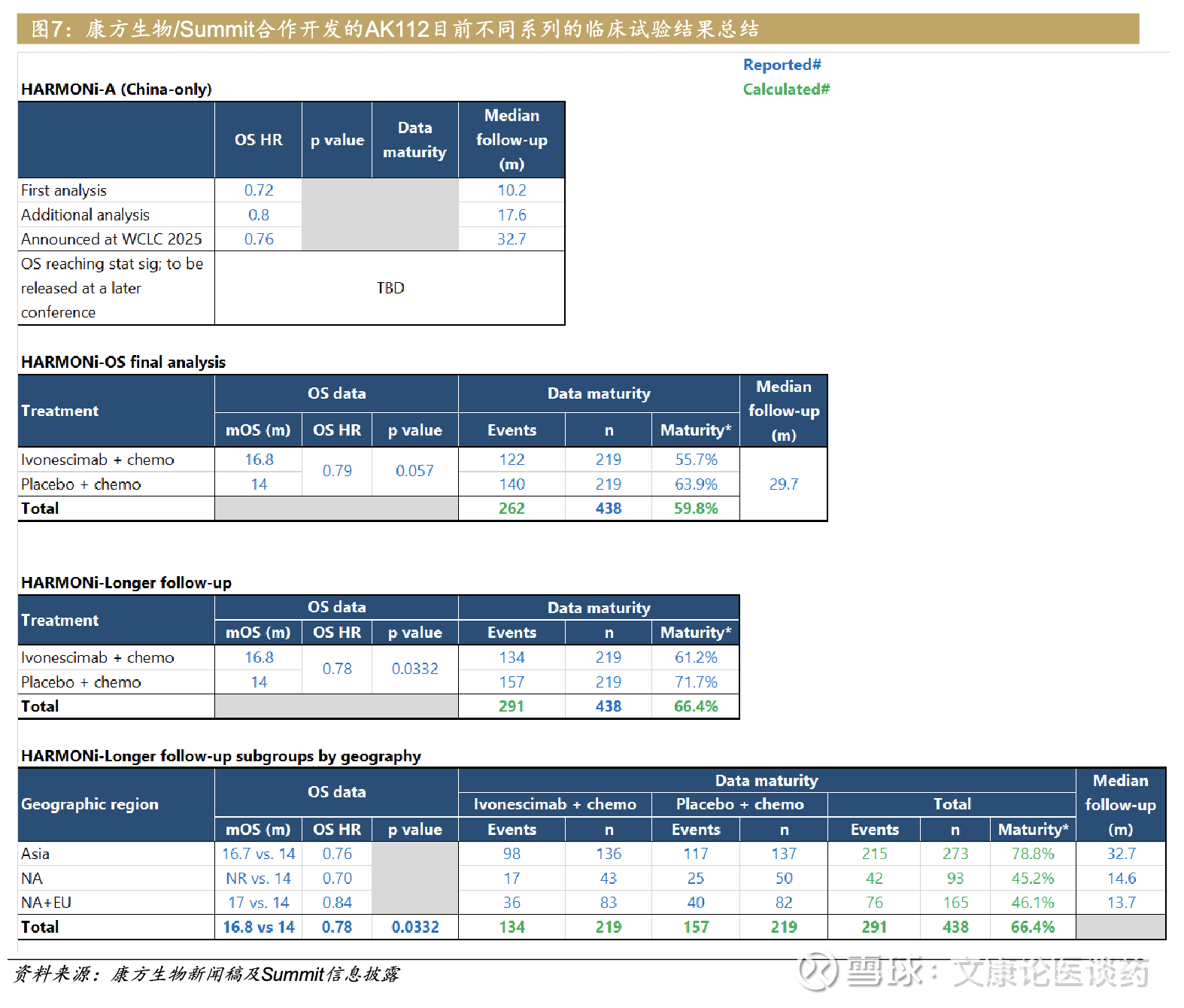
来自Summit/康方共同开发的AK112的HARMONi试验,针对EGFR突变型NSCLC 2L患者(此前使用三代TKI如osimertinib失败)。一共入组438例患者,入组人群包括从2022年1月至2022年11年入组的中国患者,以及从2023年5月至2024年10月入组的西方国家患者。人种构成上,北美加欧洲有37%,白人有1/4.

该研究设置了OS和PFS双首要终点,次要终点为ORR。患者首先在中国入组,随后在北美和欧洲的西方区域入组。因此,在Summit对两个主要终点(PFS和OS)进行预设的主要分析时,大多数事件是由中国驱动的。西方国家的患者随访时间大约9个月,目前并不成熟。未来公司将对这一人群做更长随访跟踪。
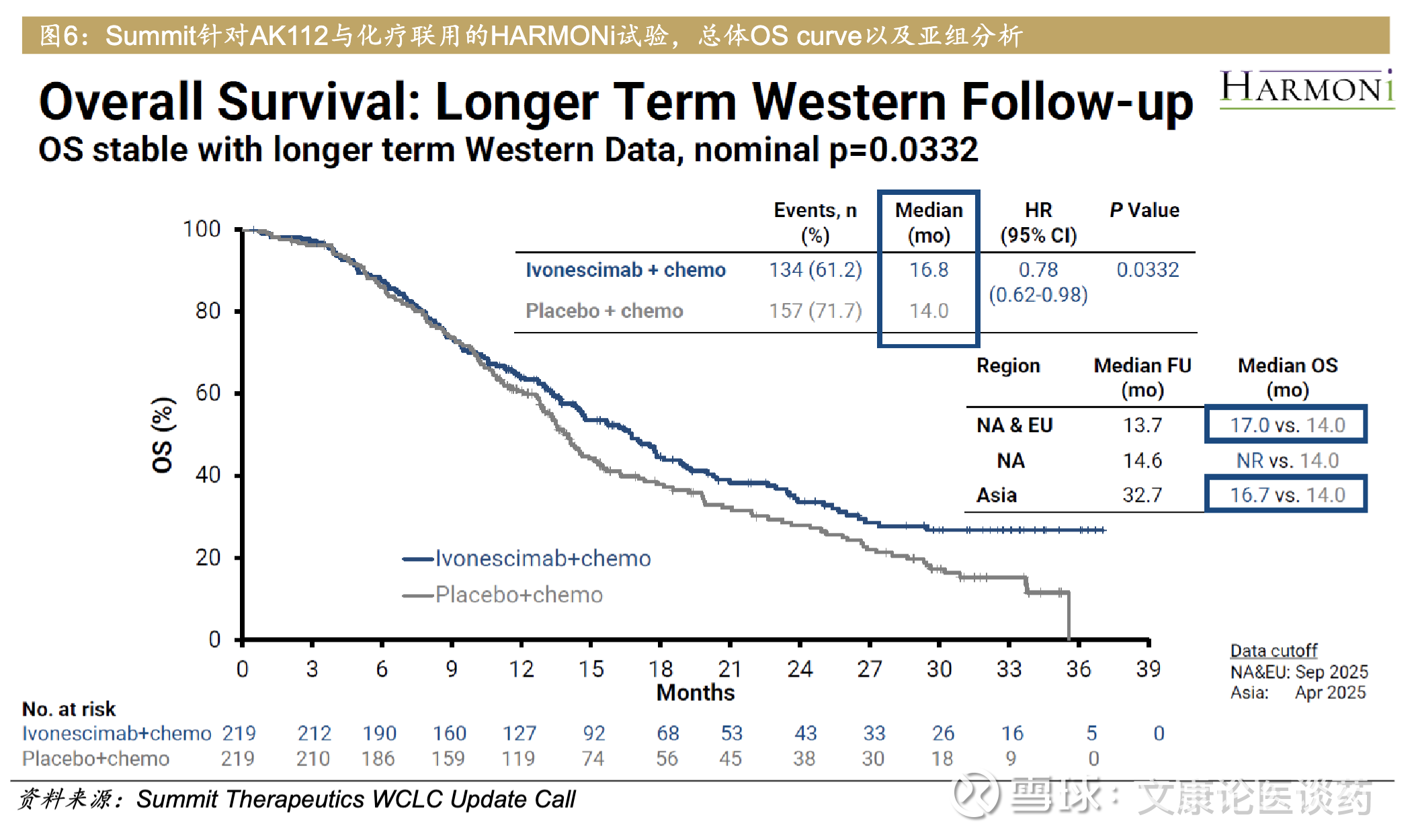
该全球临床的OS数据,首次在WCLC上亮相,整体患者中试验组OS中位16.8个月 vs 对照组14.0个月,基于西方患者(NA&EU)中位随访13.7个月,亚洲患者约32.7个月。试验组(ivonescimab联合化疗组)中位PFS 6.8个月 vs 对照组(单独化疗组)4.4个月,主要分析HR 0.52(p<0.0001);更长随访HR 0.57。长期随访PFS(LTF PFS),整体获益趋势和第一次初步分析的一样,北美+欧洲HR 0.67,一方面PFS获益可能确实比亚洲差一点,另一方面也是受制于这部分人群样本量小,样本量小的情况下,HR很难做的很漂亮。
其他指标包括:ORR 45% vs 34%,DCR 84% vs 73%,DoR 7.6个月 vs 4.2个月。PFS获益明确,OS趋势阳性,数据尚未完全成熟。
当我们观察各个亚组时,需要重点强调的是亚组的规模较小。根据定义,它们本身并不旨在具有统计学显著性,但亚组分析仍然可以提供很多信息。PFS的亚组分析证实了所有预设亚组均获益,表现为每个亚组的绘图点落在分界线的左侧,有利于ivonescimab。
之前康方针对中国版HARMONi-A,公布数据为中位PFS 7.1个月 vs 4.8个月(HR 0.46,p<0.0001),ORR提升15%(全球版仅11%),其余类似。但OS数据尚未成熟。
而此次WCLC会议的讨论环节,来自Emory大学Winship癌症中心的Suresh Ramalingam医生作为特邀讨论者(leading discussant),提出该分子在mNSCLC病人中,PFS益处类似先前NSCLC中VEGF抑制剂(如贝伐珠单抗),PD-1阻断贡献不明显,毒性符合预期。但在EGFR突变肿瘤中,免疫疗法响应传统较差,双重机制本应放大,却未见明显优势,引发对IO(免疫疗法)在该亚型中角色的疑问。

PD-L1 ADC分子设计和初步临床结果对比
PD-L1在多种肿瘤类型中广泛表达,不具备分泌性,通常表达于肿瘤浸润免疫细胞,并在与单克隆抗体结合后发生内化,这些特性使其成为抗体药物偶联物(ADC)开发的一个极具吸引力的靶点。目前有两个PD-L1 ADC药物进入临床,PF-08046054(辉瑞)和HLX43(复宏汉霖),二者都是用PD-L1抗体连接毒素,旨在免疫治疗的过程中精准的杀灭癌细胞。虽然二者看似形式相同,但在药物设计上却有大不同。下表是两个分子在设计上的比较:
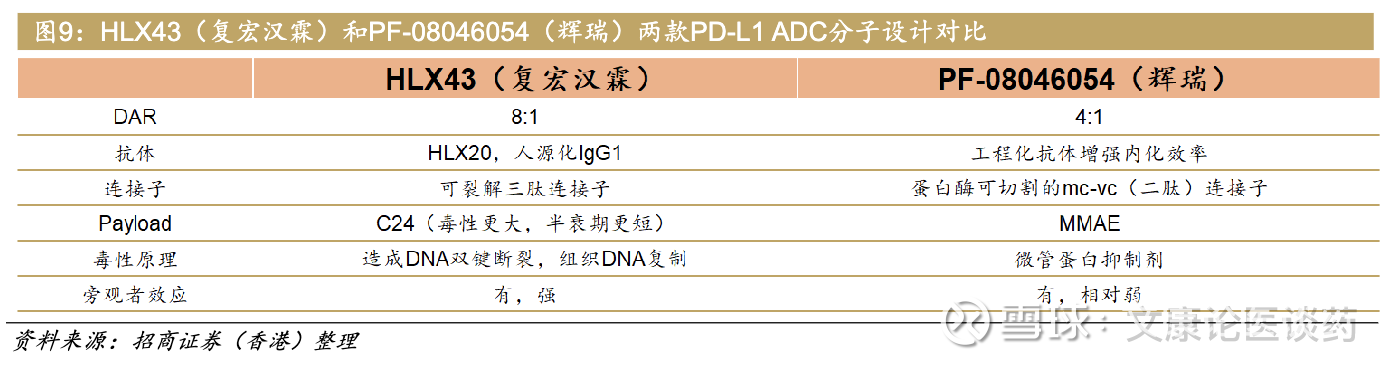
PF-08046054的连接子和payload采用的是比较成熟的vc-MMAE系统, DAR 值约4,意味着每个抗体分子携带四个毒素分子。vc-MMAE中的 “vc”代表 valine-citrulline(缬氨酸-瓜氨酸),这是一个可被组织蛋白酶特异性识切的二肽序列。组织蛋白酶是一种在溶酶体中含量丰富的蛋白酶,在ADC被内化后,组织蛋白酶会精确地切割缬氨酸和瓜氨酸之间的肽键,释放毒素。MMAE毒素就从抗体上被释放下来,成为游离状态。由于其疏水性,它能自由扩散到细胞质中。
HLX43使用的是可裂解三肽连接子,将抗体与新型毒素 C24 (拓扑异构酶 I 抑制剂类分子,能够在肿瘤细胞内引发 DNA 双链断裂,直接诱导凋亡)紧密结合,其药物抗体偶联比约为8,即一个抗体带有8个毒素分子。该新型连接子-payload可在肿瘤微环境中被优先激活并裂解,实现不依赖于ADC内化过程的肿瘤特异性毒素释放。同时,也可内吞后释放毒素PD-L1表达的细胞。也就是说,HLX43抵达肿瘤的微环境中,毒素就会被裂解释放,不完全依赖PD-L1抗体内化。
临床结果

辉瑞所选择的HNSCC(头颈鳞癌)、NSCLC(非小细胞肺癌)、ESCC(食管鳞癌)、TNBC(三阴乳腺癌)、OVC(卵巢癌)都具有一个共同点即PD-L1高表达常见,确保了ADC能够靶向结合。HLX43的适应症选择更为大胆和广泛,除了NSCLC外,还在探索结直肠癌、胸腺癌、鼻咽癌、胃癌、食管癌、肝细胞癌、宫颈癌、头颈癌等多个瘤种。复宏汉霖的策略是“广撒网”,覆盖中国高发瘤种(肺癌、肝癌、食管癌、鼻咽癌等),探索数据积累差异化证据。
小细胞肺癌领域DLL3的进展
小细胞肺癌(SCLC) 是一种侵袭性神经内分泌癌,占所有诊断肺癌的13-15%。全球每年诊断出约260,000例新病例。
广泛期疾病(ES-SCLC,大约占约65-70%的患者)的5年生存率不到10%,有限期(LS-SCLC)疾病的5年生存率为15%。过去30多年SCLC系统治疗仅含铂双药(EP/IP)可用,存在极大的为满足需求。
近年来,小细胞肺癌新靶点不断取得临床突破,包括B7H3、DLL3、SEZ6等,显著改善了晚期小细胞肺癌患者的预后。
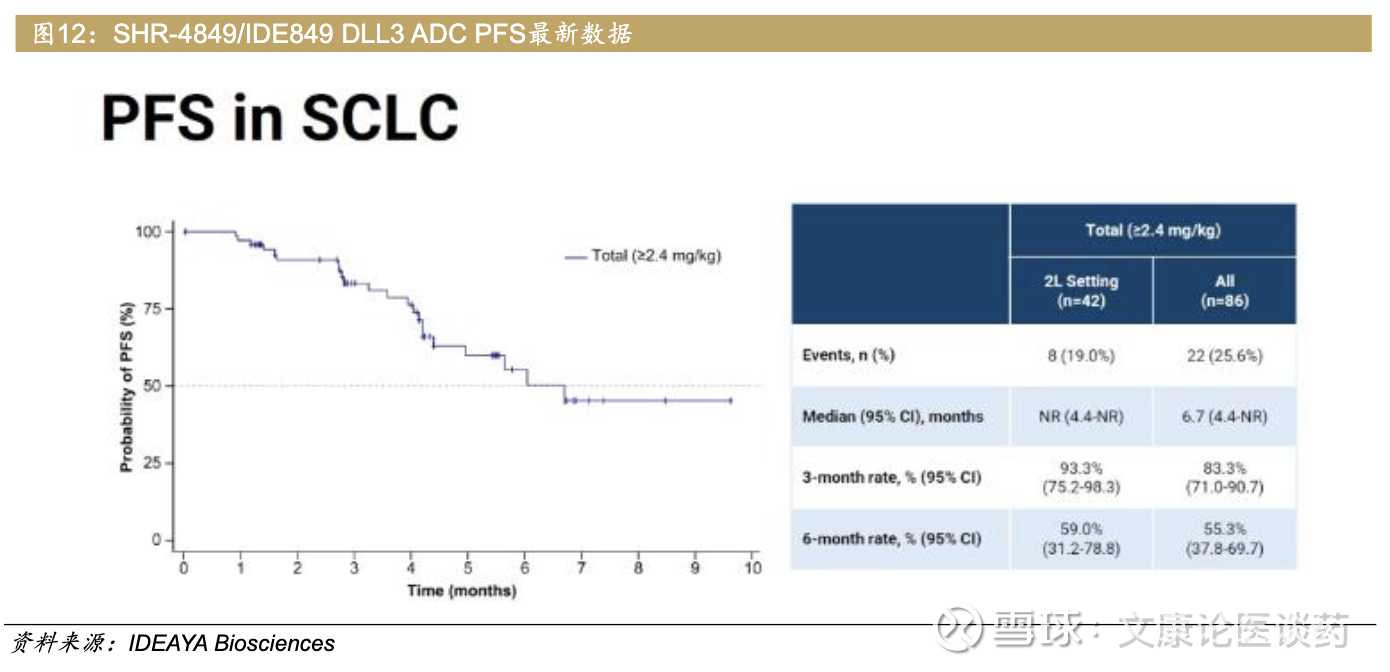
IDEAYA Biosciences今年从恒瑞医药引入了DLL3-ADC,也在WCLC会议上汇报了DLL3 ADC的一期临床最新数据。该一期临床方案设计如下,共入组100例患者接受治疗。
Amgen 3期DeLLphi-304试验(NCT05740566):
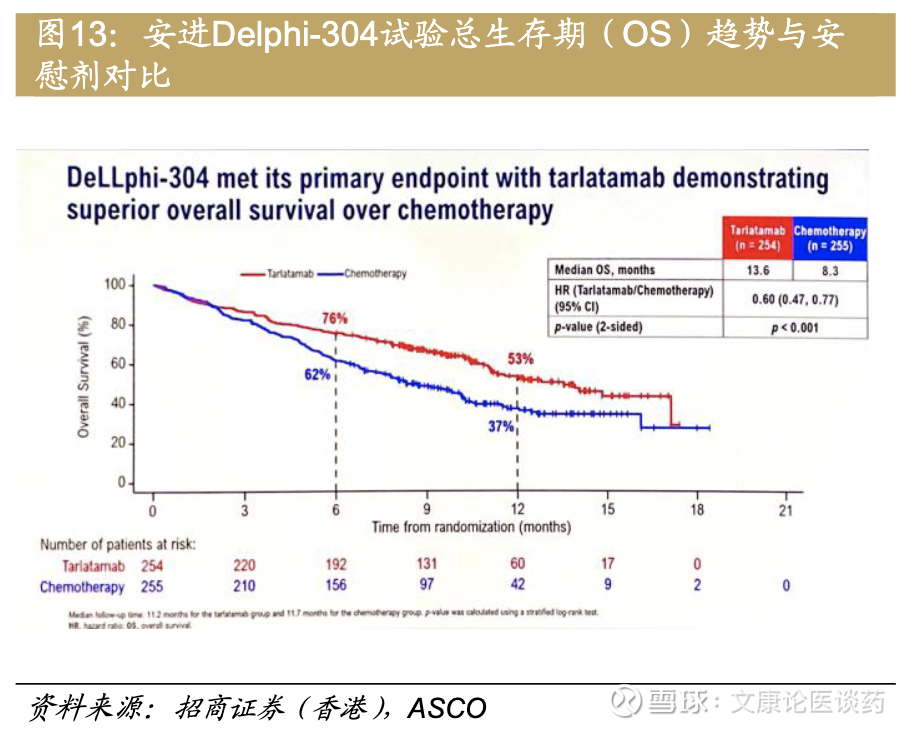

在中位随访11.2个月时,接受Tarlatamab治疗的患者(n=254)的中位随访时间为11.7个月,接受化疗的患者(n=255)的中位随访时间为11.2个月,Tarlatamab的中位OS为13.6个月,而化疗的中位OS为8.3个月(HR,0.60;95%CI,0.47-0.77;双侧P<.001)。在Tarlatamab治疗组,6个月和12个月的OS率分别为76%和53%。化疗组的6个月和12个月OS率分别为76%和53%,而化疗组分别为62%和37%。
Tarlatamab治疗组的中位PFS为4.2个月,化疗组为3.7个月。Tarlatamab治疗组和化疗组的6个月PFS率分别为31%和23%;12个月PFS率分别为20%和4%。
除了DLL3-ADC以外,目前也鉴定出SEZ6是在选定神经元谱系细胞的细胞表面上发现的跨膜蛋白。通过 mRNA 表达分析和 IHC,SEZ6是SCLC 中高表达的表面标志物,而在正常组织中表达有限,这一特性使其成为ADC药物的理想靶标。2025年9月4日,艾伯维在Clinicaltrials.gov网站上注册了SEZ6 ADC新药ABBV-706+PD-L1抗体联合一线治疗广泛期小细胞肺癌患者(ES-SCLC)的2/3期临床试验。三期临床试验计划入组730例晚期ES-SCLC患者,预计2031年完成。在2024年6月ASCO披露的数据中,SCLC组ORR 61%。