【平安证券】EGFR TKI治疗肺癌迭代发展,耐药挑战推动研发升级
平安观点
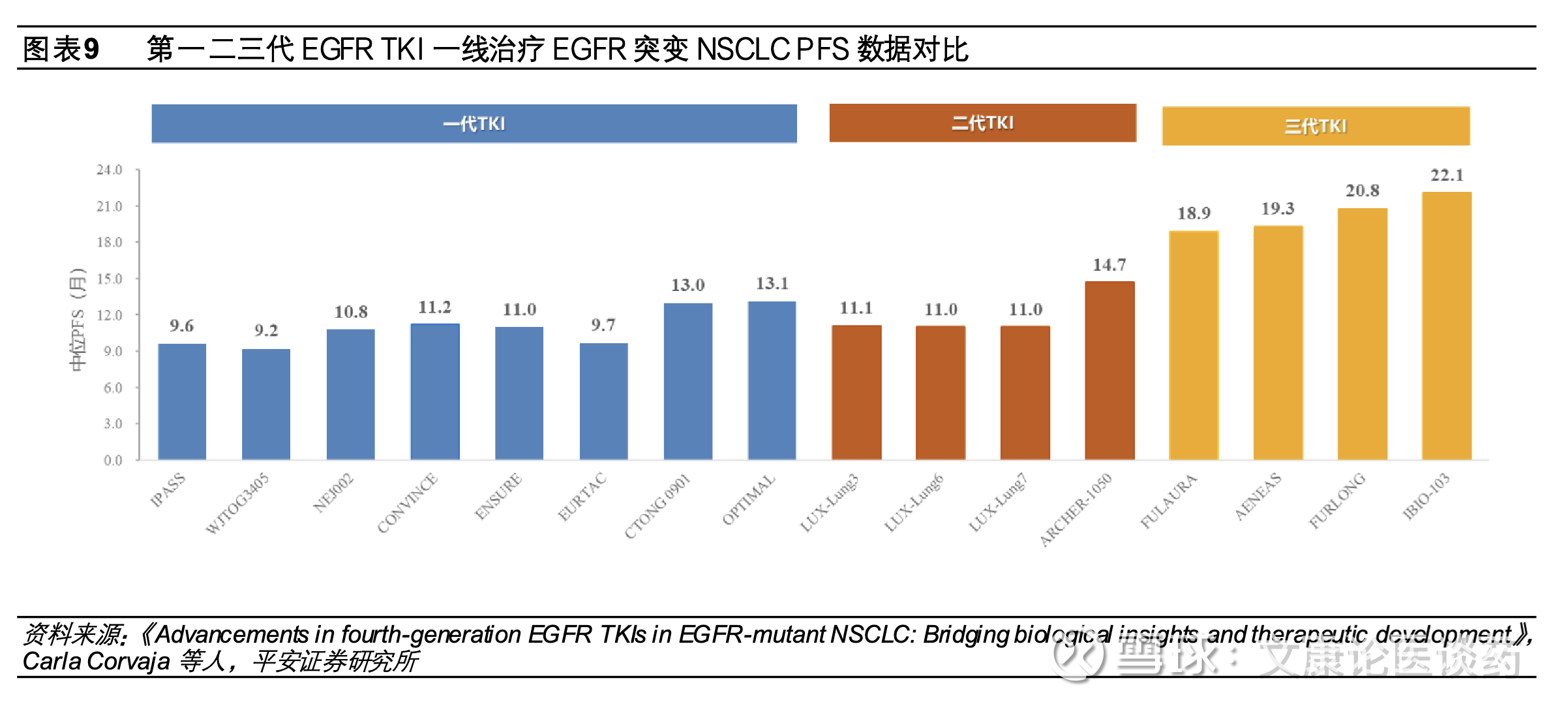
◼ 第三代EGFR TKI已成为晚期EGFR突变NSCLC一线标准疗法。EGFR TKI的发展从第一代到第三代,持续推动晚期 EGFR 突变非小细胞肺癌(NSCLC)患者生存期的延长。目前第三代EGFR TKI凭借其卓越的疗效与良好的安全性,已成为该群体一线治疗的标准方案。第一代TKI(如吉非替尼、厄洛替尼)通过可逆性地作用于 EGFR 酪氨酸激酶结构域的ATP结合位点,抑制EGFR自磷酸化及下游信号通路,将中位无进展生存期(mPFS)从传统铂类化疗的4–6个月提升至9–13个月。第二代TKI(如阿法替尼、达可替尼)则通过与 ERBB 家族不可逆结合,进一步将mPFS延长至11–14个月。第三代TKI能够选择性抑制常见EGFR突变及T790M耐药突变,在临床研究中取得18.9–22.1个月的mPFS,显著优于前两代药物。在安全性方面,第三代TKI对野生型EGFR的影响较小,皮疹、腹泻等不良事件发生率较低,展现出更好的耐受性。总体来看,每一代EGFR TKI的疗效均呈现出相应的“平台期”特征,而第三代药物在整体生存获益上实现突破,目前已成为晚期EGFR突变NSCLC一线治疗的首选。
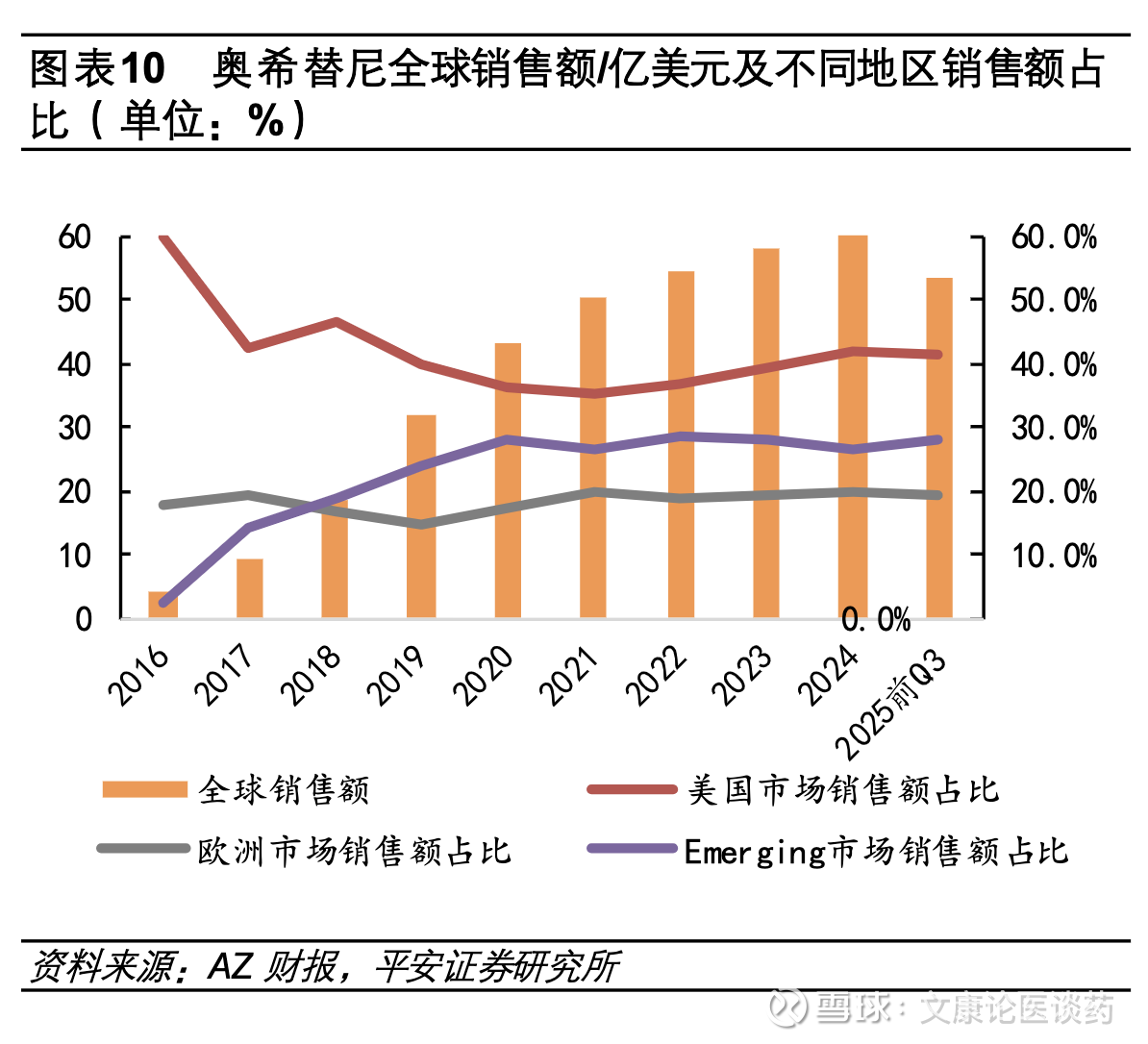
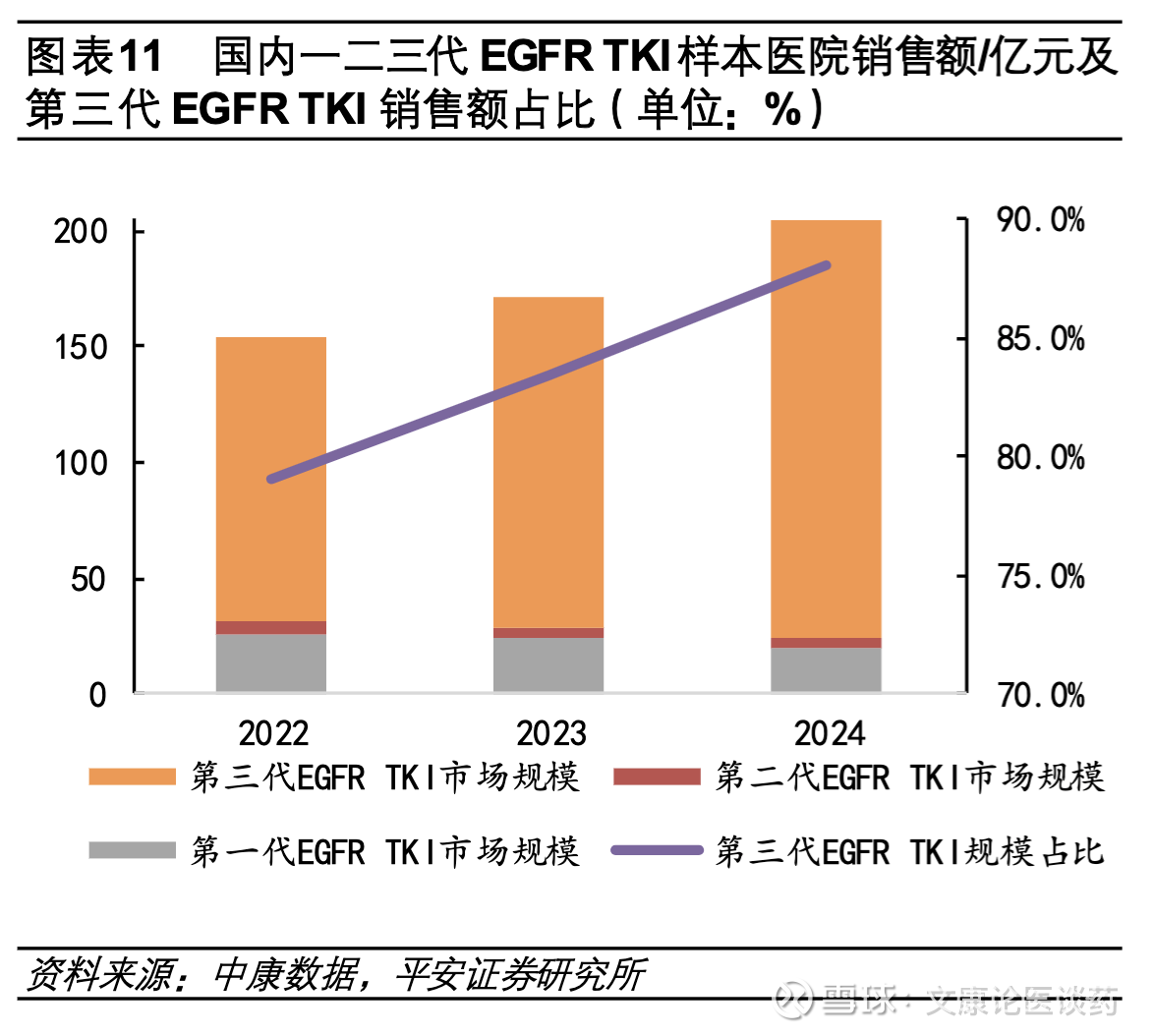
◼ 第三代EGFR TKI国内外市场规模放量及市占率持续提升。2024年国内EGFR TKI市场规模突破200亿元,三代EGFR TKI占比高达88%。作为首个获批的第三代EGFR TKI,奥希替尼自2015年在美国加速获批以来,全球销售额持续增长。2024年其全球销售额达65.8亿美元,从区域分布来看,奥希替尼美国市场贡献全球销售额42.0%,欧洲市场占19.8%,新兴市场(包括中国)占 26.7%,奥希替尼在 EGFR 突变非小细胞肺癌(NSCLC)一线治疗中的优势,是其商业成功的基础。国内市场来看,2024年中国EGFR TKI市场总销售额突破204.4亿元,同比增长19.5%。其中第三代EGFR TKI(包括奥希替尼、阿美替尼、伏美替尼等)贡献了179.9亿元,占整体市场的88%,标志着三代药物已确立市场核心地位。
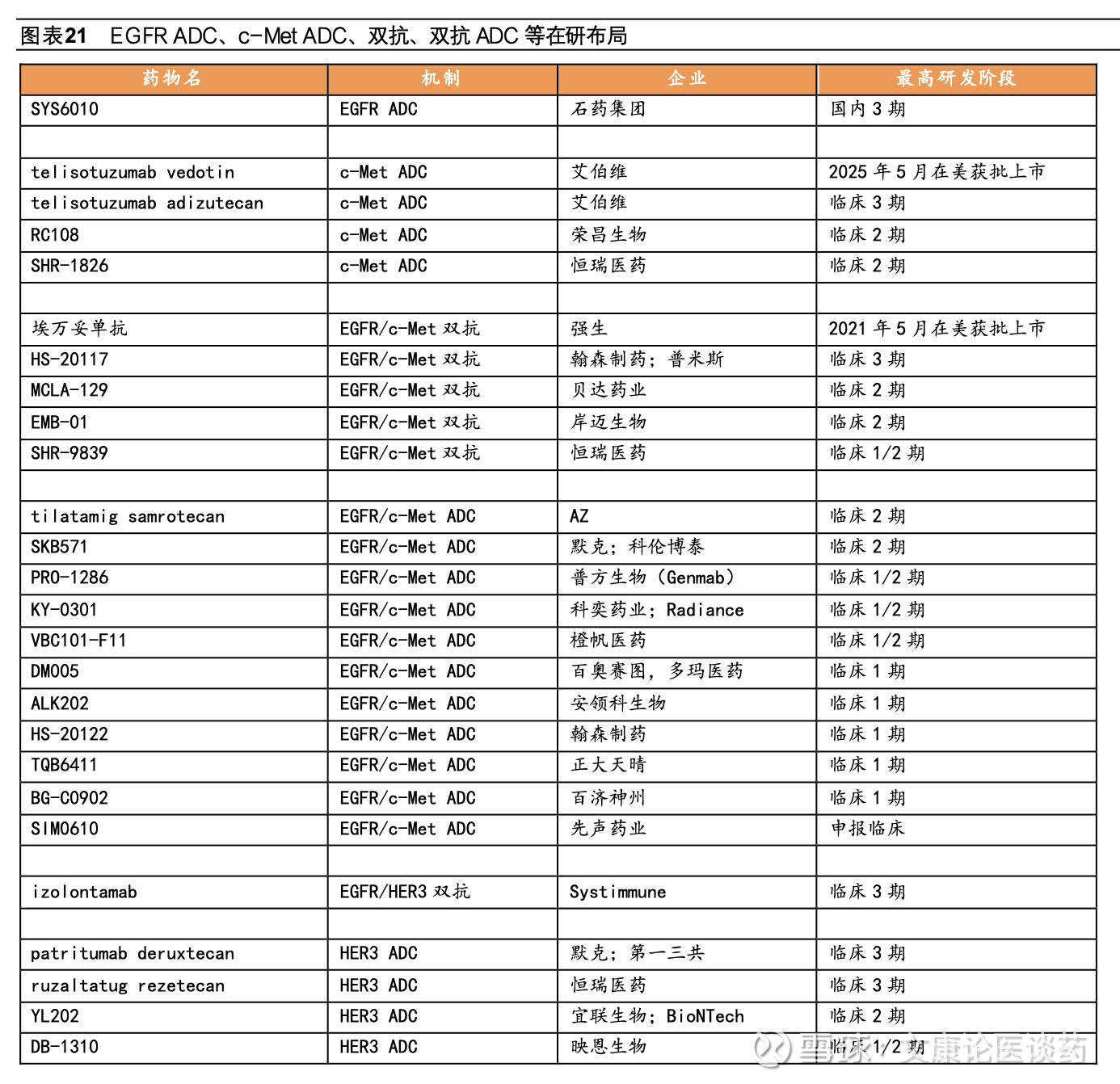
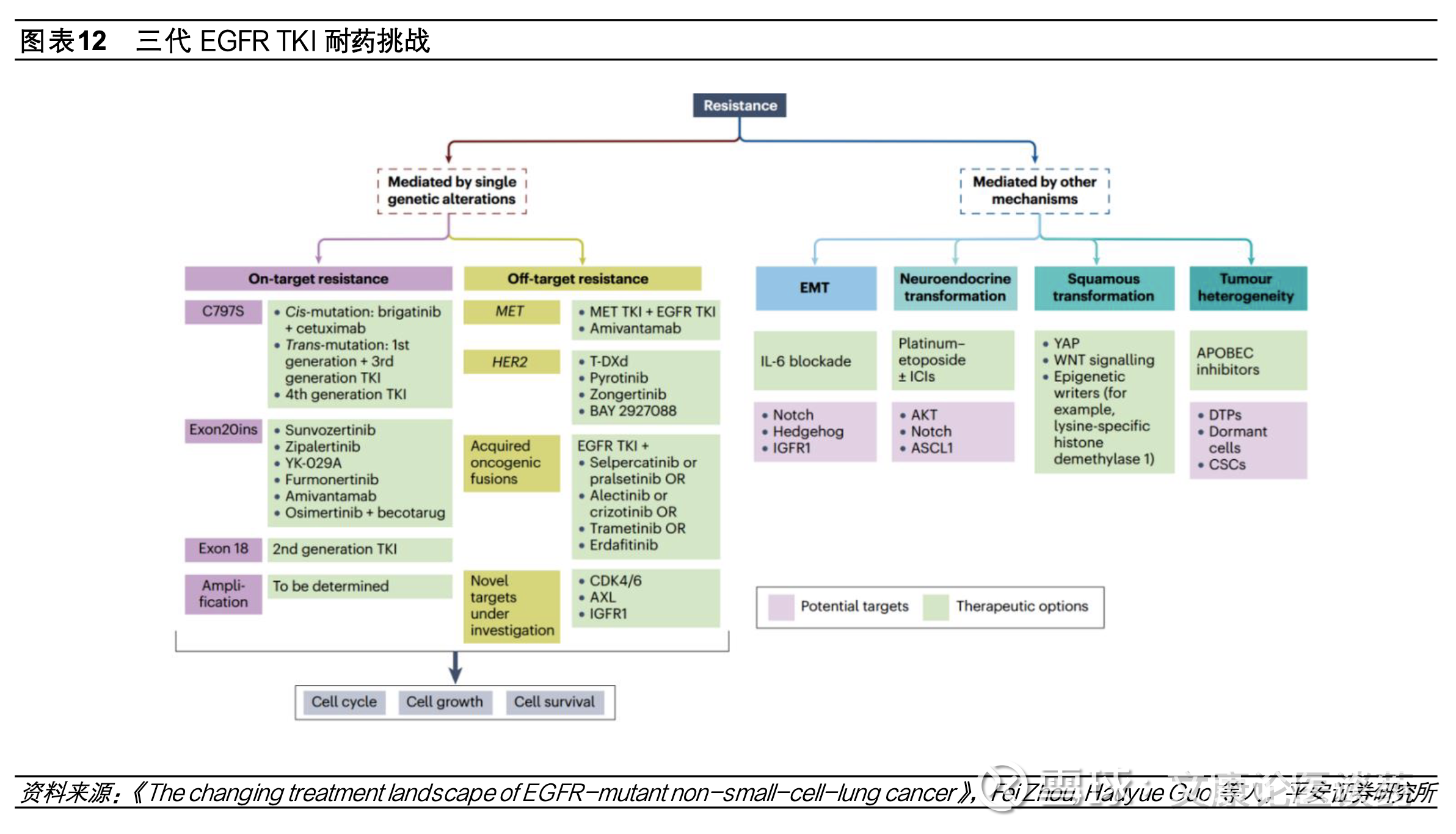
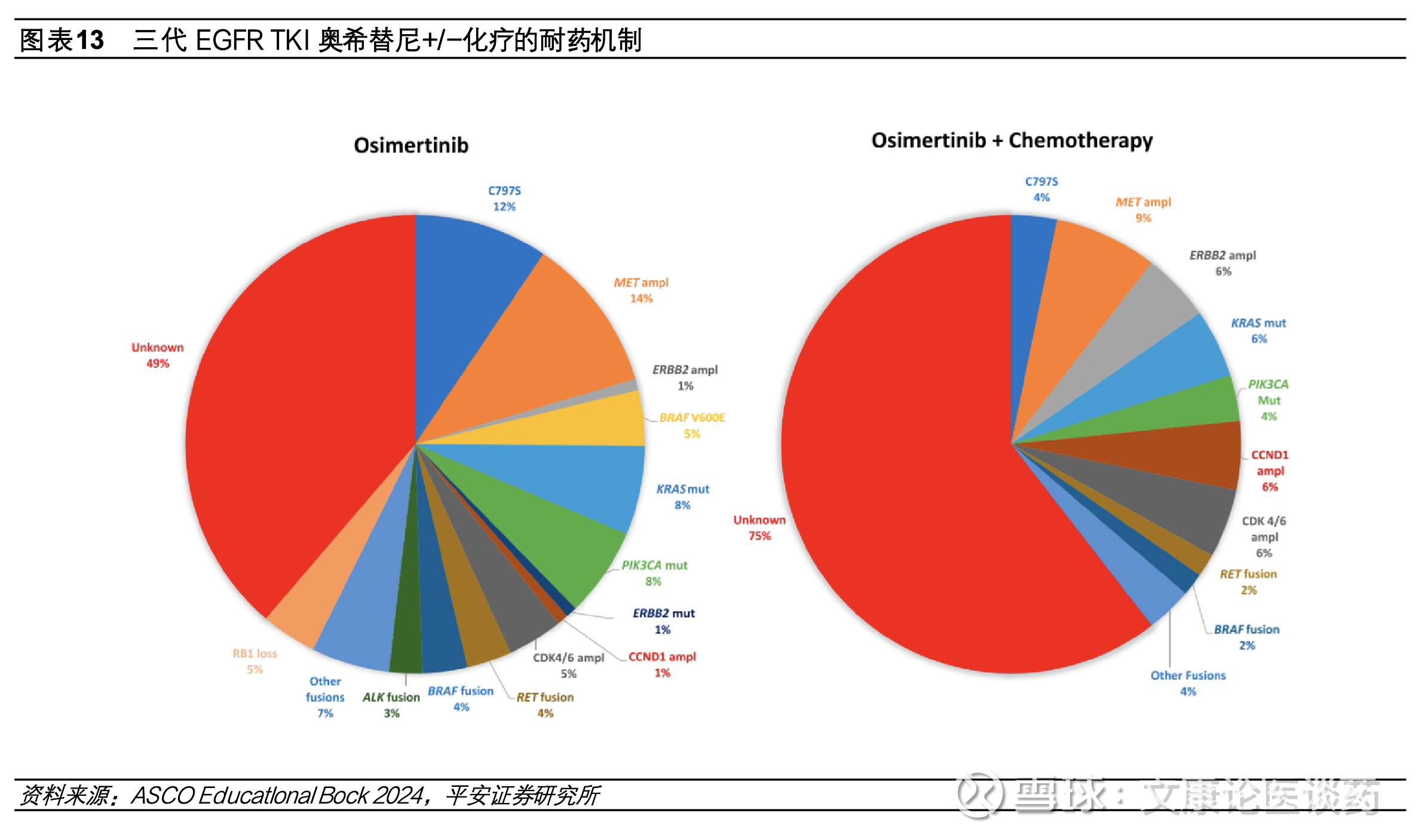
◼ 三代EGFR TKI耐药后疗法亟需破局,国内第四代EGFR TKI、双抗、ADC等方案积极探索。尽管第三代EGFR TKI在疗效和安全性方面表现优异,但耐药性的出现仍会导致疾病进展。接受第三代药物治疗的患者,其耐药机制较为复杂,主要包括EGFR依赖性机制(如EGFR C797S突变、T790M丢失等)以及EGFR非依赖性机制(如Met扩增、HER2扩增等替代信号通路的激活)。数据显示在二线和一线使用奥希替尼治疗后出现疾病进展的患者中,分别约有14%和7%发生C797S耐药突变。为克服EGFR TKI耐药,目前主要的研究方向包括:(1)开发针对EGFR依赖性耐药突变的第四代EGFR TKI小分子药物,目前整体仍处于早期探索阶段;(2)针对替代信号通路激活,已有EGFR/c-Met双抗(如埃万妥单抗)及c-Met ADC等药物取得重要突破;(3)针对未明确的耐药机制,目前布局的策略包括TROP2 ADC、HER3 ADC、免疫检查点抑制剂联合抗血管生成药物及化疗、PD-1/VEGF双抗等。在第三代EGFR TKI耐药后的联合治疗、双抗及ADC药物的探索中,国内药企正扮演越来越重要的角色,地位日益凸显。
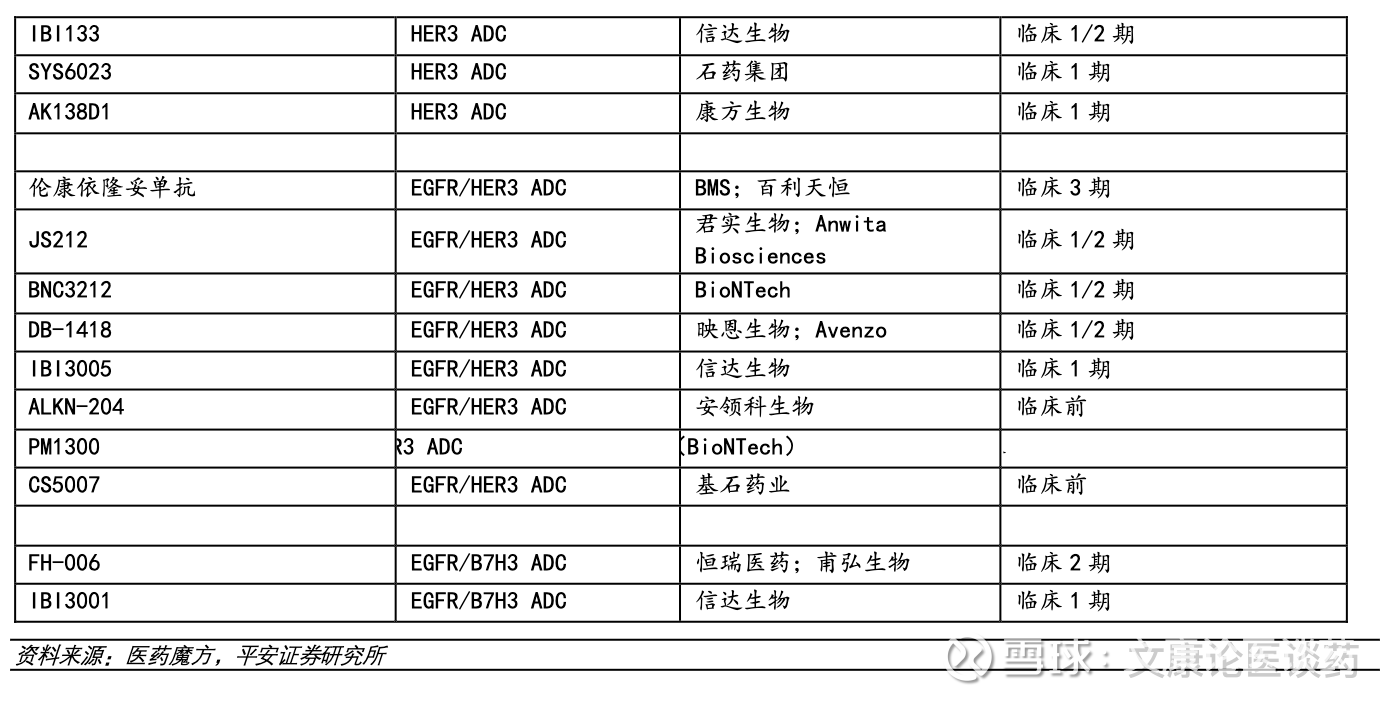
◼ 投资建议:肺癌作为全球及国内最常见的恶性肿瘤之一,2024年全球新发病例约260万,其中中国新发约115万例。在非小细胞肺癌(NSCLC)中,EGFR突变是主要基因亚型,尤其值得关注的是其在亚洲人群中的高发情况—约50%的NSCLC患者携带EGFR激活突变,显著高于白种人(10–20%)。这一庞大患者群体推动了三代EGFR TKI药物的快速放量,同时,针对三代TKI耐药后的治疗策略也已成为研发热点,当前布局方向包括免疫联合抗血管治疗、第四代EGFR TKI、ADC、双抗及双抗ADC等多元路径。(1)三代EGFR TKI的持续放量:重点关注翰森药业(阿美替尼)及艾力斯(伏美替尼)等已上市品种的市场渗透与销售增长。(2)ADC 与双抗类药物进展:科伦博泰 TROP2 ADC 全球及国内注册临床进展;百利天恒EGFR/HER3 双抗ADC(已进入临床III期);康方生物/SUMMIT PD-1/VEGF双抗;三生制药/辉瑞PD-1/VEGF双抗;信达生物在PD-1/IL2 IO2.0及ADC领域的多元布局;映恩生物多款ADC管线的研发进展等。(3)第四代EGFR TKI的研发突破:关注迪哲医药、翰森制药、和誉医药等在四代TKI领域临床进展。
$信达生物(01801)$ $翰森制药(03692)$ $科伦博泰生物-B(06990)$
一、 国内肺癌高发,EGFR突变是我国NSCLC主要突变亚型
肺癌是全球最常见的恶性肿瘤,对应药物市场规模亦庞大。2024年全球约有260万新确诊肺癌患者,当期中国新发肺癌病例数约115万,美国新发肺癌病例数24万。非小细胞肺癌NSCLC占每年肺癌病例的大多数(~85%),腺癌(占NSCLC的40%)和鳞状细胞癌(占NSCLC的25%)是NSCLC最常见的亚型。2024年全球肺癌药物市场规模约543亿美元,其中美国/中国肺癌市场规模分别为228/79亿美元。
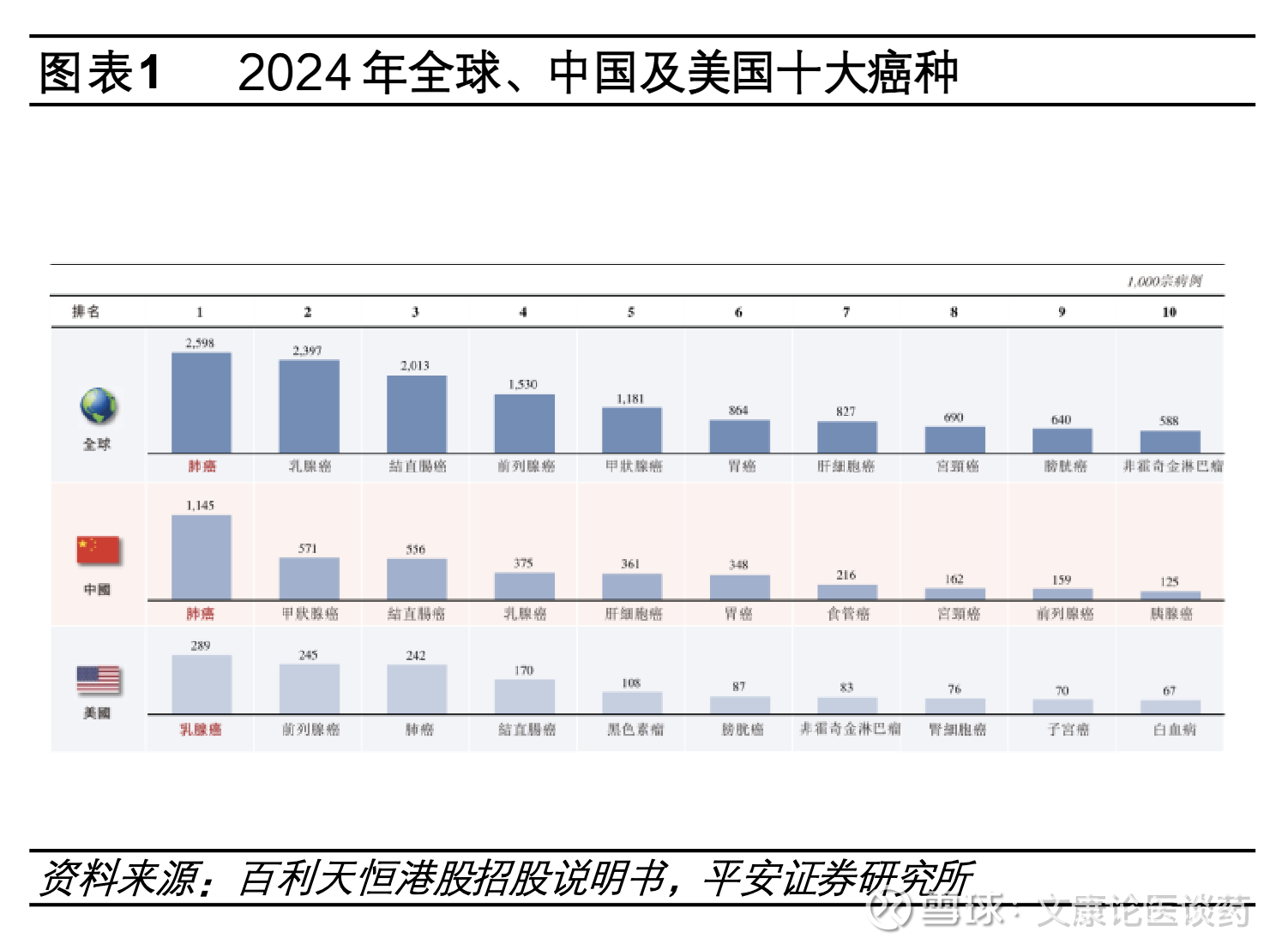
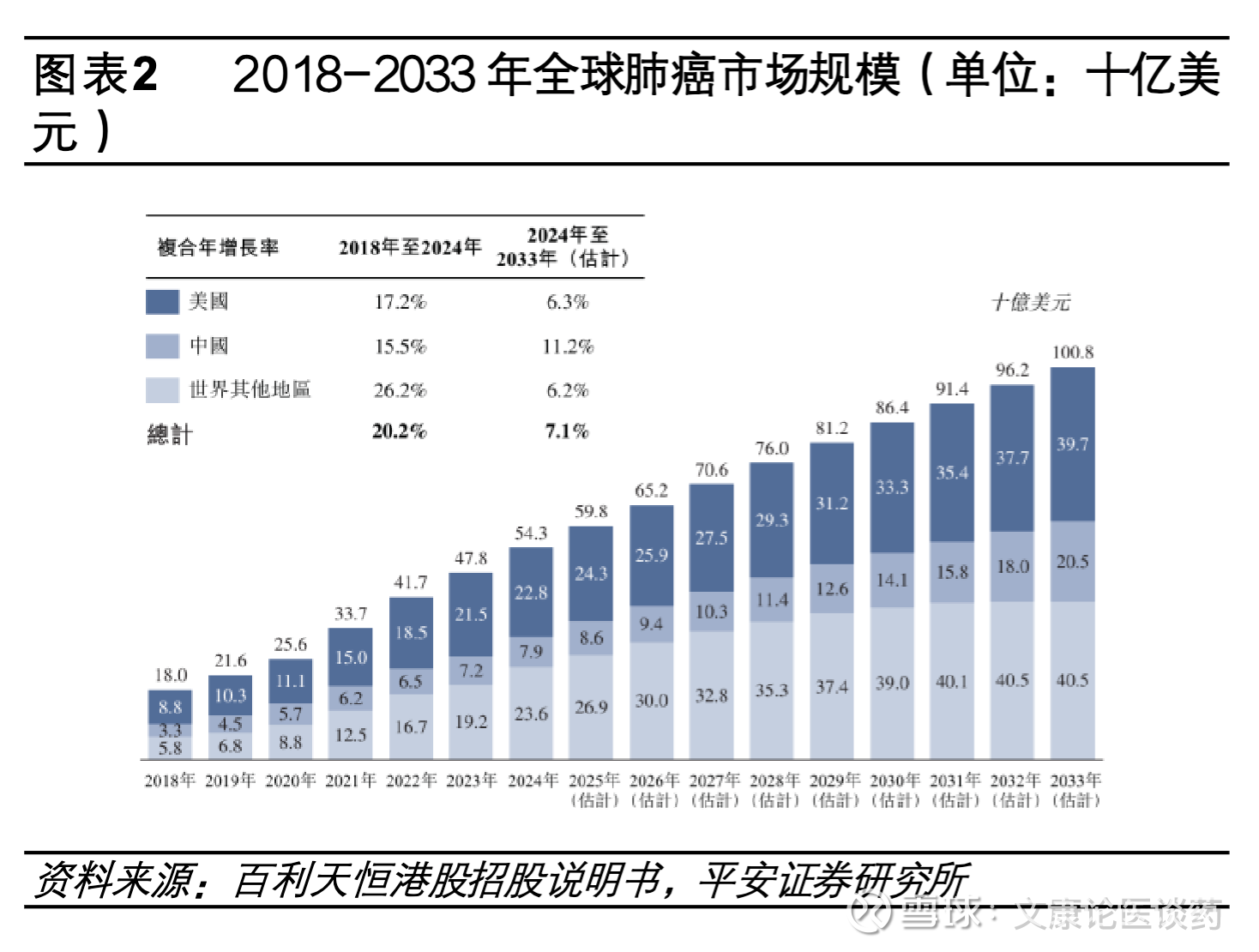
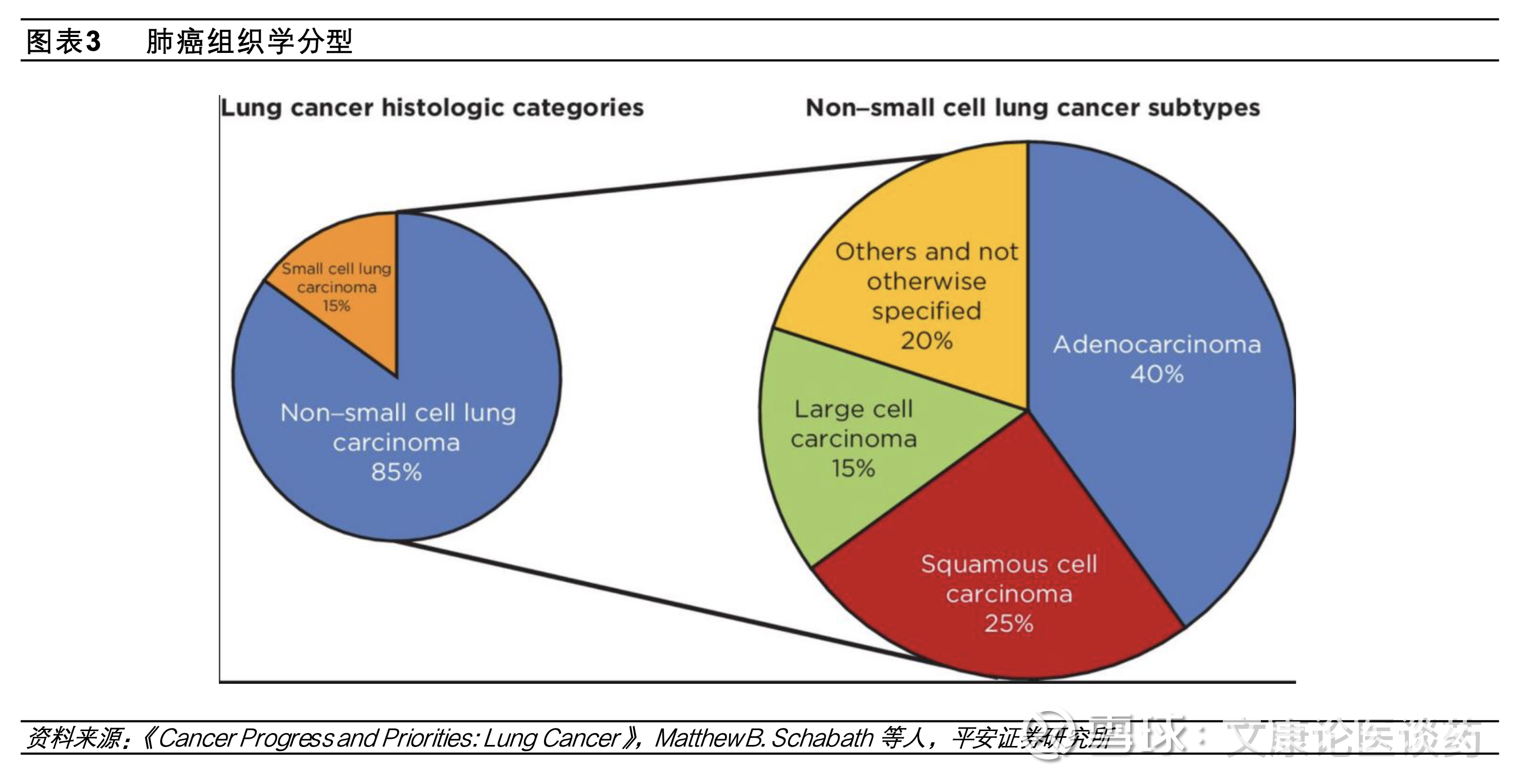
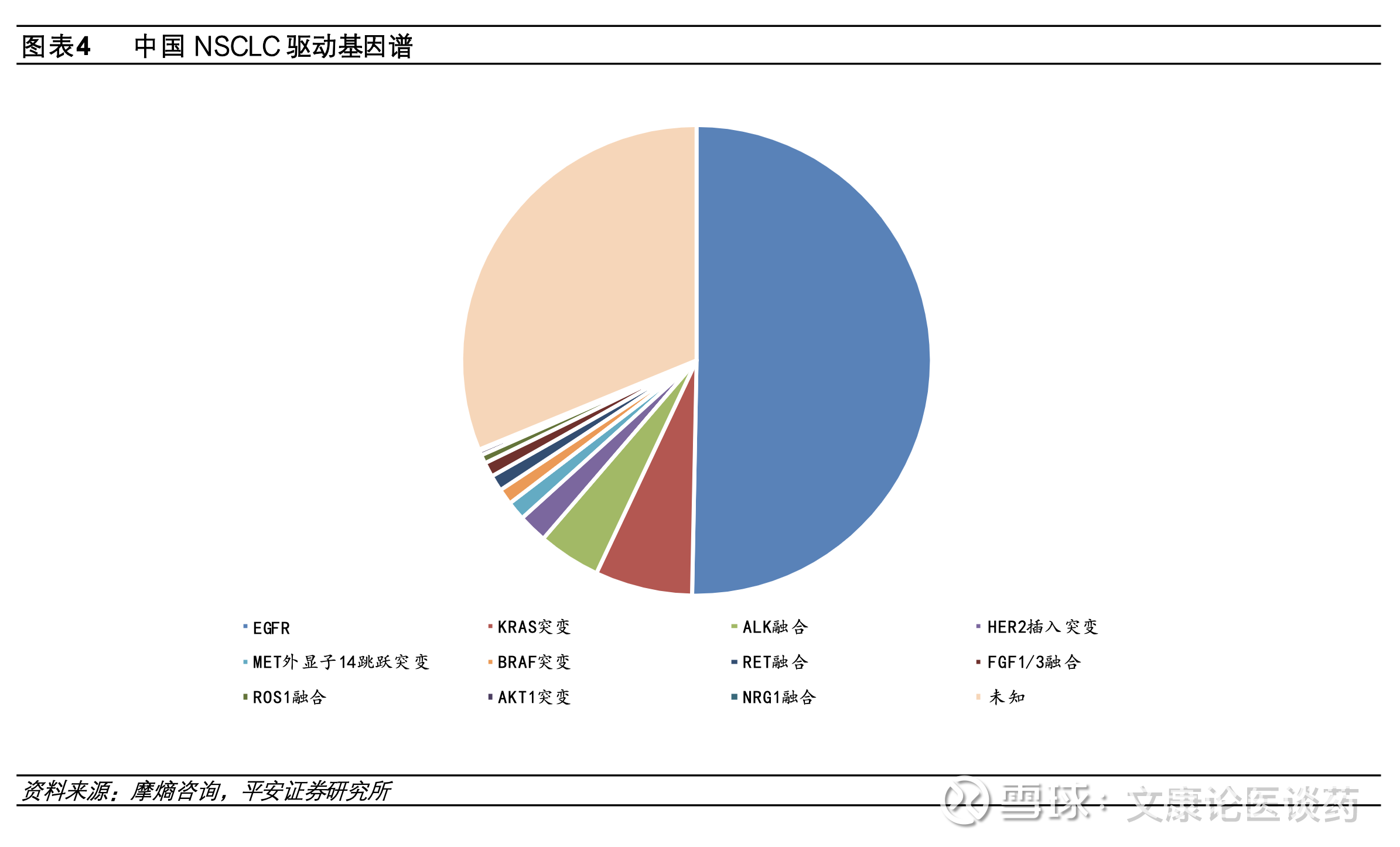
国内NSCLC突变类型主要为EGFR突变。肺癌的分子发病机制复杂且具有异质性,其发生发展可有多种遗传因素和表观遗传改变(如点突变、扩增、插入、缺失、易位)共同导致。从基因分型来看,EGFR、KRAS和ALK是中国NSCLC患者最常见的突变类型,2016年复旦大学附属肿瘤医院团队在《Oncotarget》上,发表了一项对1770例手术切除NSCLC样本(1305例为肺腺癌)的回顾性分析,显示中国EGFR、KRAS和ALK仍为NSCLC患者中最常见的三种突变,占比在整体人群中分别为50.3%、6.7%和4.3%。此外EGFR突变在中西方患者的突变频率不同,在白种人群中,NSCLC携带EGFR激活突变比例在10-20%,而对应在亚洲人群约50%的NSCLC患者携带EGFR激活突变。
二、 第三代EGFR TKI是目前晚期EGFR突变NSCLC一线标准疗法
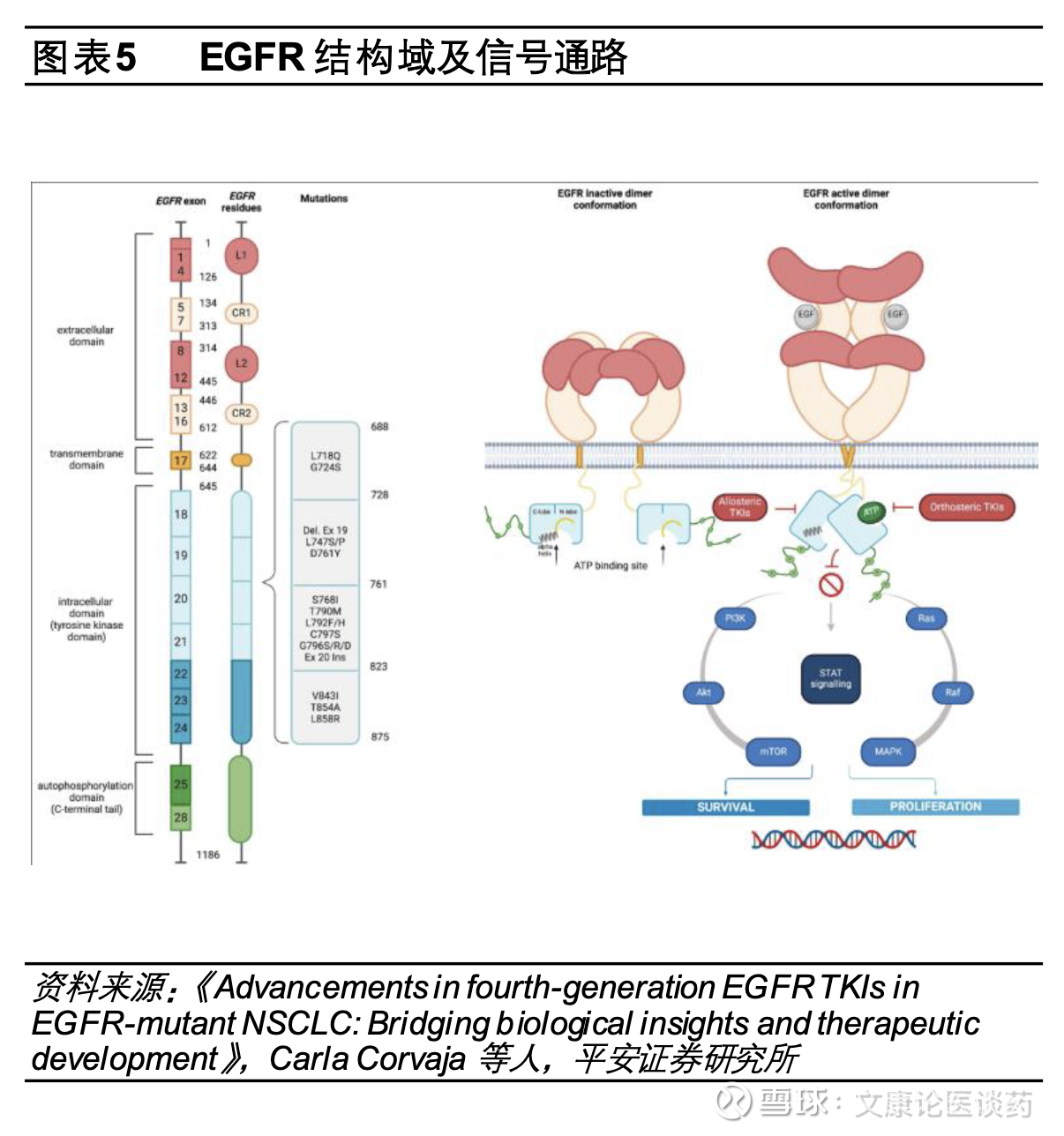
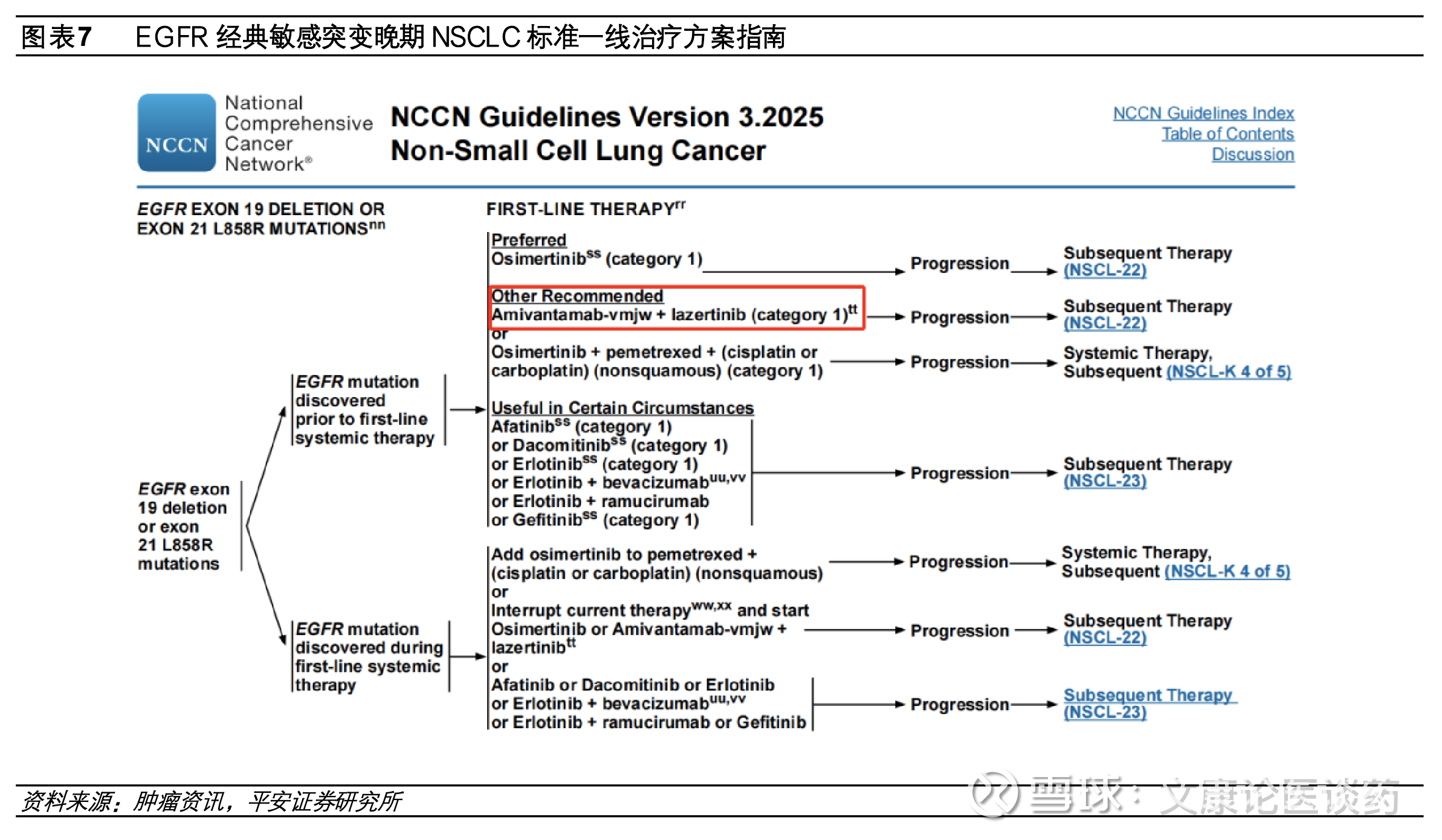
第三代EGFR TKI目前是晚期EGFR突变型NSCLC一线标准疗法。EGFR活化异常会持续激活肿瘤增殖分化,继而诱发肿瘤形成和发展,其激活突变位点位于不同于活性位点的激酶结构域:其中一个激活突变位点位于第858位的亮氨酸通过点突变为精氨酸,这一突变即“L858R“;另外一个激活突变位点是746-750的残基缺失,对应的是EGFR基因外显子19(exon19 del)。第一代EGFR TKI如吉非替尼、厄洛替尼、埃克替尼针对EGFR L858R和EGFR exon19 del突变拥有良好的治疗效果,第二代EGFR TKI靶向药达可替尼、阿法替尼由于疗效较第一代药物并未出现显著提升且副作用更大,在临床应用中并不广泛,然而在临床应用中发现第一代EGFR TKI抑制剂使用10个月左右患者会发生耐药,超过半数耐药的原因是肿瘤细胞EGFR T790M突变,而以奥希替尼、伏美替尼等为代表的三代EGFR TKI即通过不可逆结合ATP结合口袋的EGFR C797位点有效避开EGFR T790M耐药性突变影响,同时保持对EGFR L858R/exon19 del突变的有效抑制,目前第三代EGFR TKI已成为晚期EGFR突变型NSCLC的一线标准治疗方案。
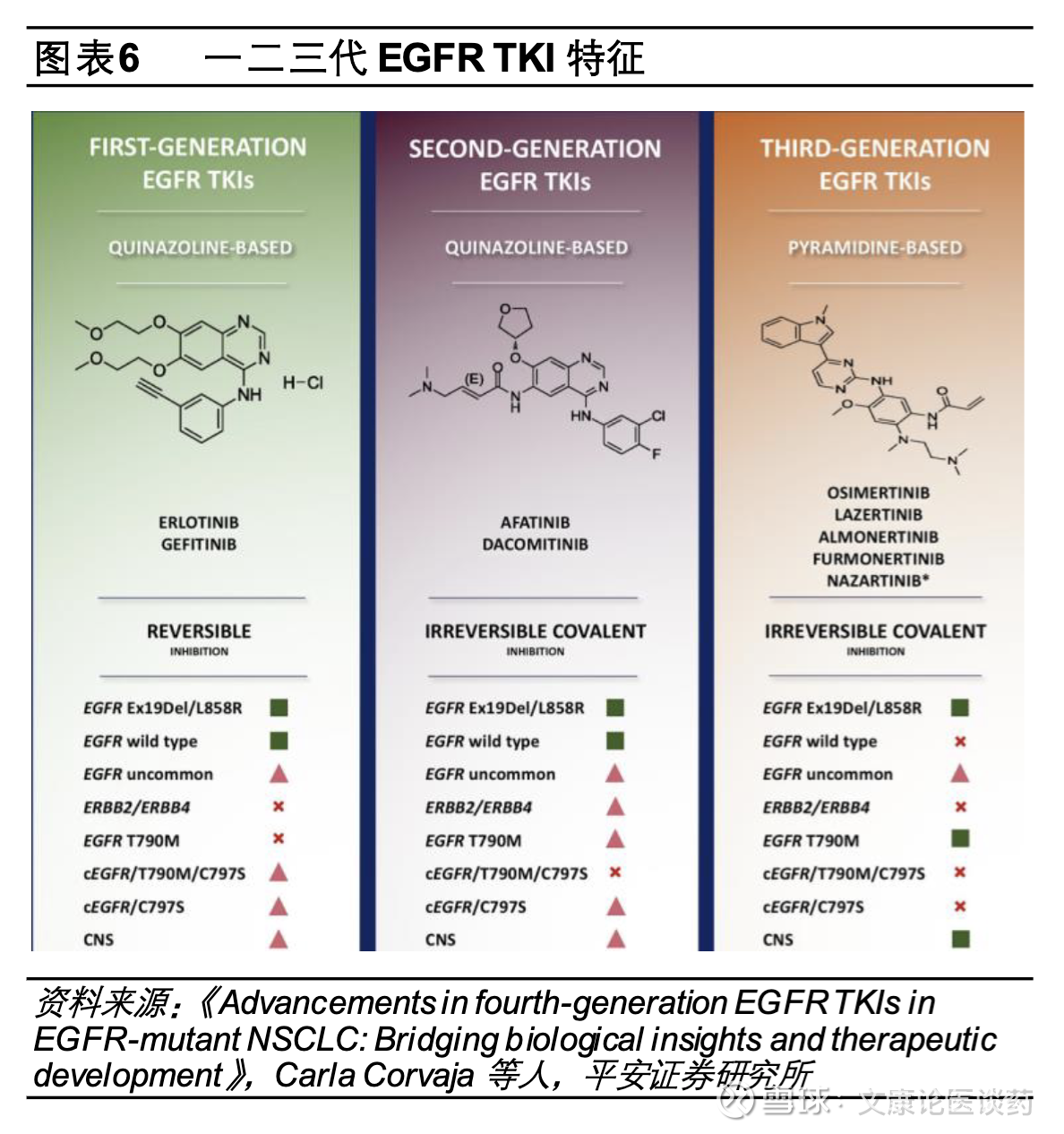
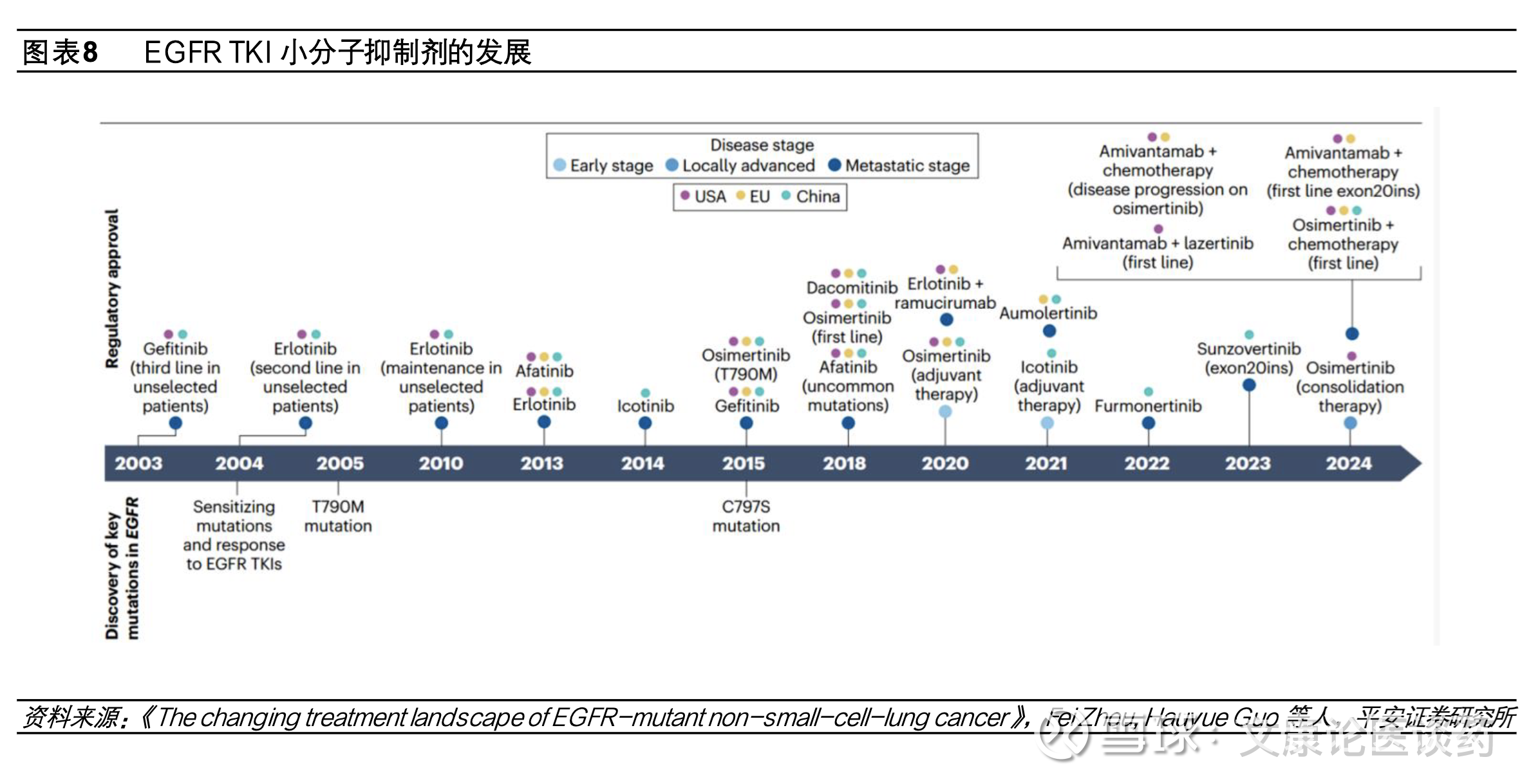
纵观一二三代EGFR TKI发展,第一代TKI如吉非替尼、厄洛替尼可逆性的针对表皮生长因子受体酪蛋白结构域的ATP结合位点,从而抑制表皮生长因子受体自磷酸化和随后下游信号激活,将mPFS从标准方案的铂类化疗4-6个月延长至9-13个月;第二代TKI阿法替尼、达可替尼通过与ERBB家族不可逆结合,将一线治疗mPFS延长至11-14个月;第三代TKI选择性的抑制携带常见突变和/或T790M突变,mPFS在18.9-22.1个月,与一二代TKI相比,第三代TKI与野生型EGFR相关的不良事件如皮疹和腹泻发生率较低,整体来看每一代EGFR TKI小分子抑制剂的疗效呈现出对应的“平台期”特征,而三代TKI对EGFR突变NSCLC患者整带来体生存获益的提升。
第三代EGFR TKI国内外市场规模放量及市占率持续提升。从全球销售额来看奥希替尼2015年11月在美加速获批,2024年全球销售额达65.8亿美元,2024当期在美/欧/新兴市场销售额占比分别为42.0%/19.8%/26.7%;从国内EGFR TKI格局来看,据中康CMH数据显示,2024年我国EGFR TKI市场销售额达204.4亿元,同比增长19.5%,其中以奥希替尼、阿美替尼、伏美替尼为代表的第三代EGFR TKI贡献了179.9亿销售额,占整个EGFR TKI市场规模比例达88%。
三、 双抗/ADC/联用方案等探索破局三代EGFR TKI耐药
3.1 三代EGFR TKI耐药后调整亟需破局
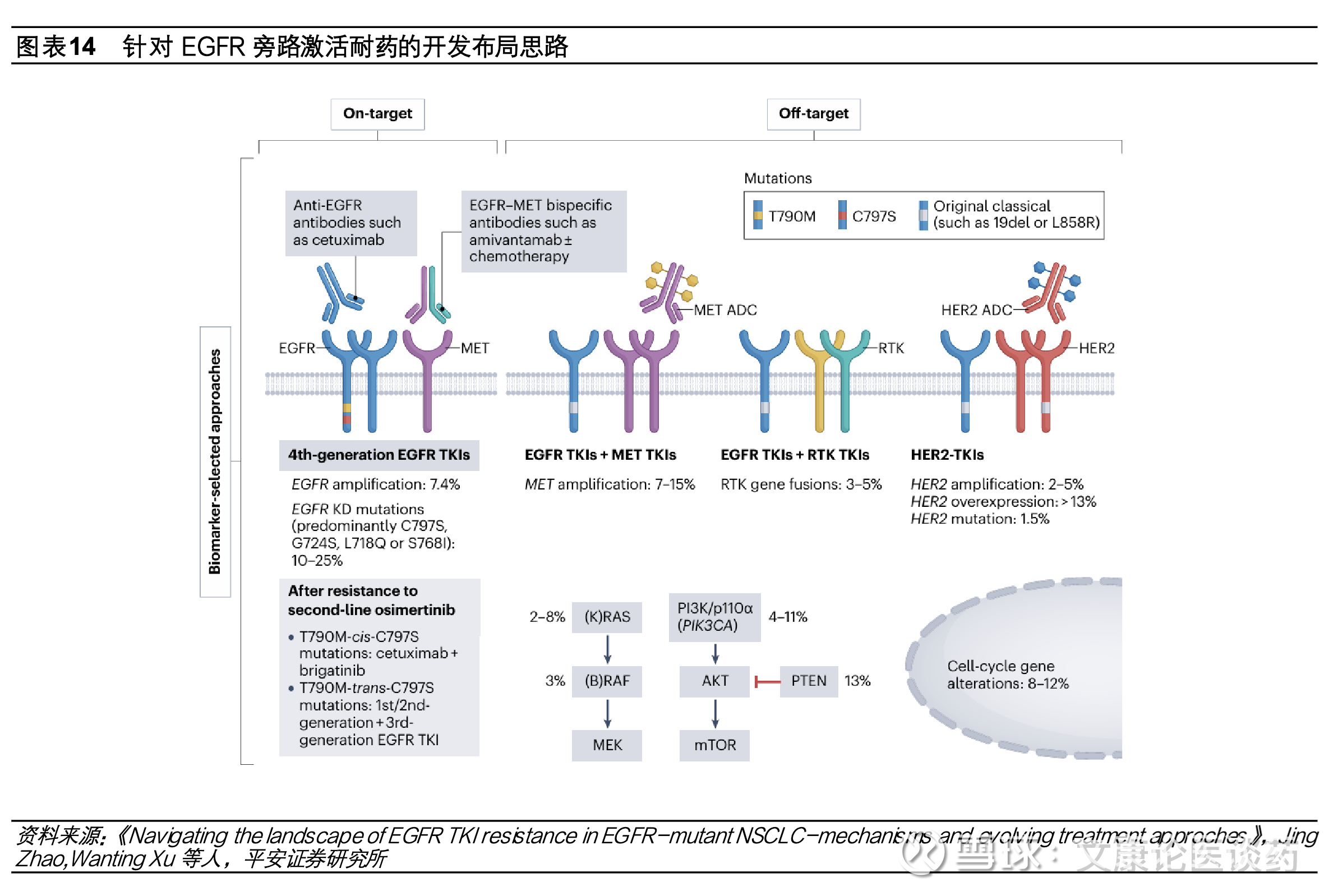
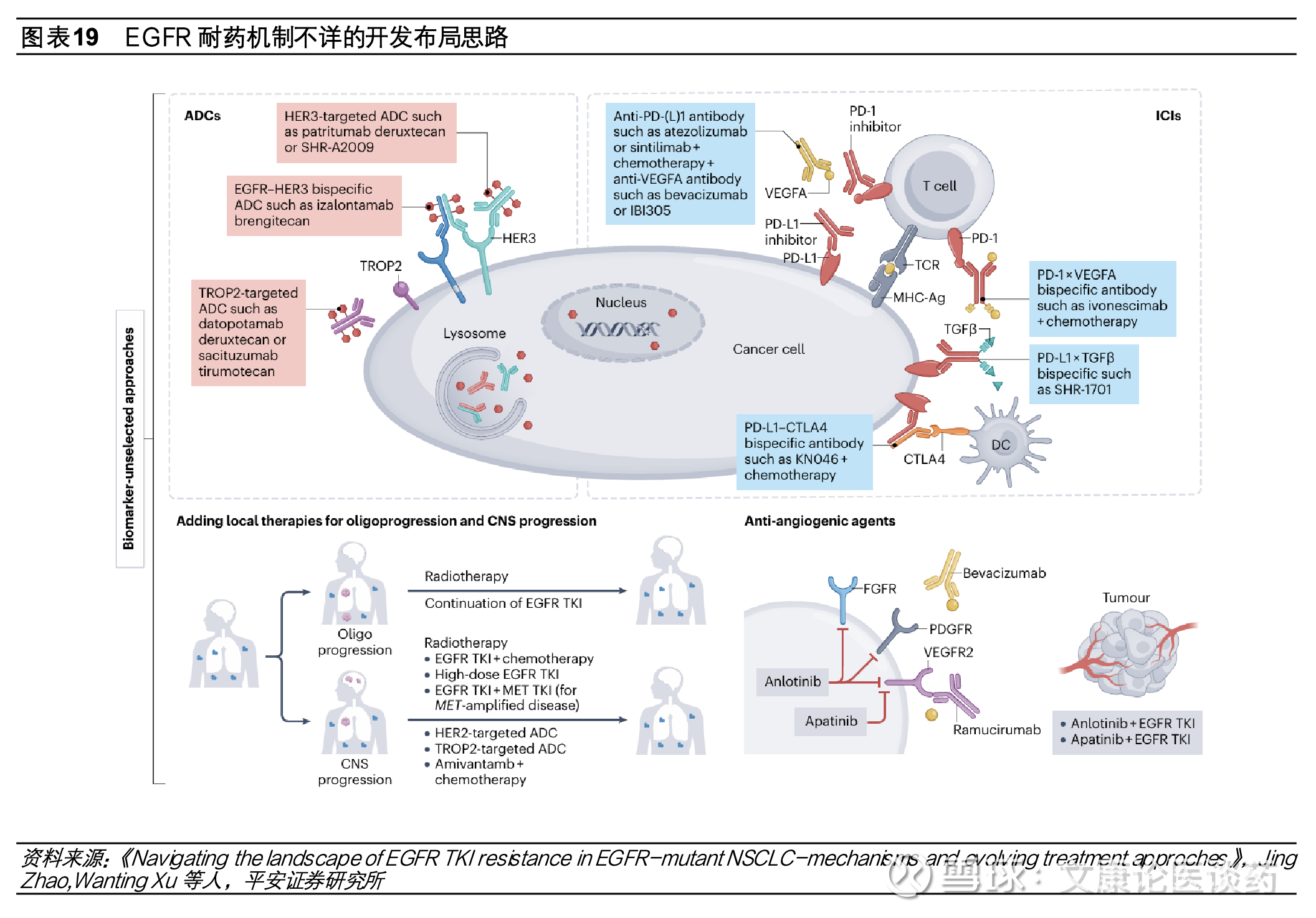
三代EGFR TKI耐药后挑战亟需破局,第四代TKI、双抗、ADC等研发布局。尽管第三代EGFR TKI疗效显著且安全性良好,但由于耐药性的出现疾病仍会发生进展,目前EGFR TKI耐药后疾病进展的标准治疗方案是化疗,中位mPFS在4.4-5.5个月,临床疗效有限并伴有严重全身性不良反应。第三代EGFR TKI用药患者出现耐药机制复杂,可能涉及EGFR依赖性(如EGFR C797S突变、T790M的丢失等)和EGFR非依赖性(替代信号通路旁路激活Met扩增、HER2扩增等)机制。疾病进展时,分别约有14%和7%接受二线和一线奥希替尼治疗患者出现C797S耐药突变。为了解决EGFR TKI耐药问题,目前开发思路主要有(1)针对EGFR依赖性耐药突变开发第四代EGFR TKI小分子;(2)针对EGFR信号通路旁路激活采取联用小分子抑制剂或开发双抗等;(3)针对机制未明的EGFR耐药探索双抗、ADC等。
3.2 第四代EGFR TKI开发主要针对C797S耐药突变,整体处于早期探索阶段
针对EGFR依赖性耐药开发思路主要是第四代EGFR TKI抑制C797S耐药突变,整体处于早期临床探索中。目前大部分第四代EGFR TKI结构设计为ATP竞争性抑制剂,通常与激酶结构域的铰链区形成氢键,以模拟ATP的结合模式;或设计为与EGFR变构口袋结合的变构抑制剂,优点在于有较高的靶向选择性和较低的体内副作用,缺点在于变构口袋空间有限开发难度大。目前第四代EGFR TKI 整体处于早期探索阶段,国内企业布局的有翰森制药HS-10375(临床1期)、迪哲医药DZD6008(临床1/2期)、和誉AKB3376(临床1期)等。
3.3 针对EGFR替代信号旁路激活,EGFR/c-Met双抗、c-Met ADC等取得突破
针对EGFR非依赖性耐药机制如MET扩增、HER2突变、RET融合、KRAS突变等布局联用如奥希替尼联用赛沃替尼(EGFR联用c-Met抑制剂)、EGFR/c-Met双抗埃万妥单抗、c-Met靶向ADC、EGFR/HER3双抗、EGFR/HER3双抗ADC等。
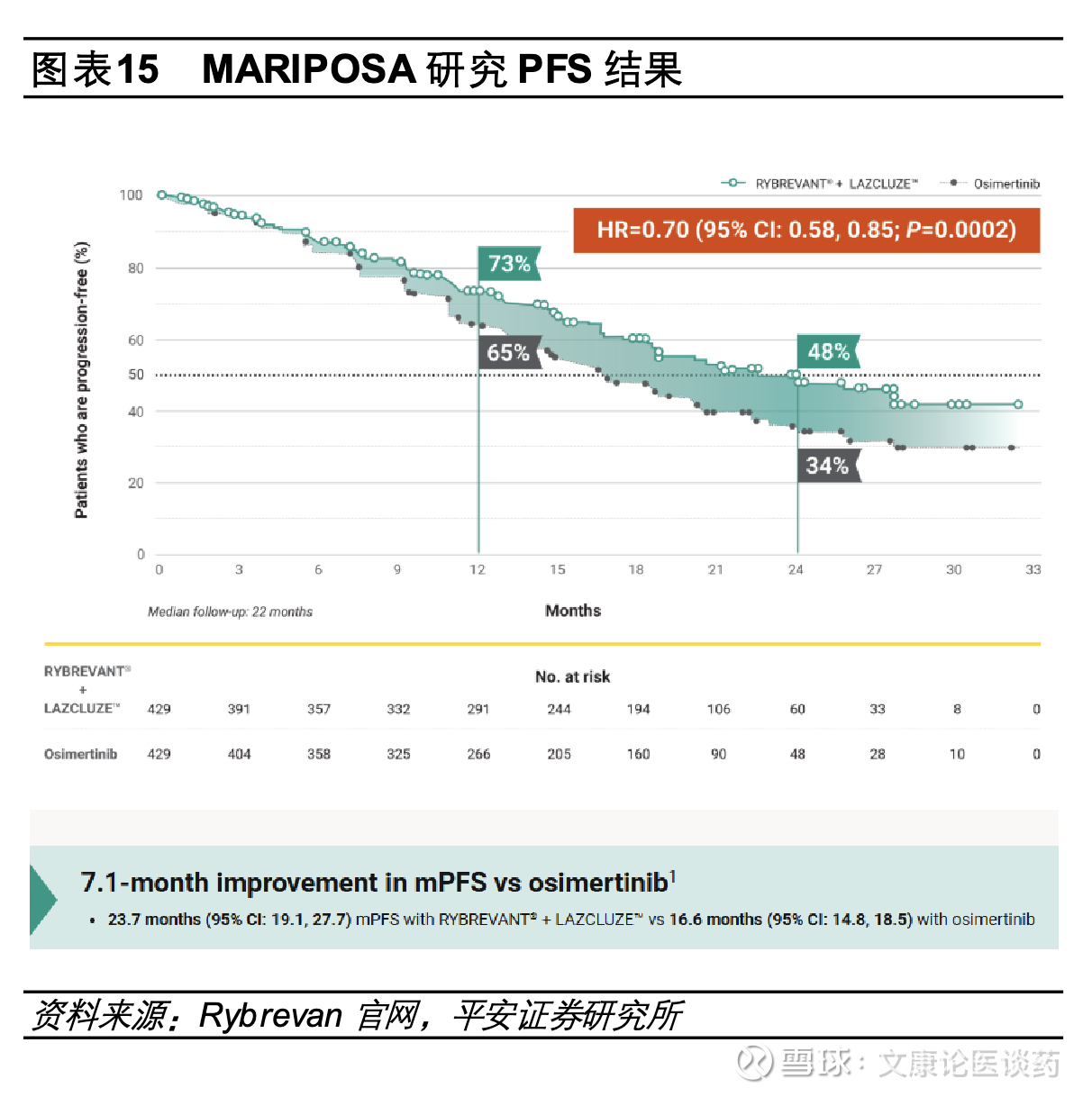
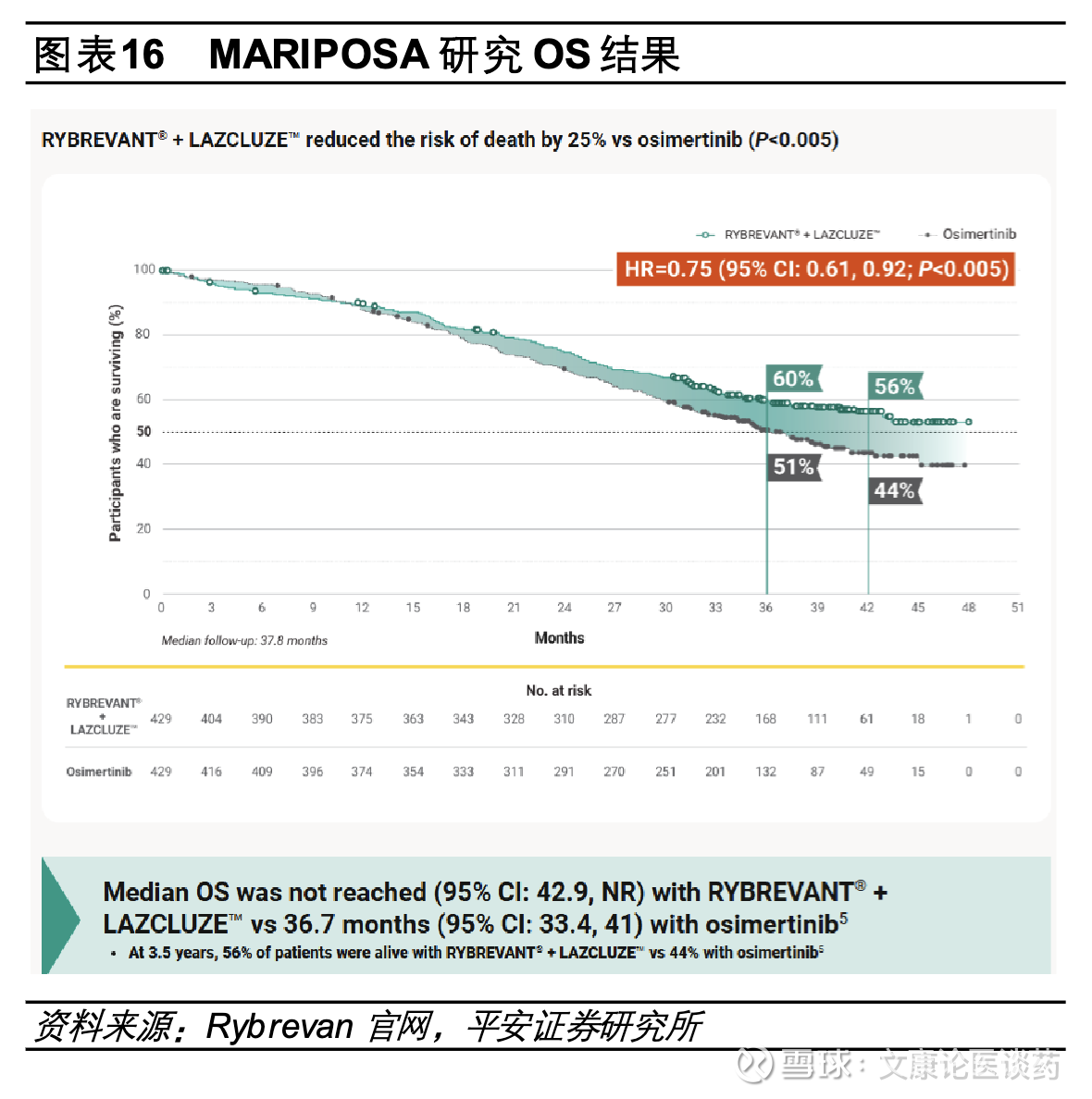
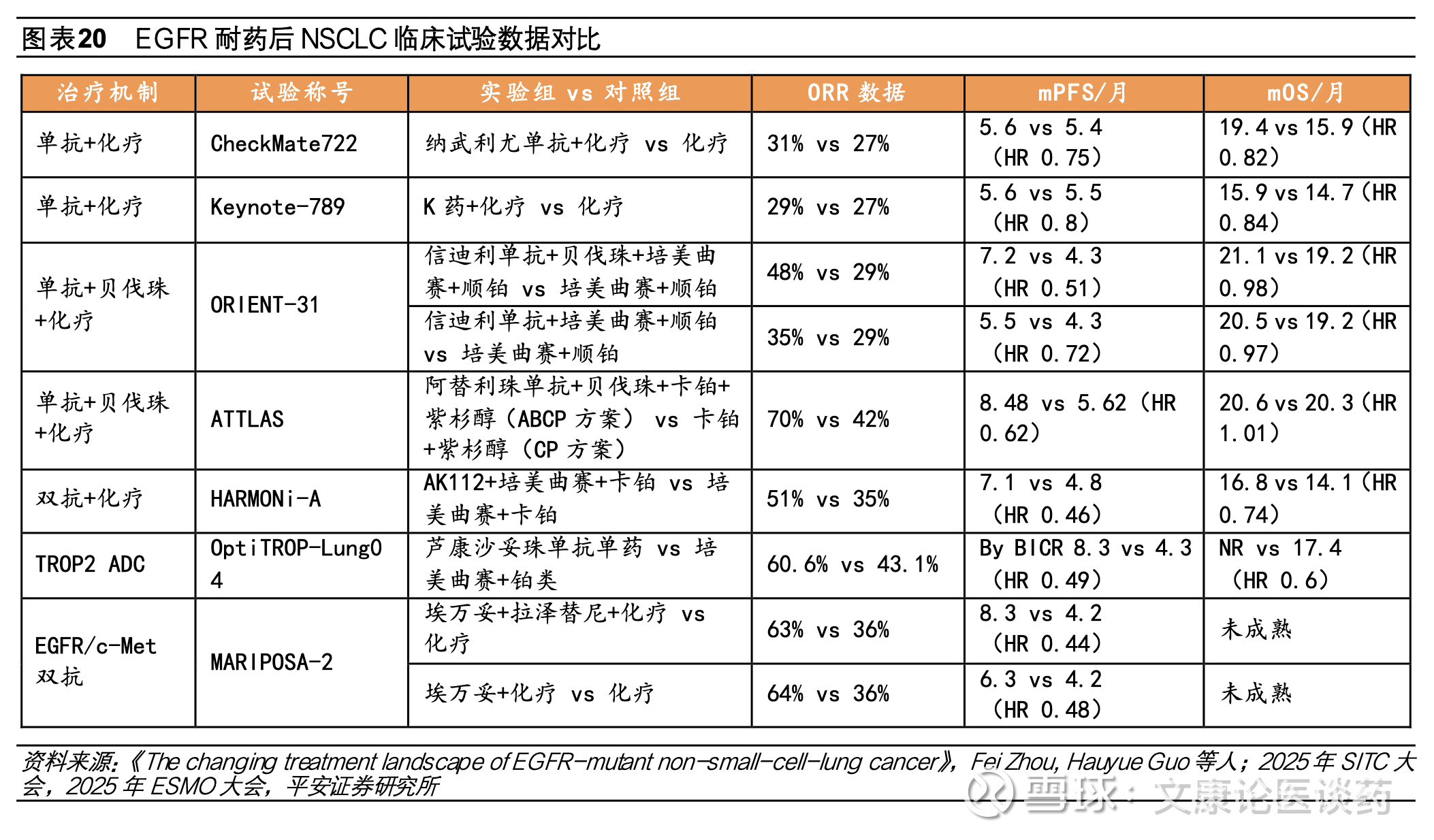
➢ EGFR/c-Met双抗埃万妥联合兰泽替尼为不可耐受化疗/拒绝化疗EGFR突变NSCLC患者提供“Chemo-Free”的新治疗模式。2025年8月基于MARIPOSA研究,埃万妥单抗联合兰泽替尼国内获批1L EGFR 19号外显子缺失或21号外显子L858R置换突变NSCLC,研究结果显示,对比奥希替尼单药组,埃万妥单抗联合兰泽替尼mPFS显著延长(23.7个月 vs 16.6个月,HR=0.7),2025年ELCC会议上公布的最新OS数据显示中位随访37.8个月,埃万妥单抗关联和兰泽替尼的OS较奥希替尼明显改善,相较于奥希替尼组mOS为36.7个月,埃万妥单抗联合兰泽替尼的mOS尚未达到,且生存曲线呈现长拖尾效应。

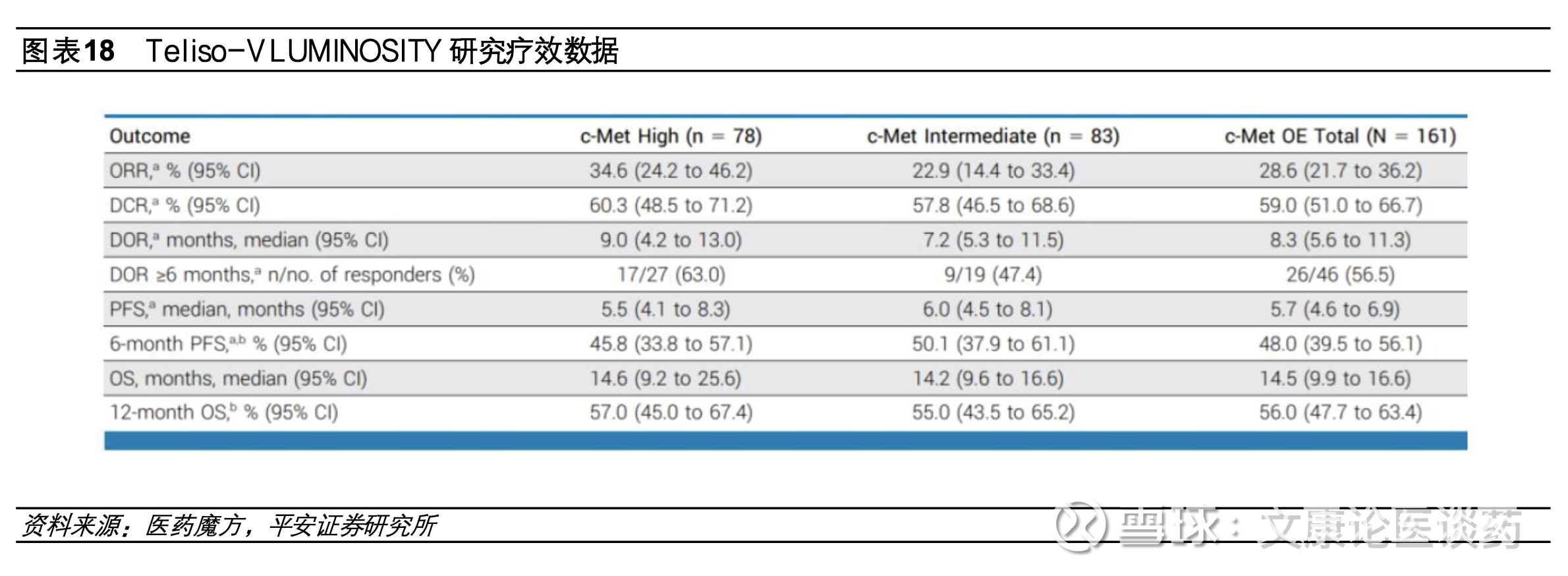
➢ 艾伯维旗下Emrelis为全球首款c-Met ADC在美获批上市,2L治疗c-Met高表达NSCLC患者。2025年5月艾伯维的c-Met ADC Emrelis(telisotuzumab vedotin,Teliso-V,ABBV-300)在美获加速获批,用于治疗既往接受过全身治疗的局部晚期或转移性高c-Met表达的NSCLC患者,作为全球首款获批上市的c-Met ADC,Emrelis采用的是传统的VC-MMAE结构构建,在c-Met高表达(>=50%肿瘤细胞3+染色)人群,ORR达34.6%,mPFS达5.5个月,OS达14.6个月;此外艾伯维同步布局了新一代c-Met ADC ABBV-400,与已获批上市的Emrelis不同在于毒素为拓朴异构酶。
3.4 针对EGFR耐药机制不明人群,双抗、ADC、IO联用等持续探索
尽管EGFR TKI耐药后可通过再次活检来确定耐药机制,但仍有部分患者耐药机制不明,针对未明确EGFR耐药机制的布局有TROP2 ADC、HER3 ADC、免疫检查点抑制剂联合抗血管生成和化疗、PD-1/VEGF双抗联合化疗等。在三代EGFR TKI耐药后联用、双抗、ADC等探索中,国内药企的地位和重要性越来越凸显,具体相关研究描述如下:(1)信达生物的ORIENT-31研究采用信迪利单抗联合贝伐和化疗四药联合治疗EGFR TKI耐药非鳞状NSCLC患者,研究结果表面四药联合治疗对比单纯化疗延长患者 PFS,但中位 OS 未取得获益;(2)康方生物 HARMONi-A 研究实验组采取依沃西单抗(PD-1/VEGF双抗)联合化疗对比安慰剂联合化疗,显著延长患者PFS;(3)科伦博泰OptiTROP-Lung04研究为SKB264单药(TROP ADC)对比化疗,结果表明显著延长PFS,且OS期中分析显示与含铂双药化疗相比,SKB264显著改善OS,死亡风险降低40%。
四、 投资建议
肺癌作为全球及国内最常见的恶性肿瘤之一,2024年全球新发病例约260万,其中中国新发约115万例。在非小细胞肺癌(NSCLC)中,EGFR突变是主要基因亚型,尤其值得关注的是其在亚洲人群中的高发情况—约50%的NSCLC患者携带EGFR激活突变,显著高于白种人(10–20%)。这一庞大患者群体推动了三代EGFR TKI药物的快速放量,同时,针对三代TKI耐药后的治疗策略也已成为研发热点,当前布局方向包括免疫联合抗血管治疗、第四代EGFR TKI、ADC、双抗及双抗ADC等多元路径。(1)三代EGFR TKI的持续放量:重点关注翰森药业(阿美替尼)及艾力斯(伏美替尼)等已上市品种的市场渗透与销售增长。(2)ADC与双抗类药物进展:科伦博泰TROP2 ADC全球及国内注册临床进展;百利天恒EGFR/HER3双抗ADC(已进入临床III期);康方生物/SUMMIT PD-1/VEGF双抗;三生制药/辉瑞PD-1/VEGF双抗;信达生物在PD-1/IL2 IO2.0及ADC领域的多元布局;映恩生物多款ADC管线的研发进展等。(3)第四代EGFR TKI的研发突破:关注迪哲医药、翰森制药、和誉医药等在四代TKI领域临床进展。