SRPT:祸福相依?
Sarepta Therapeutics 的股票(纳斯达克代码:SRPT)在 2025 年 11 月 4 日星期二暴跌约 33.74%,原因是其两款已获批的杜氏肌营养不良症(DMD)药物——Amondys 45(casimersen)和 Vyondys 53(golodirsen)——的 III 期 ESSENCE 试验结果令人失望。这一挫折加剧了 Sarepta 持续面临的挑战,包括对其最畅销基因疗法 Elevidys 的审查和限制,此前在今年早些时候有两名患者死亡。
然而,更深入的分析描绘了一幅不同的画面。ESSENCE 试验的失败虽不可否认,但并非如市场反应所暗示的那样具有灾难性。事后分析中的积极趋势、令人信服的真实世界证据以及历史先例表明,FDA很可能保留这些药物批准和市场准入资格。同时,Elevidys——尽管近期销售额下滑——但在未满足的医疗需求和持续监管讨论的推动下,显示出在 2026 年可能重新加速增长的迹象。
总体而言,对于 Sarepta 这家在 DMD 等超罕见疾病领域开创突破性疗法的公司来说,这些短期困难可能代表着"黎明前的黑暗"。
1. 临床试验失败为何并非灾难性?
1.1 临床试验结果
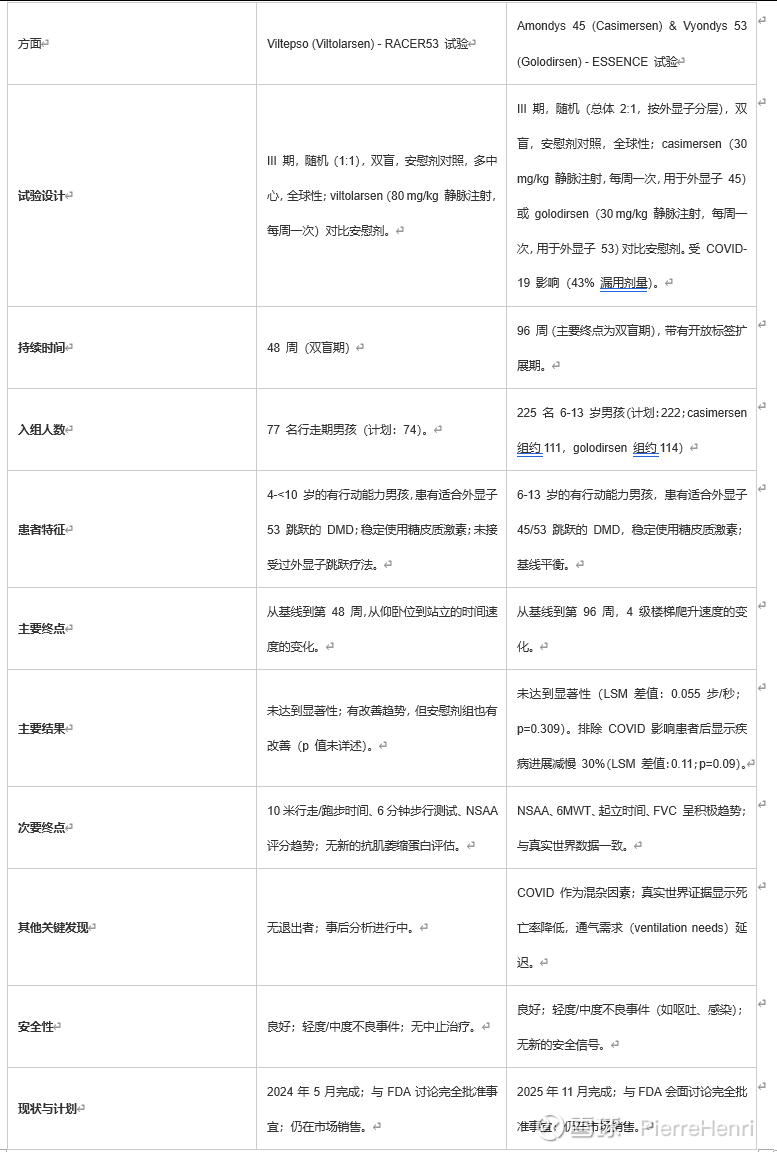
III 期 ESSENCE 试验(NCT02500381)是一项全球性、随机、双盲、安慰剂对照研究,旨在评估 Amondys 45 和 Vyondys 53 在 6-13 岁、适合外显子 45 或 53 跳跃治疗的 DMD 男孩中的疗效。该试验历时近九年,共入组 225 名患者(casimersen 组约 111 人,golodirsen 组约 114 人,均包含安慰剂组),但未达到其主要终点:在意向治疗人群中,第 96 周时 4 级楼梯爬升速度相对于基线的变化。最小二乘均值差为 0.055 步/秒,p 值为 0.309。
这一结果受到外部因素影响,包括 COVID-19,导致 43% 的参与者出现漏用剂量和评估中断。一项排除受 COVID 影响的参与者(n=168)的事后分析显示结果有所改善:最小二乘均值差为 0.11 步/秒(p=0.09),意味着在 4SC 指标上两年内疾病进展减缓了 30%。
此外,当应用预后评分来识别有病情恶化风险的亚组人群(占非 COVID 患者的 63.1%;总计 106 人,其中药物组 71 人,安慰剂组 35 人)时,治疗效果更为显著:最小二乘均值差为 0.186 步/秒(p=0.010),相当于疾病进展减少了 35%。
虽然总体结果未达理想,但远非灾难性。排除受 COVID 影响的数据是合理的调整,因为大流行对临床研究的干扰已有充分记录。p 值为 0.09,虽高于统计学显著性的常规阈值 0.05,但对于像 DMD 这样的超罕见疾病而言可能是可接受的,因为这类试验的规模本身有限,且要达到足够的统计效力具有挑战性。次要终点,包括北极星动态评估量表评分、6 分钟步行测试和用力肺活量,均显示出有利于治疗组的积极趋势,这与之前的 II 期数据和真实世界证据相符。
为加强这一观点,Sarepta 在 2025 年世界肌肉协会会议上展示了额外数据,强调了早期研究中在运动功能和抗肌萎缩蛋白产量方面的一致益处。
1.2 FDA 会撤销这两种药物的批准吗?
可能性低。这两种药物均基于抗肌萎缩蛋白产量这一替代终点获得加速批准,ESSENCE 试验作为其验证性研究。FDA 在评估是否转为完全批准时,会考量"证据的总体性",包括真实世界数据。
这两种药物的真实世界证据非常有力:一项汇总分析显示,与类固醇治疗的对照组相比,casimersen(占汇总人群的 33%)和 golodirsen(占汇总人群的 11%)的死亡率降低了 70%(风险比 = 0.303)。其他数据表明,丧失行走能力的时间延迟了 3-4 年,需要夜间通气(nighttime ventilation needs)的时间延迟了 7.5 年(针对 Vyondys 53),肺功能下降速度减慢(针对 Amondys 45),以及住院/急诊次数减少。
一个可比的案例是来自 NS Pharma(日本新药子公司)的 Viltepso(viltolarsen),这是另一种外显子 53 跳跃的反义寡核苷酸药物,于 2020 年依据加速批准途径获批。其 III 期 RACER53 试验于 2024 年 5 月未能达到主要终点(48 周时从仰卧位到站立的时间变化),但截至 2025 年 11 月,FDA 并未撤销其批准。Viltepso 仍在市场上销售,NS Pharma 计划基于次要终点和事后分析的趋势与 FDA 讨论完全批准事宜。
Sarepta 已宣布计划与 FDA 会面,讨论将 Amondys 45 和 Vyondys 53 转为完全批准的事宜,将在补充新药申请中提交完整的 ESSENCE 试验数据以及真实世界证据。这种方法与罕见病领域的成功先例相呼应,在罕见病领域,验证性试验常常面临类似的挑战。
1.3 这会影响保险覆盖吗?
争论仍在继续,但有证据表明大规模中断的可能性很小。一些分析师担心保险公司可能利用试验失败作为限制覆盖的筹码,但 Viltepso 的先例提供了 减少了这种担心。
在 RACER53 试验失败后,美国主要保险公司如 UnitedHealthcare、Aetna、Cigna、CarelonRx 和Federal Employee Program (FEP) Blue Cross Blue Shield,直至 2025 年中后期的政策更新仍继续报销 Viltepso。没有证据表明覆盖范围普遍下降;决策取决于加速批准状态、可用数据和个人患者评估。一些支付方要求验证性证据,但在特定条件下(如事先授权)予以批准。
对于 Sarepta 的 涉及药物(在 2025 年第三季度创造了 2.385 亿美元的销售额,高于前几个季度),由于 DMD 的进展性和替代方案有限,其客户粘性很高。真实世界的益处,包括死亡率降低,支撑了保险公司继续覆盖的理由。
1.4 这会影响收入吗?
影响应该是有限和短期的。
Viltepso 在 RACER53 试验后的经验具有参考意义:在 2024 财年第一季度(2024 年 4 月至 6 月,试验失败后),销售额为 51.94 亿日元(同比下降 4.7%;日本:+2.0%,美国:-6.5%)。2024 财年上半年(4 月至 9 月)达到 108 亿日元,2025 财年(2025 年 4 月至 2026 年 3 月)全年预估为 215 亿日元。NS Pharma 报告称没有患者因试验结果而退出治疗;在日本的新患者获取甚至有所增加。美国市场增长因竞争(例如来自 Sarepta 自身的药物)和更严格的再授权程序而放缓,但销售额趋于稳定,并未出现持续下降趋势。
DMD 疗法的患者留存源于两个因素:(1)已证实的临床益处,即使主要试验终点未达到;(2)在这种超罕见疾病中缺乏更优的替代方案。Sarepta 的两款药物受益于类似的处境。
2. 为何 Elevidys 可能在明年重新加速增长
2.1 巨大的未满足需求
Sarepta 的一次性 DMD 基因疗法 Elevidys 在 2025 年第三季度于美国实现了 1.315 亿美元的销售额——超过了分析师预估的 1.09-1.15 亿美元。这种韧性凸显了三个关键驱动因素:
l 目前还没有替代方案:DMD是由于抗肌萎缩蛋白基因突变导致进行性肌肉损失。辉瑞的 PF-06939926 其 III 期 CIFFREO 试验失败,并于 2024 年 7 月因缺乏疗效而终止开发。REGENXBIO 的 RGX-202临床试验仍处于 III 期阶段,最早可能也要到 2026 年底才能上市。
l 有行动能力患者(ambulatory patients)安全性良好:该组别未见死亡报告,支持继续使用。
l 无行动能力患者(non-ambulatory patients)风险可控:Sarepta 已提交对 Study 103(ENDEAVOR)中第 8 队列(最多 25 名患者)的修正方案,以评估使用西罗莫司的增强型免疫抑制方案。这将是全球唯一一项针对无行动能力患者 DMD 患者正在进行的临床试验,有可能解决巨大的未满足需求。
在 2025 年世界肌肉协会会议上,Sarepta 分享了新的 Elevidys 数据,强化了其在有行动能力患者中的益处,包括持续的运动功能改善。
2.2 2026 年第一季度应会好转
Sarepta 预计,由于FDA要求的暂停发货导致的系列连锁反应,Elevidys 在 2025 年第四季度的输注量将持平或略低。然而,第三季度被推迟的输注迅速重启,大部分取消的订单被重新预订。新的患者识别虽然延迟,但正在恢复。
这些延迟所积累的潜在需求使得 2026 年第一季度有望释放。
3. 为何这是祸福相依?
Sarepta 作为超罕见疾病反义寡核苷酸和基因疗法领域的领导者,面临暂时的逆风。然而,这些挑战——试验挫折和安全性审查——可能会迫使其运营效率提升,正如近期重组(第三季度运营现金流为正)和研发管线进展所显示的那样。
市场的过度反应,对于高风险的生物科技企业而言并不罕见。客观且深入分析每个公司在至暗时刻所面临的挑战和机遇更有裨益,正如当下的Sarepta,可以说是祸福相依。
附录:临床试验比较(NS Pharma的Viltepso 对比 Sarepta 的 ESSENCE)