AXL 靶向新突破!pH依赖性ADC实现肿瘤专属杀伤
AXL 靶向新突破!pH依赖性ADC实现肿瘤专属杀伤
在癌症治疗的 “靶点图谱” 中,AXL 酪氨酸激酶受体始终是一个让人又爱又恨的存在。它像一把 “双刃剑”—— 在正常组织中,它调控造血功能、清除凋亡细胞、维护血管稳定;可在肿瘤微环境(TME)里,它却摇身一变,成为推动癌症进展、耐药、转移的 “帮凶”。
多年来,科学家们一直试图 “驯服” AXL,但裸抗需要高剂量才能起效,传统抗体药物偶联物(ADC)又因 AXL 在正常组织的表达引发脱靶毒性,让这一靶点的治疗潜力始终难以释放。
Mecbotamab vedotin(BA3011) 新型 ADC 出现,局面终于被打破。近期发表在《Antibody Therapeutics》的研究,详细披露了这款 AXL 特异性 “条件激活生物 ADC” 的临床前数据 —— 它借助独特的 pH 依赖性结合机制,在酸性肿瘤微环境中精准结合 AXL,在正常组织中却 “低调隐身”,既实现了强效抗肿瘤,又大幅降低了毒性。今天,我们就来深入解读这款潜在新药的创新之处与临床前表现。
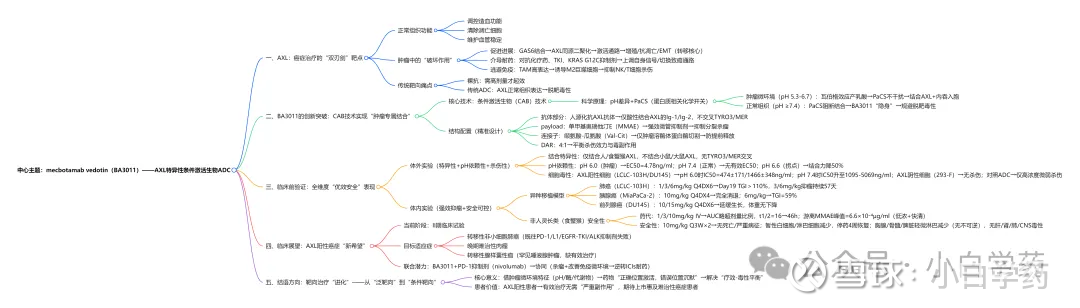
一、先搞懂:为什么 AXL 是癌症治疗的 “关键靶点”?
要理解 BA3011 的价值,首先得清楚 AXL 在癌症中的 “破坏力”。作为 TAM 家族(包括 TYRO3、AXL、MER)的重要成员,AXL 是一种 140kDa 的跨膜酪氨酸激酶受体,由胞外的 2 个免疫球蛋白样结构域、2 个纤连蛋白 III 型重复序列,以及胞内的酪氨酸激酶结构域组成。
它的 “作恶路径” 主要有三条:
促进肿瘤进展AXL 的配体 GAS6 结合后,会引发 AXL 同源二聚化,激活下游信号通路,推动肿瘤细胞增殖、抑制凋亡,还会诱导上皮 - 间质转化(EMT)—— 这是肿瘤转移的 “核心步骤”;
介导治疗耐药无论是化疗药还是酪氨酸激酶抑制剂(TKI),甚至是 KRAS G12C 抑制剂(如 adagrasib、sotorasib),AXL 都能通过上调自身信号或切换致癌通路,帮助肿瘤细胞 “逃脱” 药物攻击;
逃避免疫监视AXL 在肿瘤相关巨噬细胞(TAM)上高表达,会诱导巨噬细胞向 “促肿瘤” 的 M2 型转化,抑制 NK 细胞、T 细胞的杀伤功能,为肿瘤构建 “免疫庇护所”。
更棘手的是,AXL 在非小细胞肺癌、前列腺癌、胰腺癌、肉瘤等多种实体瘤,以及部分血液瘤中均有过表达,覆盖人群广泛。
但它的 “广谱性” 也带来了麻烦 —— 正常组织(如血管平滑肌细胞、巨噬细胞、造血细胞)中也存在 AXL,这让传统靶向药物很难 “区分敌我”,容易误伤正常细胞。
二、创新突破:CAB 技术让 ADC 实现 “肿瘤专属结合”
针对 AXL 靶向治疗的核心痛点 ——“脱靶毒性”,BA3011 的研发团队提出了一个巧妙的解决方案:条件激活生物(Conditional Active Biologic, CAB)技术。
简单来说,这款 ADC 的 “抗体部分” 被设计成了 “环境敏感型”—— 它能感知肿瘤微环境与正常组织的 pH 差异,只在酸性的肿瘤区域结合 AXL,在碱性的正常组织中则 “解绑”,从而实现 “精准打击”。
1. 背后的科学原理:pH 差异与蛋白质化学开关
肿瘤细胞因 “瓦伯格效应”(偏好无氧糖酵解),会持续产生乳酸,导致肿瘤微环境的 pH 值降至5.3-6.7;而正常组织的生理 pH 值稳定在7.4 左右。
BA3011 正是利用了这一关键差异,再结合 “蛋白质相关化学开关(Protein-associated Chemical Switches, PaCS)”—— 一种天然存在的生理化学物质,能调控抗体与靶点的结合能力。
具体来说:
在肿瘤微环境(pH 5.3-6.7):PaCS 不干扰抗体与 AXL 的结合,BA3011 能高效识别并结合 AXL,随后通过内吞作用进入肿瘤细胞;
在正常组织(pH ≥7.4):PaCS 会与抗体或 AXL 结合,阻断两者的相互作用,使 BA3011 几乎不与正常细胞上的 AXL 结合,从而避免脱靶毒性。
2. BA3011 的 “结构配置”
除了 CAB 技术带来的靶向性,BA3011 的 “payload - 连接子” 组合也经过精心设计:
抗体部分人源化抗 AXL 抗体,经过突变筛选,确保仅在酸性环境中与 AXL 的免疫球蛋白样结构域(Ig-1 和 Ig-2)结合,且不与 TAM 家族的 TYRO3、MER 交叉反应,进一步提升特异性;
Payload单甲基奥瑞他汀 E(MMAE),一种强效微管抑制剂,能通过抑制细胞分裂杀死肿瘤细胞;
连接子缬氨酸 - 瓜氨酸(Val-Cit)蛋白酶可切割连接子,仅在肿瘤细胞内的溶酶体蛋白酶作用下才会断裂,释放 MMAE,避免 payload 在血液中提前释放导致毒性。
此外,BA3011 的药物抗体比(DAR)为 4:1—— 这是经过优化的比例,既能保证足够的杀伤效力,又能减少游离 payload 带来的毒副作用。
三、临床前验证:从实验室到动物模型的 “全优表现”
为了验证 BA3011 的有效性和安全性,研究团队开展了一系列严格的临床前实验,从体外细胞实验到动物模型,全方位评估其性能。
1. 体外实验:特异性、pH 依赖性、细胞杀伤能力均达标
(1)结合特异性:只认 AXL,不 “认错人”
通过 ELISA 和流式细胞术实验,研究人员证实:
BA3011 能强效结合人 AXL和食蟹猴 AXL(为后续非人灵长类安全性研究奠定基础),但完全不结合小鼠、大鼠的 AXL;
对 TAM 家族的另外两个成员 ——TYRO3 和 MER,BA3011 也无交叉结合,排除了 “误伤” 其他受体带来的副作用;
结合位点精准定位在 AXL 的 Ig-1 和 Ig-2 结构域,这是 AXL 与配体 GAS6 结合的关键区域,意味着 BA3011 还能同时阻断 GAS6-AXL 信号通路,实现 “双重抑制”。
(2)pH 依赖性:严格遵循 “肿瘤环境激活”
pH 亲和 ELISA 实验显示:
在 pH 6.0(模拟肿瘤微环境)时,BA3011 与 AXL 的结合 EC50 仅为4.78 ng/ml,结合能力极强;
在 pH 7.4(模拟正常组织)时,即使提高抗体浓度,BA3011 也几乎不与 AXL 结合,无法计算出有效 EC50;
进一步的 pH 梯度实验(pH 6.0-7.4)发现,BA3011 的结合活性在 pH 6.6 时出现 “拐点”—— 此时结合能力降至 pH 6.0 时的 50%,这意味着它在接近正常组织 pH 的环境中会快速 “失活”。
(3)细胞毒性:只杀 AXL 阳性肿瘤细胞
在 AXL 阳性的肿瘤细胞系(肺癌 LCLC-103H、前列腺癌 DU145)和 AXL 阴性细胞系(293-F)中,BA3011 的杀伤效果差异显著:
在 pH 6.0 条件下,BA3011 对 LCLC-103H 的 IC50 为474 ± 171 ng/ml,对 DU145 的 IC50 为1466 ± 348 ng/ml,呈现明显的剂量依赖性杀伤;
在 pH 7.4 条件下,BA3011 的杀伤活性大幅下降(IC50 提升至 1095-5069 ng/ml),说明其在正常组织环境中毒性极低;
对 AXL 阴性的 293-F 细胞,即使使用高浓度 BA3011,也几乎无杀伤作用;
作为对照的 “非靶向 ADC(B12-MMAE)” 仅在极高浓度下有微弱杀伤,进一步证实 BA3011 的 cytotoxicity 是 AXL 特异性依赖的。
2. 体内实验:强效抑瘤 + 良好安全性
(1)异种移植模型:多种癌症均显效
研究团队在三种常见实体瘤的小鼠异种移植模型(CDX)中测试了 BA3011 的抗肿瘤效果,结果令人振奋:
肺癌(LCLC-103H)模型给 NOD/SCID 小鼠静脉注射 1、3、6 mg/kg BA3011(每 4 天 1 次,共 6 次),在第 19 天时,三组的肿瘤生长抑制率(TGI)均超过 110%(意味着肿瘤体积缩小),且 3 mg/kg 和 6 mg/kg 组的抑瘤效果持续至 57 天,无明显复发;
胰腺癌(MiaPaCa-2)模型
10 mg/kg BA3011(每 4 天 1 次,共 4 次)实现了完全肿瘤消退,6 mg/kg 组的 TGI 达 59%,显著优于对照组;
前列腺癌(DU145)模型10 mg/kg 和 15 mg/kg BA3011 能持续延缓肿瘤生长,且小鼠体重无明显下降,说明在有效剂量下安全性良好。
(2)非人灵长类安全性:高剂量耐受,毒性可逆
为了评估临床转化潜力,研究团队在食蟹猴中开展了药代动力学(PK)和毒性研究:
药代特征单次静脉注射 1、3、10 mg/kg BA3011 后,药物在体内的暴露量(AUC)随剂量增加呈略超比例上升,半衰期(t1/2)从 1 mg/kg 时的 16 小时延长至 10 mg/kg 时的 46 小时,说明药物在体内代谢稳定,且无明显蓄积;游离 MMAE 的峰值浓度极低(10 mg/kg 组仅 6.6×10⁻⁴ μg/ml),且快速清除,减少了系统毒性风险;
安全性在最高 10 mg/kg 的重复给药(每 3 周 1 次,共 2 次)中,食蟹猴未出现死亡或严重 morbidity,仅观察到暂时性白细胞减少(尤其是中性粒细胞) 和淋巴细胞亚群(CD3+、CD4+、CD8 + 等)轻度下降,但在停药后 4 周内完全恢复;
靶器官影响胸腺、骨髓、脾脏出现轻微淋巴组织减少,但无不可逆损伤,且未观察到肝、肾、肺、中枢神经系统等关键器官的毒性 —— 这与传统 AXL ADC(如 Enapotamab Vedotin)的严重胃肠道毒性形成鲜明对比。
四、临床展望:为 AXL 阳性癌症患者打开新通道
BA3011 的临床前数据,不仅解决了 AXL 靶向治疗的 “脱靶毒性” 难题,还为多种难治性癌症提供了新的治疗思路。目前,这款药物已进入II 期临床试验阶段,针对的适应症包括:
既往接受过 PD-1/L1 抑制剂、EGFR-TKI 或 ALK 抑制剂治疗失败的转移性非小细胞肺癌;
晚期难治性肉瘤;
转移性腺样囊性癌(一种罕见的唾液腺肿瘤,目前缺乏有效治疗手段)。
更值得期待的是,BA3011 的联合治疗潜力。由于 AXL 能介导免疫检查点抑制剂(ICIs)的耐药,研究团队已启动 BA3011 联合 PD-1 抑制剂(nivolumab)的临床试验,探索 “ADC + 免疫” 的协同效应 —— 理论上,BA3011 既能直接杀死肿瘤细胞,又能通过抑制 AXL 改善肿瘤微环境的免疫抑制状态,增强 ICIs 的疗效。
结语:精准靶向的 “下一站”—— 从 “靶向” 到 “条件靶向”
BA3011 的临床前研究,不仅验证了一款新药的潜力,更代表了癌症靶向治疗的一个重要方向:从 “泛靶向” 到 “条件靶向”。
通过利用肿瘤微环境的独特特征(如 pH、酶表达、代谢物等),让药物在 “正确的地方” 激活,在 “错误的地方” 沉默,这或许是解决靶向药物 “疗效 - 毒性平衡” 的关键。
对于 AXL 阳性癌症患者而言,BA3011 的出现意味着 “有效治疗” 不再需要以 “严重副作用” 为代价。随着临床研究的推进,我们期待这款新型 ADC 能早日上市,为更多难治性癌症患者带来希望。