VEGF/PD-1/CTLA-4三抗相关
以下是基于全球公开信息整理的专注于 VEGF/PD-1/CTLA-4三抗布局的核心企业及其研发进展:
💊 一、核心三抗玩家(PD-1/VEGF/CTLA-4靶点)
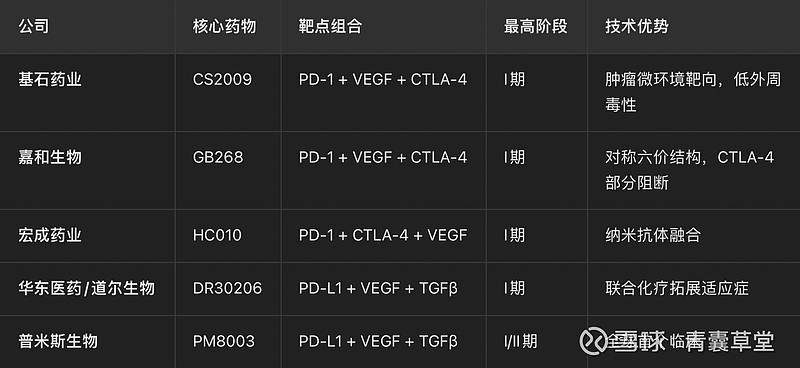
1. 基石药业(02616.HK)
核心药物:CS2009(PD-1/VEGF/CTLA-4三抗)
技术亮点:
采用 单价PD-1/CTLA-4臂 + 双价VEGF臂,优先结合肿瘤浸润T细胞(PD-1/CTLA-4双阳性),减少外周毒性。
临床前数据:肿瘤抑制率显著优于PD-1/CTLA-4双抗、PD-1/VEGF双抗及联合疗法。
临床进展:
Ia期:完成4个剂量组评估(至20mg/kg),未出现剂量限制毒性(DLT);正在30mg/kg剂量组入组,同步回填低剂量组。
计划:2025年下半年启动Ib/II期扩展研究,2025Q4公布Ia期完整数据(安全性、PK/PD、抗肿瘤活性)。
适应症:覆盖非小细胞肺癌、肝癌、胃癌等晚期实体瘤。
2. 嘉和生物(06998.HK)
核心药物:GB268(PD-1/VEGF/CTLA-4三抗)
技术亮点:
对称六价结构(抗PD-1/CTLA-4的VHH抗体 + 抗VEGF常规抗体),CTLA-4臂部分阻断以降低毒性。
临床进展:
I期启动:2025年4月登记实体瘤I期临床试验(NCT编号未公开),评估安全性、耐受性及疗效。
临床前:食蟹猴毒理研究显示无严重不良反应,肿瘤抑制率优于康方AK112(PD-1/VEGF双抗)。
3. 宏成药业
核心药物:HC010(PD-1/CTLA-4/VEGF三抗)
技术路径:PD-1 scFv + CTLA-4纳米抗体融合至VEGF抗体。
临床进展:I期进行中,针对晚期实体瘤(具体数据未披露)。
🔬 二、拓展靶点组合玩家(PD-(L)1/VEGF/TGFβ三抗)
此类企业通过增加TGFβ靶点进一步调控肿瘤微环境,与PD-1/VEGF/CTLA-4三抗形成差异化竞争:
华东医药/道尔生物
药物:DR30206(PD-L1/VEGF/TGFβ三抗)
进展:2023年6月获批临床,2025年4月新增联合化疗用于消化道肿瘤的临床试验。
普米斯生物
药物:PM8003(PD-L1/VEGF/TGFβ三抗)
进展:全球首个进入临床的同类药物(2021年启动I/II期),适应症为晚期实体瘤。
药物:SCTB41(PD-(L)1/VEGF/TGFβ三抗)
进展:临床前阶段,未公开进展细节。
📊 三、全球多抗研发格局对比
⚠️ 四、挑战与行业趋势
技术壁垒:
毒性控制:CTLA-4靶点易引发免疫过度激活(如结肠炎),需通过分子设计优化(如基石/嘉和的差异化阻断策略)。
工艺复杂度:三抗纯度高要求(>95%)、稳定性难保障,规模化生产挑战大。
临床定位:
目标患者:聚焦PD-(L)1耐药/低响应“冷肿瘤”、多线治疗失败患者,替代双抗或联合疗法。
疗效验证:需头对头对比PD-1/VEGF双抗(如康方依沃西)及PD-1+CTLA-4联合疗法(如O+Y方案)。
市场前景:
治疗成本:三抗定价或达双抗2倍以上(预计终端年费用15万–20万),需显著疗效优势支撑医保准入。
竞争加剧:全球32款PD-(L)1三抗在研(6款进入临床),中国占全部临床阶段项目。