药品优先审评的相关情况
2026年1月7日,$丽珠集团(SZ000513)$ 和$健康元(SH600380)$ 发布公告,莱康奇塔单抗注射液被纳入优先审评审批程序。这里简单介绍一下,纳入优先审评,对于评审周期的影响。
1、基础知识
丽珠莱康奇塔单抗注射液的受理号:CXSS2500144。
首位C代表CHINA(如果是进口则首位为J);次位X代表新药(另有常见的Y,代表仿制药);第三位S代表生物药(另有常见的Z代表中药,H代表化药);第四位S代表申报上市(另有L代表临床,B代表补充申请)。
组合起来,CXSS即中国、新药、生物药、上市申请。
随便说几个:JXHL:进口、新药、化药、临床申请;CYHS:中国、仿制药、化药、上市申请。
上市申报、药审部门承办后,会分配受理号。
阶段一:审评。漫长的排队等待时间,完成药理毒理、临床、药学、统计、临床药理、合规这几个方面的审查。药审部门需在200个工作日内完成审评。
阶段二:审查完成后,药审部门通常会要求企业对申报内种中不完善的某些资料进行补充(常说的发补),企业完善信息,必须在80个工作日内完成补充资料上报。发补原则上是一次,但也经常遇到发补两次、甚至三次的情况,0次比较罕见(总能挑出点问题来)。
阶段三:企业发送补充材料,再次排队、等待审评。药审部门在67个工作日应完成发补资料的审评(即200个工作日的1/3)。
若审评通过,则离开发补任务,随后几天会批准生产、分配国药准字文号。
2、常规品种(非优先审评)审评周期
列几个常规品种,可以观察一下审评时间:
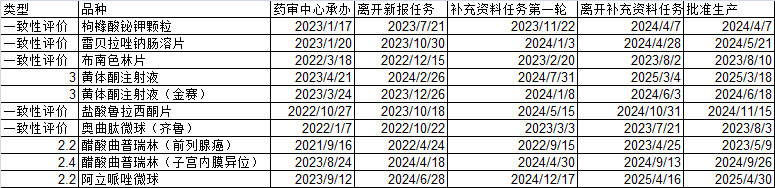
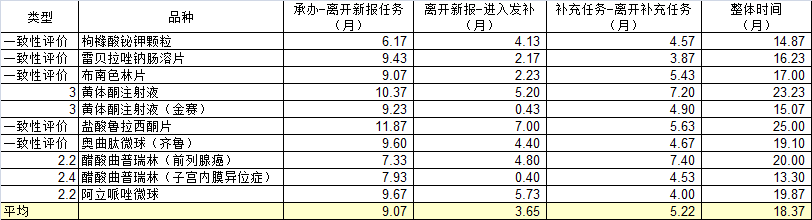
从审评情况可以看到,从递交上市申请,到获批,最快的接近15个月(曲普瑞林为新增适应症,耗费13.3个月),最慢的达到25个月。平均时间为18.37个月(不含曲普瑞林新适应症为18.93个月)。
3、优先审评品种的时间周期
优先审评主要在于能插队。常规审评200个工作日(不含企业完善补充材料、对补充材料审评),但优先审评品种要求在120个工作日内完成。
列几个近年来获批的优先审评品种的情况:
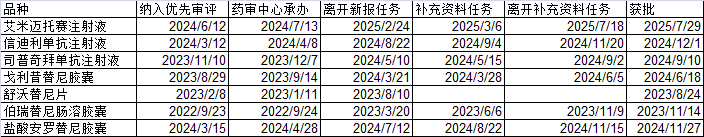
随机统计的7个品种中:首次申报平均5.6个月,发补审评平均3个月(舒沃替尼一次过、未发布),从药审部门承办到获批,平均9.7个月。对比普通审评的18.93个月,节约了大概一半的时间。
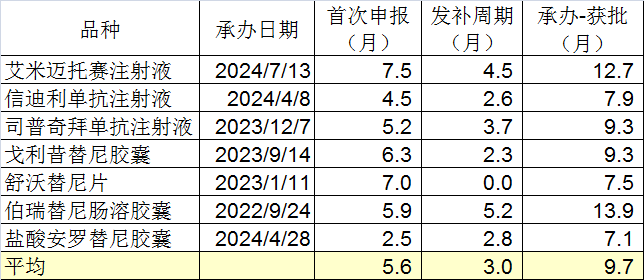
由此计算,丽珠的IL-17A/F,预计会在2026年10月份获批。
严格意义上说,这个优先审评象征意义不错,实际效果一般。不进医保必然无法放量;但2026年上半年获批的品种,才有资格进入2027的医保国谈,丽珠的IL-17A/F虽然纳入优先审评,但除非奇迹发生,否则会错过2026年11月的国谈,只能去参与2027年10月进行的2028年国谈。
4、纳入优先审评的条件
根据药品注册管理办法第六十八条规定:
第六十八条 药品上市许可申请时,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:
(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;
(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;
(三)疾病预防、控制急需的疫苗和创新疫苗;
(四)纳入突破性治疗药物程序的药品;
(五)符合附条件批准的药品;
(六)国家药品监督管理局规定其他优先审评审批的情形。
丽珠这个品种,是按照“(六)国家药品监督管理局规定其他优先审评审批的情形”这点申报获批的。
查阅了一下,按照条件一“临床急需”的其实并不多,多数是条件四“纳入突破性治疗药物程序”、条件五“符合附条件批准的药品”和第六条“其他”。
5、优先审评的数量
丽珠历史上,7条优先审评记录(实际4个品种)。2023年以来,这是第一个。
2023年以来,纳入优先审评的品种,一共370条。
各企业做个对比:
恒瑞医药历史上累计51条优先审评记录。2023年以来4条、3个品种。2025年以来1个没有。
正大天晴历史上40条记录(18条为盐酸安莫替尼)。2023年以来9条(6条为盐酸安莫替尼)、4个品种。
石药历史上35条记录,2023年以来2条、1个品种(2条都是苯甲酸安达替尼胶囊)。
科伦历史上9条记录,2023年以来4条(3条注射用芦康沙妥珠单抗)、2个品种。
华海历史上40条记录(均为仿制药),2023年以来0条。
长春高新(金赛)历史上9条记录(8条重组人生长激素注射液),2023年以来1条(聚乙二醇重组人生长激素注射液)。
人福历史上23条记录,2023年以来0条。