小核酸减肥药,开年继续爆

如果2025年属于GLP-1,那么2026年开年,市场已急切地追问:在这条已然拥挤的赛道上,下一代王者将凭何胜出?
答案或许在于——在减重之外,能否创造更稀缺、更深刻的健康价值。
继2025年12月Wave凭借早期数据引爆市场后,1月6日,另一巨头Arrowhead Pharmaceuticals紧跟着投下一枚“深水炸弹”,公布了其两款RNAi管线(ARO-INHBE和ARO-ALK7)的I/IIa期临床试验中期结果。
初步数据显示,截至目前,在肥胖2型糖尿病患者中,相较于单独使用替尔泊肽,ARO-INHBE与替尔泊肽联用时,实现体重减轻幅度翻倍,并使内脏脂肪、总脂肪和肝脏脂肪的减少幅度提升3倍。
与此同时,ARO-ALK7的早期结果则首次在人体中证明,Activin E/ALK7通路(一条经过遗传学验证的调节脂肪储存的通路)可能被用于治疗,以改善肥胖2型糖尿病患者的身体成分,并增强减重效果,优于单独的替尔泊肽治疗。
市场对此报以热烈反响。消息公布后,Arrowhead股价应声上涨20%,最高至76美元/股,公司盘中市值曾一度突破100亿美元。$Arrowhead制药(ARWR)$
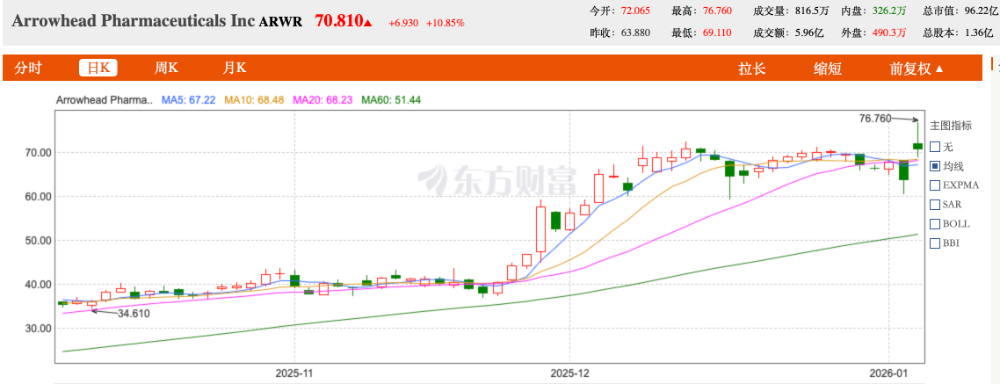
在GLP-1重塑的市场格局中,新一轮以“价值创造”为核心的竞赛,已由小核酸赛道率先鸣枪。
当全球制药巨头们正虎视眈眈,寻找下一个足以定义时代的突破。Arrowhead这开年“第一炮”,不仅是为自己吹响了号角,也无疑为整个减肥治疗领域,拉开了后GLP-1时代更具深度的技术角逐序幕。
01
INHBE数据首轮交锋
通过降低肝脏INHBE基因表达及下游激活素E水平发挥作用,作为经过遗传学验证的肥胖黄金靶点,INHBE靶点已成为小核酸企业切入减重市场的首选。
Wave旗下WVE-007便是靶向INHBE,根据此前公布的I期人体试验中期数据:WVE-007单次皮下注射240毫克三个月后,内脏脂肪减少9.4%,全身总脂肪减少4.5%,而瘦体重(肌肉等非脂肪组织)增加了3.2%。
经安慰剂调整后,单次剂量的WVE-007通过DEXA测量,导致内脏脂肪减少9.2%,总脂肪质量减少4.0%,瘦体重增加0.9%,总质量减少0.9%。
详细来看Arrowhead这次公布的最新数据:
ARO-INHBE单药治疗(单次给药,第16周)实现平均内脏脂肪减少9.9%;(两次给药,第24周)安慰剂校正后平均内脏脂肪减少15.6%;且单次给药治疗使瘦肌肉组织增加3.6%。
除了单药数据,Arrowhead还重点展示了其与GLP-1药物的协同潜能。

在为期16周的试验中,4名接受两剂ARO-INHBE联合替尔泊肽治疗的肥胖合并2型糖尿病患者,体重平均降低了9.4%,相较于单独使用替尔泊肽的-4.8%,改善幅度约达两倍。
与此同时,该联合疗法还显著促进脂肪减少,包括内脏脂肪减少23.2%、总脂肪减少15.4%,以及肝脏脂肪减少76.7%——在肥胖糖尿病患者中,所有这些指标较替尔泊肽单药治疗均提升约3倍。
安全性与耐受性上,截至目前,ARO-INHBE作为单药治疗以及与替尔泊肽联合治疗在伴有或不伴有2型糖尿病的肥胖受试者中总体耐受性良好。大多数治疗中出现的不良事件(TEAE)为轻度。
Wave凭借时间差优势,率先公布了令人鼓舞的单药人体数据,证明了该靶点在“减重增肌”上的潜力。
而Arrowhead紧随其后,在单药数据之外,以更具说服力的联合疗法数据,展示了小核酸与现有GLP-1药物联用可能带来的“增效革命”。
02
ALK7的平台突破
如果说INHBE是战场,那么ALK7则代表了向新大陆的远征。
Arrowhead是唯一拥有两款临床阶段减重小核酸管线的全球领跑者,除了ARO-INHBE,旗下还拥有靶向ALK7的ARO-ALK7,彰显了其通过双靶点策略切入肥胖治疗市场的野心。
ALK7是INHBE所编码配体(Activin E)的下游受体ALK7,表达相对集中于脂肪组织,一旦被激活将启动细胞内的SMAD2/3信号通路,下达“减少脂肪分解,增加脂肪储存”的指令。
由于INHBE主要表达在肝脏中,正好发挥GalNAc靶向肝的能力,成为各家小核酸企业进入减肥领域的首选,而ALK7作用在脂肪细胞,更依赖先进的肝外递送技术才能有效发挥作用。
为此,Arrowhead构建了脂肪细胞靶向小核酸递送平台——TRiM Adipose递送系统,既能实现对白脂肪组织(iWAT与pgWAT)的精准进入,也能在adipocyte内部看到siRNA的定位,同时具备极强的长效性。
作为全球首款靶向脂肪组织的RNAi在研疗法,这次ARO-ALK7数据公布,也是搭载的TRiM-Adipose 递送系统首次进行人体验证。
ARO-ALK7的早期结果显示,受试者的脂肪组织ALK7 mRNA水平呈现剂量依赖性降低。在200毫克剂量组,第8周时的平均降低幅度达到88%。单次给药8周后,与安慰剂相比,内脏脂肪平均减少14.1%。
在安全性与耐受性上,截至目前,ARO-ALK7作为单药在肥胖受试者中总体耐受性良好。未发现具有临床意义的实验室异常趋势(包括肝酶和血糖指标)。大多数TEAE为轻度,未导致研究或用药中断,亦未报告SAE。
Arrowhead首席医疗官兼研发主管James Hamilton指出:“ARO-ALK7耐受性良好,敲低数据证实了我们在动物模型中观察到的药效学特征在人体中得到了转化,并验证了我们的技术平台能够将siRNA 递送至脂肪细胞。”
相比INHBE,ARO-ALK7的意义更体现在平台层面,不仅初步验证了Arrowhead的递送平台,也真正回答了一个长期悬而未决的问题,RNAi能不能稳定进入脂肪组织,而不是只停留在肝脏。
这也意味着小核酸减肥疗法将从“仅能调控肝脏分泌因子”进化到“可直接编程脂肪细胞本身”,治疗潜力或将维度性提升。
03
“三强”竞逐下的未来之战
Wave与Arrowhead的早期数据,双双引爆市场,背后是小核酸技术对减肥治疗范式的根本性重构。
GLP-1的成功建立在一个简单直接的逻辑上:作用于大脑,减少饥饿感,让人自然而然地吃得少。但它的痛点同样突出:停药后超过80%的体重反弹率,伴随减重发生的25%~40%肌肉流失,以及令人困扰的胃肠道副作用等。
小核酸药物走的是一条完全不同的路径,它不通过中枢神经系统抑制食欲,而是直接在基因层面干预脂肪代谢的关键靶点。想象一下,传统药物是在下游堵截,而小核酸则是直接关掉上游的“脂肪生产开关”。
凭借其“减脂保肌”的独特机制、长效给药的便利性以及与GLP-1联用的协同潜力,小核酸从基因层面为肥胖治疗提供全新的解决方案。它并非GLP-1的简单模仿者,而是以重塑身体成分为目标,直击现有疗法的核心痛点。
目前,围绕小核酸减肥药的赛道上,已经形成了清晰的领先阵营。
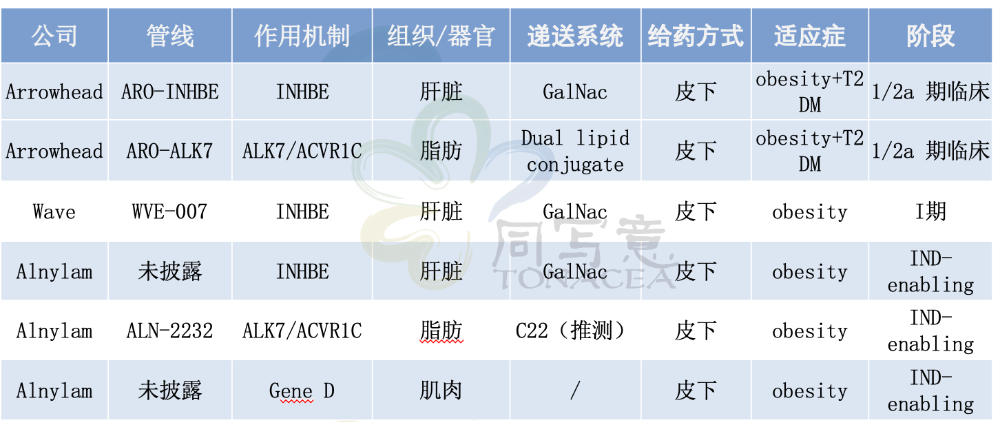
作为小核酸领域的老牌企业,Arrowhead凭借双靶点矩阵与已被初步验证的脂肪递送平台,构建了更宽、更深的护城河,其战略是提供从肝脏到脂肪的全方位代谢调控解决方案。
按着规划,Arrowhead接下来将通过多种方式扩展现有研究,包括增加患者数量以提高统计效力、延长随访时间,以更好地了解药物的持久性和长达一年的活性,在肥胖合并糖尿病患者中启动单药治疗队列,以及启动与其他 GLP类药物联合治疗的额外队列,
同时,尽快推进至II期研究,包括在肥胖合并糖尿病患者中开展与替尔泊肽及其他GLP类药物的联合治疗研究,以及探索ARO-INHBE和ARO-ALK7作为 GLP 类药物停药后维持治疗的研究。此外,重点扩展肥胖症研发管线。
Wave作为黑马选手,凭借WVE-007的I期临床数据惊艳市场,目前正在规划II期临床试验,探索其作为单药、联合疗法及维持疗法的多元应用场景。
相对,Alnylam进度略慢,但布局最全面,IND-enabling阶段的分子覆盖了INHBE(肝脏靶向)、ALK7(脂肪靶向)、Gene D(肌肉靶向)。
很显然,竞争的核心已不仅限于临床数据的读出,更延伸至技术平台的验证、应用场景的广度以及靶点覆盖的深度——三强竞逐,谁先撞线,仍待分晓。
正如Arrowhead投资者会议开场引用西西弗斯形象所作的比喻——小核酸引领的革命,旨在不再让肥胖症患者单纯地 “少吃多动”,而是移开那块 “巨石”,通过有效的治疗手段来攻克这一疾病。
2026年的开场昭示着,以小核酸为代表的下一代疗法,正通过改写身体的“代谢语言”,开启以质量优于重量、健康重于数字为核心的全新减重篇章。