百利天恒食管癌ADC新药报产,远大医药RDC、兴齐眼药近视新药齐获进展
文 李咏诗 整理 医药经济报
百利天恒食管癌ADC新药上市获受理
1月20日,CDE官网显示,百利天恒1类新药注射用BL-B01D1 新适应症上市申请获受理,用于既往经 PD-1/PD-L1 单抗联合含铂化疗治疗失败的复发性或转移性食管鳞癌患者。此前,该适应症已被 CDE 纳入优先审评。
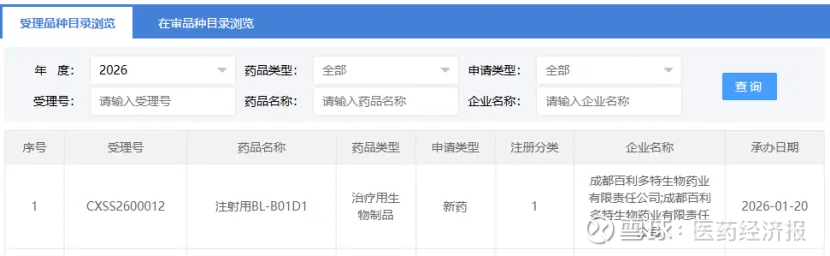
截图来源:CDE官网
BL-B01D1(Iza-bren,伦康依隆妥单抗)是一款全球首创双抗 ADC,通过双重作用机制阻断EGFR 和 HER3 向肿瘤细胞传递的信号,从而抑制其增殖与存活信号。此外,通过抗体介导的内吞作用,BL-B01D1 释放的治疗性有效载荷可引发基因毒性应激,最终导致肿瘤细胞死亡。
兴齐眼药一款滴眼液获批临床
1月19日,CDE官网显示,兴齐眼药申报的SQ-24071 滴眼液获批临床,拟用于延缓儿童及青少年的近视进展。根据公开资料,这是该药首次获批临床。
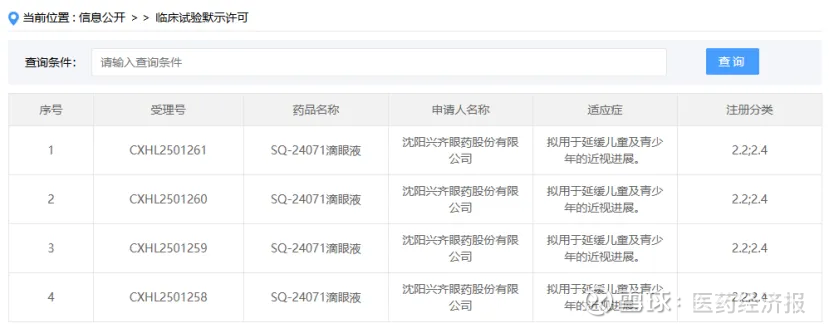
截图来源:CDE 官网
SQ-24071滴眼液为兴齐眼药研发的化学药品2.2;2.4类改良型新药。根据改良型新药的有关要求, 兴齐眼药已经完成SQ-24071滴眼液药学及非临床药理毒理学等多方面的研究,研究结果表明SQ-24071滴眼液具有良好的安全性及临床开发价值。
远大医药创新RDC国内申报上市
1月19日,远大医药发布公告,其用于诊断前列腺癌的创新在研放射性核素偶联药物(RDC)TLX591-CDx(Illuccix®, gallium Ga 68 PSMA-11)近日正式向药监局递交了新药上市申请(NDA),并获得受理。另外,远大医药用于治疗前列腺癌的RDC产品TLX591已在中国获批加入国际多中心 Ⅲ 期临床研究。

截图来源:远大医药公告
本次NDA申请包含了TLX591-CDx中国临床研究的数据,该研究于2025年12月公布了积极的初步结果。这是一项单臂、开放标签的Ⅲ期临床研究,在超过100例前列腺癌生化复发患者中使用 TLX591-CDx并进行正电子发射断层成像/电脑断层扫描(PET/CT)或正电子发射断层成像/磁共振成像(PET/MRI)检测,以评估产品的诊断有效性,同时评估产品在中国人群中的安全性和耐受性。
校对:陈丽娜
版式:李晚晚
审校:马 飞