聊聊基因编辑到全人抗体那点事儿 | 百奥赛图平台价值的高能输出
最近,基因编辑技术频频登上新闻头条。比如:
广州医科大学团队把经过基因编辑的猪肺移植到一位脑死亡患者体内,存活了9天,突破了器官移植的免疫屏障;
中科院研发出全球首个“可编程染色体编辑”技术,可以像搭积木一样精准操纵DNA,应用前景横跨农业和医疗。
这些成果让人们意识到:基因编辑早已不再是实验室里的“闭门造车”,它正加速改变医疗和产业格局。
基因编辑是什么?
通俗点说,如果把生命比作一部超级复杂的“代码程序”,基因就是其中的源代码。基因编辑,就是用更先进的“编辑器”去修改这段代码,让生命表现出新的特性。
在农业上,它能让番茄更好吃、产量更高;
在医学上,它能让猪器官更适合移植到人体;
在药物研发上,它能帮助科学家直接培育出“更像人类生理反应”的实验小鼠。
过去,人类曾用类似思路解决糖尿病:早期胰岛素需要从牛的胰腺里提取,既贵又不稳定。后来通过分子克隆技术,把“人类胰岛素基因”放进大肠杆菌里,让细菌来生产胰岛素,从此糖尿病患者才真正用得起药。
这,就是基因编辑力量的最好例子。
基因编辑与抗体药物:一场革命
医药资本市场很关注的一个领域是抗体药物。这是现代医药最重要的大分子药物类别之一。
简单来说:抗体药物是利用人体免疫系统中的“导弹”——抗体,去靶向攻击癌细胞或致病因子。第一代抗体药物从小鼠里获得,但因为“人鼠差异”,容易在人体里失效甚至引发过敏。于是,科学家开始让小鼠产生的抗体“更像人类抗体”:
嵌合抗体:人和鼠的混合抗体模式;
人源化抗体:再进一步,90%像人;
全人抗体:直接就是“人类版本”,免疫排斥最小。
全人抗体不仅仅是免疫原性更低,在技术方面与抗体人源化也有很大区别。抗体人源化的技术流程主要是:先在小鼠中免疫抗原,筛选获得特异性小鼠抗体,然后再用这个抗体做人源化改造,改造后获得候选序列,这些候选序列需要进一步通过检测亲和力、功能实验去筛选,最终获得目标分子。可以看出,抗体人源化过程非常的耗时耗力,而且序列经过人工改造后,很可能会破坏抗体的特异性和亲和力。
如果有一种方法能够直接获得全人序列的抗体,就可以省去上述的所有过程,在抗体药物开发过程中节省大量的时间和金钱,这属于颠覆性的技术变革。
表1. 在不同年代,FDA首次批准上市的抗体药物类型数量和比例
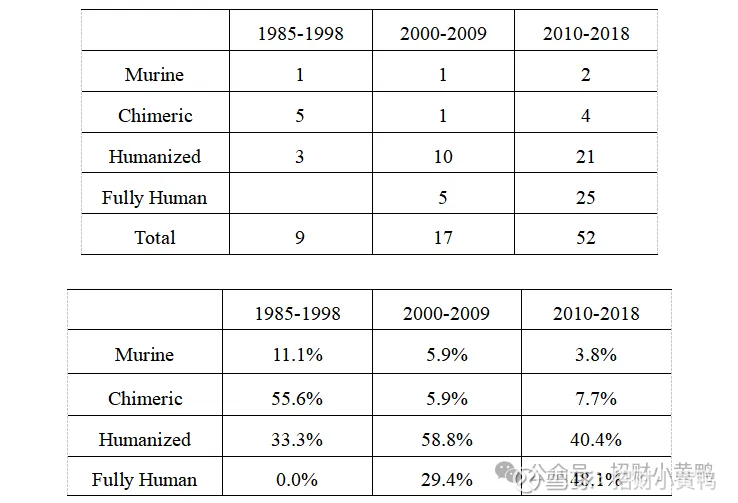
数据来源:网页链接
那么如何能够直接获得全人抗体呢?
理论上有三种方法。一是用抗原免疫人体,但实际不行,你不能拿人做实验工具。二是用全人噬菌体库,但这是体外方法,存在多种技术上的缺陷,比如抗体库本身并不是经过抗原免疫的,没有体内亲和成熟过程,轻重链错配问题,未经过免疫系统的阴性选择导致的特异性问题等等。第三种,也是理论上最理想的方法,将人类编码抗体的基因组序列转入到小鼠中,免疫后即可直接获得全人序列抗体,而且这些抗体经历过免疫系统的亲和成熟,最能还原天然抗体产生过程。
那全人抗体小鼠技术又经历了哪些迭代?
技术代差= 产业壁垒
在抗体药物研发的道路上,全人抗体小鼠技术被认为是迄今最好的抗体发现工具。通过这种技术,科学家能够在小鼠体内直接获得与人体一致的抗体序列,大大提高了新药研发效率。
回顾发展历程,全人抗体小鼠大体经历了三代进化。
第一代:奠基者的探索
上世纪90年代,第一代全人抗体鼠(UltiMab、XenoMouse)问世。它们首次实现了将人类抗体基因引入小鼠体内,推动了全人抗体药物的诞生。然而,由于采用的是早期的基因改造方式,存在一些局限:小鼠免疫系统功能不够完整,抗体多样性有限,部分序列缺失。这些缺点在当时是巨大的挑战,但仍然开创了行业的新时代。
第二代:突破与改进
进入21世纪,VelocImmune 和 Kymouse 代表了 第二代全人抗体鼠。
它们通过更先进的原位替换技术,解决了第一代在免疫功能和抗体多样性方面的不足,大幅提升了新药发现的效率。
不过,受限于当时的基因工程手段(BAC+ES 细胞改造),仍需要进行多轮改造,耗时耗力。例如:仅针对重链,再生元就用了9轮,Kymab用了15轮,且转入的抗体基因并不完整,依然存在改善空间。
第三代:全面升级
随着抗体药物形式的多样化(双抗、多特异性抗体、纳米抗体等),科研对小鼠平台的要求进一步提升。于是,出现了第三代全人抗体鼠,代表性平台包括百奥赛图的RenMab、RenLite、RenNano,以及产生全人TCR的RenTCR小鼠等。
这一代技术有两大升级:
更完整:将人类抗体基因片段“全部”转入小鼠,包括重链、轻链的所有可变区,最大程度保证抗体多样性。采用SUPCE(Size-Unlimited Precise Chromosome Engineering)技术,承载能力达到百 Mb,远超前代。
更精准:通过一次性替换,避免多轮拼接带来的错误。百奥赛图的RenMab 技术采用SUPCE,能“严丝合缝”地把人类抗体基因原位替换到小鼠基因组中,实现高稳定性和高保真度。
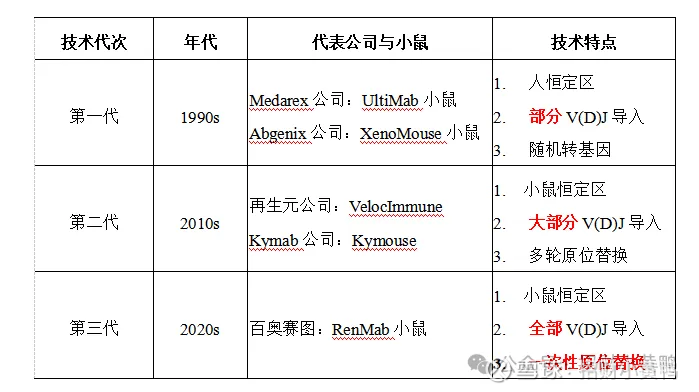
从第一代的“能做”,到第二代的“能用”,再到第三代的“更好用、能扩展”,全人抗体小鼠技术不断突破,成为推动抗体药物研发不可或缺的“发动机”。尤其在第三代阶段,技术不再局限于单克隆抗体的发现,还能支持双抗、三抗、多特异抗体,乃至后续全人 TCR 药物的研发,为全球新药创新打开了新的想象空间。
这背后的本质是底层基因编辑技术的壁垒。技术越先进,能做出的“药物候选分子”就越多样,研发效率更高。对于制药企业来说,这直接意味着时间成本和资金成本的大幅下降。
讲到这里,再来看看百奥赛图目前的基本面,依托SUPCE 超大规模精准染色体编辑技术,百奥赛图打造了全球领先的RenMice全人抗体/TCR小鼠平台。该平台覆盖全人单抗、双抗/双抗ADC、纳米抗体、全人TCR等系列产品的开发。目前,全球能同时掌握并迭代全系列抗体小鼠技术的企业屈指可数,百奥赛图正是其中之一。
在此基础上,公司发起了“千鼠万抗”计划:针对1000 多个潜在可成药靶点 进行大规模药物开发,并建立了超百万条全人抗体序列库,可供全球合作伙伴使用。简单讲,药企有了新的idea可直接从百奥赛图多元化的抗体库进行筛选,并快速进行概念验证,这一体系显著加快了研发节奏——将从临床前发现到候选分子确认(PCC)的周期从 平均 5.5 年缩短至 12–18 个月,大幅提升新药研发效率。而对于投资者而言,这类底层技术驱动型平台公司 意味着更高的技术壁垒和长期价值。
就企业自身而言,凭借在基因编辑和抗体研发上的深厚技术壁垒,百奥赛图逐渐成长为一家创新平台驱动的产品型企业。公司聚焦“靶点人源化动物模型” 与“全人抗体分子库” 两大核心业务,已成为全球抗体药物临床前研发的重要“行业基础设施”,并以“全球新药发源地”为愿景不断前行。
9月4日,百奥赛图宣布与默克签署合作协议,携手推进抗体偶联脂质递送解决方案,进一步彰显了其在全球创新药产业链中的平台价值与合作潜力。
8月28日,公司发布2025 年上半年业绩,公司实现营收6.21 亿元,同比增长 51.5%,净利润4800 万元,经营现金流全面转正,展现出强劲的自我造血能力。