阿斯利康首创高血压新药申报上市
来源:市场资讯
(来源:求实药社)
当地时间12月2日,阿斯利康宣布已向 FDA 递交 Baxdrostat 的新药申请,并已获 FDA 优先审评资格,作为其他抗高血压药物的辅助治疗,用于这些药物无法充分降低血压的情况,以治疗难治性高血压(未控制或治疗抵抗)成年患者。
PDUFA 生效日期预计将在 2026 年第二季度。此外新闻稿指出,如果获得批准,Baxdrostat 可能成为首个获得监管机构授权的醛固酮合成酶抑制剂。

此次新药申请是基于 III 期试验 BaxHTN 的数据。BaxHTN 是一项多中心、随机、双盲、安慰剂对照、平行分组的 III 期研究,旨在评估 Baxdrostat 在接受两种不同降压药物治疗但血压仍控制不佳的高血压患者,以及接受三种或以上降压药物(其中包括一种利尿剂)治疗但血压仍控制不佳的高血压患者中的安全性、耐受性及疗效。
在 2025 年欧洲心脏病学会(ESC)年会上,该研究的具体结果以最新突破性研究专场进行汇报。
结果显示,Baxdrostat 在 BaxHTN 试验中达到了主要和全部次要终点,在难控制高血压患者中实现了显著且持久的血压降低:
在治疗第 12 周时,Baxdrostat 2 mg 剂量组平均坐位收缩压较基线的绝对降幅为 15.7 mmHg,经安慰剂校正后的降幅为 9.8 mmHg。
1 mg 剂量组平均坐位收缩压的绝对降幅为 14.5 mmHg,经安慰剂校正后降幅为 8.7 mmHg。安慰剂组平均坐位收缩压下降5.8 mmHg。
上述结果在未控制和难治性高血压亚组中表现一致。
Baxdrostat 整体耐受性良好,未发现非预期的安全性事件。与安慰剂组(0.0%)相比,Baxdrostat 两个剂量组的明确诊断的高钾血症发生率较低。其安全性特征与作用机制一致,大多数不良事件为轻度。
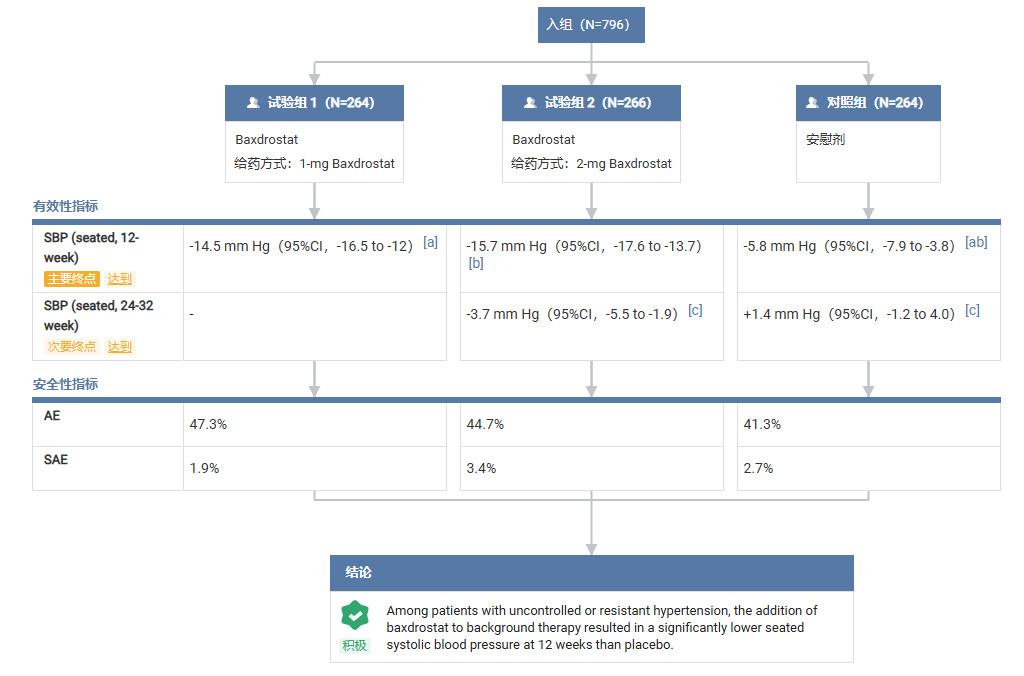
此外,Baxdrostat 也达到了所有确认性次要终点。其中,Baxdrostat 2 mg 剂量组展现出了持久的长期降压效果。2 mg 和 1 mg 剂量组均实现了更显著的舒张压降低,且患者收缩压<130 mmHg 的达标率较安慰剂组提升近三倍。
Baxdrostat 是一种有望成为首创新药的高选择性、强效口服小分子药物,可抑制醛固酮合酶,该酶由 CYP11B2 基因编码,负责肾上腺中醛固酮的合成。
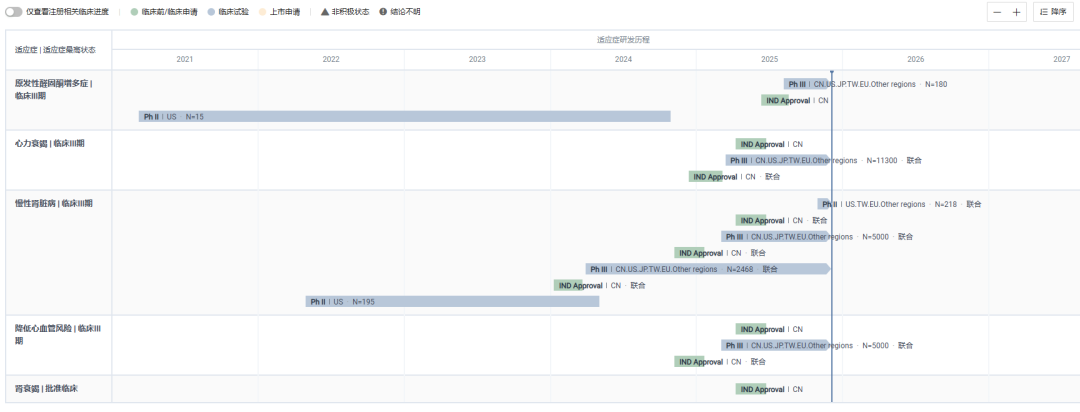
2023 年 2 月,阿斯利康 18 亿美元收购 CinCor Pharma,囊获了该产品。目前,除了已申报上市的高血压适应症以外,Baxdrostat 还在开展慢性肾脏病、心力衰竭等多个适应症的临床。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担, 关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部。