阿斯利康首创高血压新药国内报上市
来源:市场资讯
(来源:求实药社)
2 月 13 日,CDE 官网显示,阿斯利康 Baxdrostat 片上市申请获受理。根据临床试验进展,Insight 数据库推测适应症为高血压。
Baxdrostat 是一种全球首创、高选择性的醛固酮合成酶抑制剂(ASI),可抑制醛固酮合酶。该酶由 CYP11B2 基因编码,负责肾上腺中醛固酮的合成。临床研究表明,Baxdrostat 可在较大剂量范围内显著降低醛固酮水平且不影响皮质醇水平。
2023 年 2 月,阿斯利康 18 亿美元收购 CinCor,囊获了 Baxdrostat。2025 年 12 月,阿斯利康向 FDA 递交了该产品的上市申请,并获优先审评资格,作为其他抗高血压药物的辅助治疗,用于这些药物无法充分降低血压的情况,以治疗难治性高血压(未控制或治疗抵抗)成年患者。
阿斯利康向 FDA 递交的上市申请基于 III 期试验 BaxHTN 的数据。BaxHTN 是一项多中心、随机、双盲、安慰剂对照、平行分组的 III 期研究,旨在评估 Baxdrostat 在接受两种不同降压药物治疗但血压仍控制不佳的高血压患者,以及接受三种或以上降压药物(其中包括一种利尿剂)治疗但血压仍控制不佳的高血压患者中的安全性、耐受性及疗效。
在 2025 年欧洲心脏病学会(ESC)年会上,该研究在最新突破性研究专场进行汇报。结果显示,Baxdrostat 在 BaxHTN 试验中达到了主要和全部次要终点,在难控制高血压患者中实现了显著且持久的血压降低:
在治疗第 12 周时,Baxdrostat 2 mg 剂量组平均坐位收缩压较基线的绝对降幅为 15.7 mmHg,经安慰剂校正后的降幅为 9.8 mmHg。
1 mg 剂量组平均坐位收缩压的绝对降幅为 14.5 mmHg,经安慰剂校正后降幅为 8.7 mmHg。安慰剂组平均坐位收缩压下降5.8 mmHg。
上述结果在未控制和难治性高血压亚组中表现一致。
Baxdrostat 整体耐受性良好,未发现非预期的安全性事件。与安慰剂组(0.0%)相比,Baxdrostat 两个剂量组的明确诊断的高钾血症发生率较低。其安全性特征与作用机制一致,大多数不良事件为轻度。
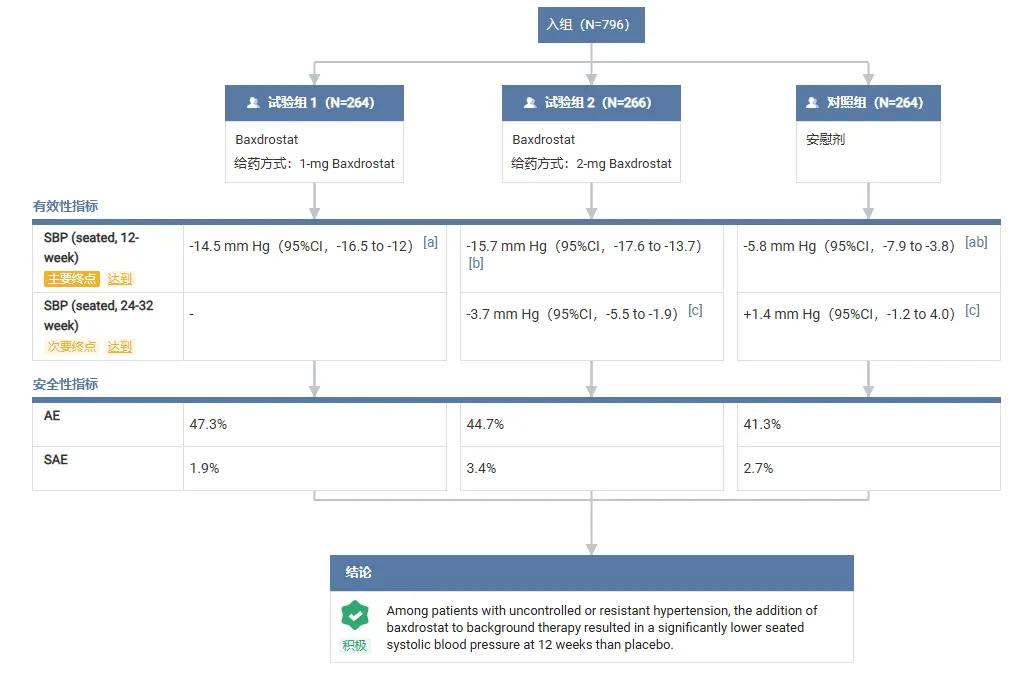
此外,Baxdrostat 也达到了所有确认性次要终点。其中,Baxdrostat 2 mg 剂量组展现出了持久的长期降压效果。2 mg 和 1 mg 剂量组均实现了更显著的舒张压降低,且患者收缩压<130 mmHg 的达标率较安慰剂组提升近三倍。
除了高血压外,阿斯利康还在开展 Baxdrostat 用于慢性肾脏病、心力衰竭等适应症的临床。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担, 关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部。