ADC药物“体内命运”如何精准捕捉?一站式LC-MS/MS策略解锁关键指标!
ADC即抗体毒素偶联物(Antibody–drug conjugate),它主要由3部分构成[1](图1):抗体(Antibody)、毒素小分子(Drug / Payload / Warhead)以及连接子(Linker)。ADC药物通过抗体靶向递送作用,将高效细胞毒性药物运送至肿瘤细胞,并实现细胞毒性药物的持续递送[2]。
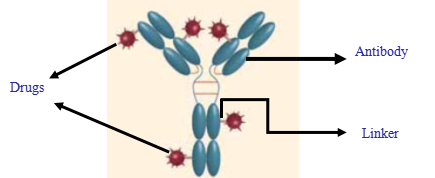
图1:ADC的结构[1]
在ADC药物的临床及临床前药代动力学以及毒理学研究中,药物浓度的生物分析至关重要。然而,ADC药物在生物体内呈现形式比其他药物复杂,其DAR值在体内发生着动态变化[3]。此外,其他生物转化过程(如加合物的形成、多肽片段、Linker-payload片段的生成)也增加了其在体内形式的复杂性[1](图2)。因此,ADC药物浓度的生物分析面临着许多挑战。
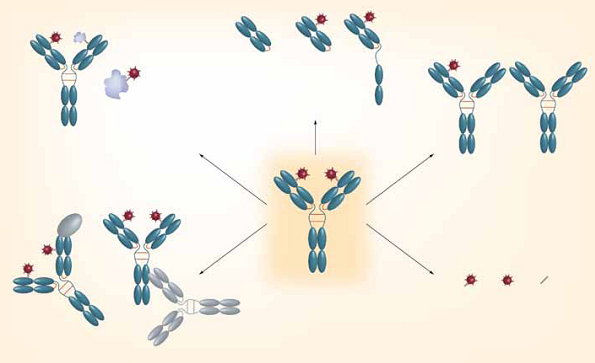
图2:ADC药物在体内的复杂性[1]
对于ADC药物的生物分析策略,主要通过分类检测来进行。主要分为以下几类[1]:1)游离的毒素小分子(free payload)以及一些代谢物(如payload-linker,payload-linker-amino acid等);2)抗体上偶联的毒素小分子(conjugated payload);3)结合毒素的抗体(至少连接有一个payload分子);4)未连接payload的裸抗体(DAR=0);5)总抗体(包括连接和未连接payload的所有抗体)。LC-MS/MS平台广泛应用于游离毒素和偶联毒素的定量,也逐渐用于总抗体和ADC的定量分析[2]。
1
生物样本中游离毒素小分子的定量分析
对ADC药物释放的游离毒素小分子分析时,样品提前方法通常包括蛋白沉淀(PPT)法、固相萃取(SPE)法和液液萃取(LLE)法。与传统小分子的方法开发相似(包括质谱参数的调谐,液相色谱条件优化,内标(IS)选择等),同时须考虑ADC存在对游离毒素小分子检测的影响。游离毒素分析主要关注以下三个问题。
灵敏度:因体内释放量极低,需通过萃取浓缩或高灵敏度质谱设备提升检测限;
特异性:ADC代谢物可能在色谱中干扰游离毒素,需通过优化提取方法或色谱条件消除干扰;
稳定性:包括样本采集、储存和处理过程中的稳定性。某些毒素(如含巯基化合物)需还原和衍生化处理;可裂解linker需控制pH或添加蛋白酶抑制剂以防止payload脱落[3]。
1
抗体上偶联毒素小分子的定量分析
偶联毒素小分子的定量分析通常会与免疫亲和纯化的方法相结合[3](图3)。对于具有可裂解连接子的ADC药物,可先从样品中通过免疫亲和纯化分离出偶联毒素小分子的ADC,再进行连接子裂解,然后对偶联毒素小分子的进行定量。对于不可裂解连接子偶联的毒素小分子进行定量分析方法,则需要通过全面酶解或位点特异性酶解后,以payload-linker-amino acid或payload-linker-peptide作为偶联的毒素小分子的替代目标分析物进行定量,该方法目前仅限于位点特异性定点偶联的ADC药物。
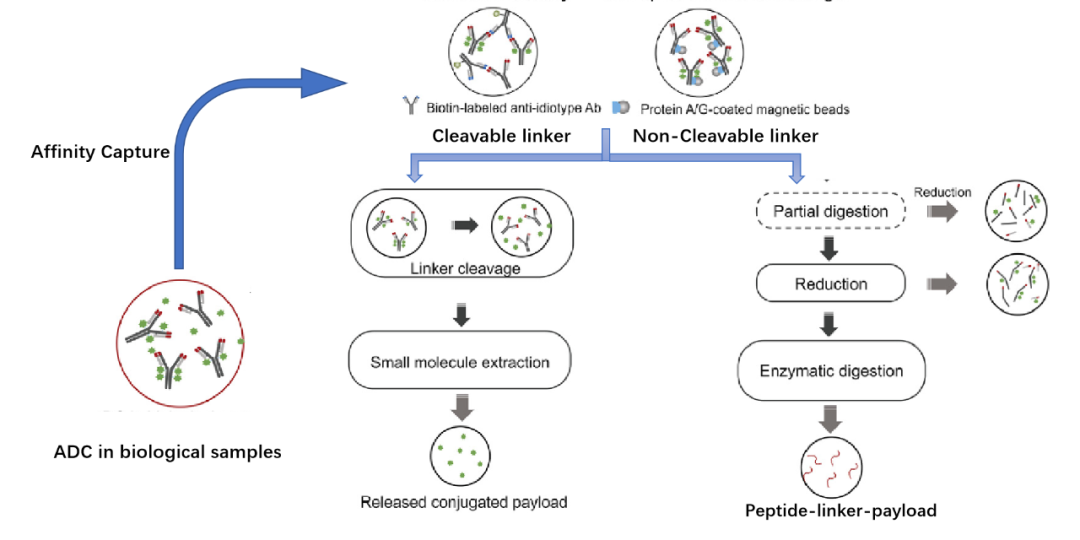
图3:ADC药物偶联毒素小分子的分析策略[3]
1
总抗和ADC部分的LC-MS/MS分析
采用LC-MS/MS方法进行总抗和ADC分析,液相色谱和质谱条件的优化以及内标的选择非常关键。此外,替代肽段(surrogate peptides)的选择、获取替代肽段的酶解过程,以及替代肽段的提取和纯化也非常重要[2]。
01
样品富集纯化
通常采用免疫亲和纯化法进行生物样本中总抗体和偶联抗体的预处理。总抗的分析方法可以采用protein A/G 或者独特性抗体等进行富集纯化,而在测定ADC时,必须使用抗毒素小分子特异性抗体来进行捕获。
02
替代肽段的选择
常选用抗体的特征肽段作为完整抗体蛋白的替代肽进行分析来获得更高的灵敏度。替代肽段的选择对于准确定量至关重要,利用许多生物信息学工具,可以筛选出特异性的替代肽,通过计算机模拟分析获得独特序列,将干扰降至最低。通常会选择多个替代肽,再通过条件优化,最终确认最高的选择性和灵敏度的替代肽。
03
酶解过程
酶解过程通常包括蛋白变性、还原双硫键、烷基化以及酶解反应。其中酶解反应可以选择不同的酶(包括胰蛋白酶、胃蛋白酶、赖氨酰内肽酶、胰凝乳蛋白酶、谷氨酸内肽酶和天冬氨酸内肽酶等[4]),最常用的是胰蛋白酶,它会切割精氨酸和赖氨酸残基的羧基端,从而生成特征的替代肽。酶解条件如温度、pH值和酶解时间等均需要进行优化[5](图4)。
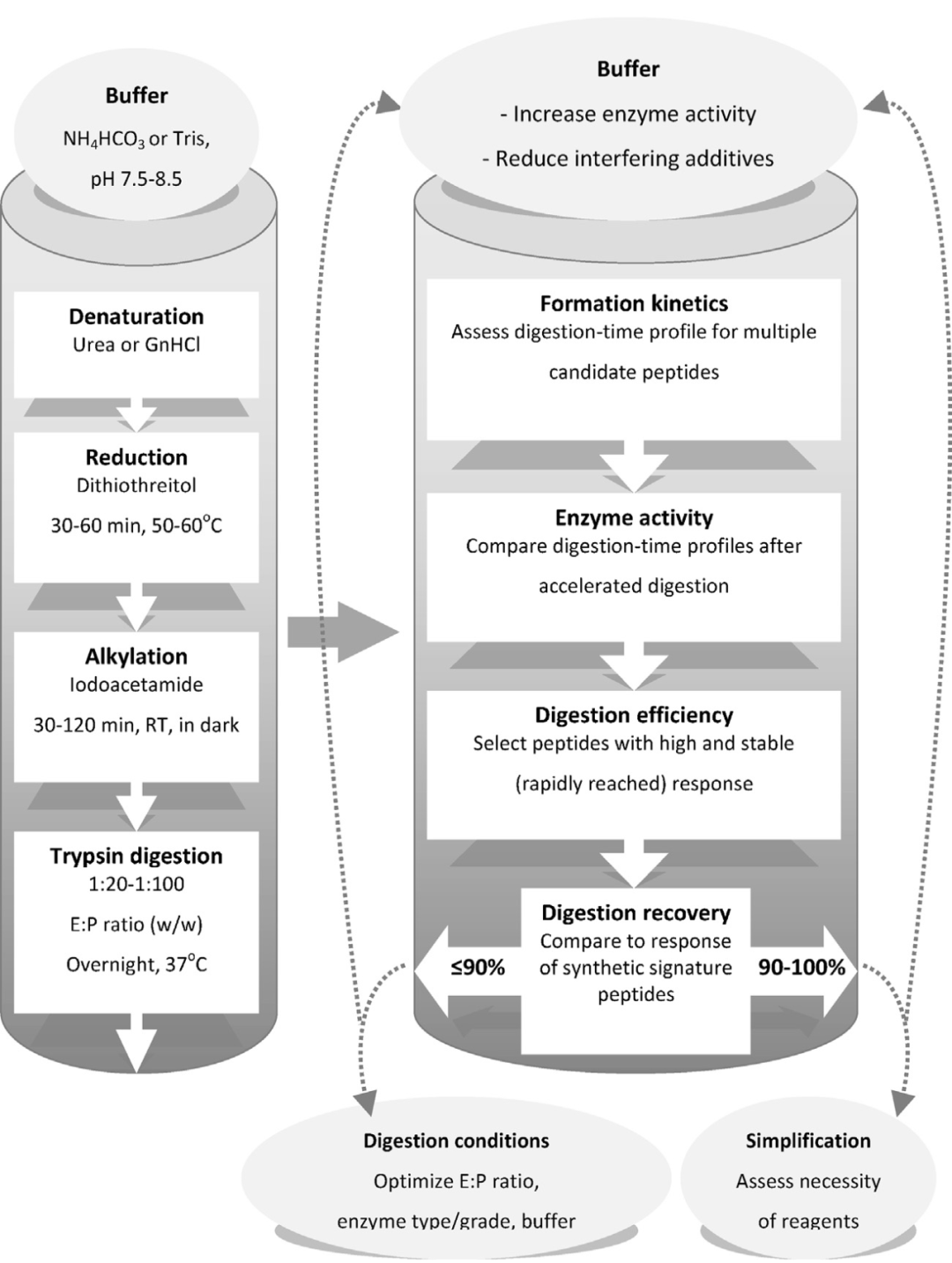
图4:酶解过程以及优化策略[5]
04
替代肽段的提取和纯化
可使用固相萃取法去除干扰物并浓缩替代肽。提取过程需要选择不同类型SPE板,并对洗脱条件进行优化,从而获得稳定的检测结果[2]。
05
LC-MS条件的优化
通过优化仪器参数,提高回收率和检测灵敏度。
色谱柱的选择取决于肽的性质,通常选用反相色谱柱(例如C8或C18)进行疏水性肽的分离,对于亲水性肽和磷酸化肽则选择极性大的色谱柱或HILIC柱。
流动相会影响色谱分离和质谱的离子化。由于多肽经常会带多电荷而影响灵敏度,通常需要对流动相的pH值和添加剂进行优化。
通过优化离子源参数(喷雾电压、雾化气、加热气、温度等)和化合物参数(去簇电压、碰撞能等)获得最优的灵敏度和特异性。
06
内标的选择
通常需要在样品分析过程中加入内标进行校正,内标必须在预处理、酶解和LC-MS分析等整个过程中保持稳定。内标通常分为稳定同位素标记(SIL)的ADC(SIL-ADCs)、与替代肽段对应的稳定同位素标记肽段(SIL-peptides)以及结构相似的模拟肽段(analog peptides)。用13C或15N稳定同位素标记的SIL-ADCs是最理想的内标,但合成成本高较难获取,SIL-peptides更常使用[2]。模拟肽段能够校正仪器分析误差,但对样品提取以及酶解过程校正效果较差。
1
实 例
益诺思开发了一种LBA与LC-MS/MS联用的ADC药物生物分析策略,通过链霉亲和素包被的磁珠与生物素化的捕获抗体进行反应,再将血浆中的ADC药物进行特异性免疫捕获(分析策略见图5)。该方法可同步获取总抗、偶联毒素小分子及DAR值,可应用于ADC药物的临床前及临床的PK/PD研究。
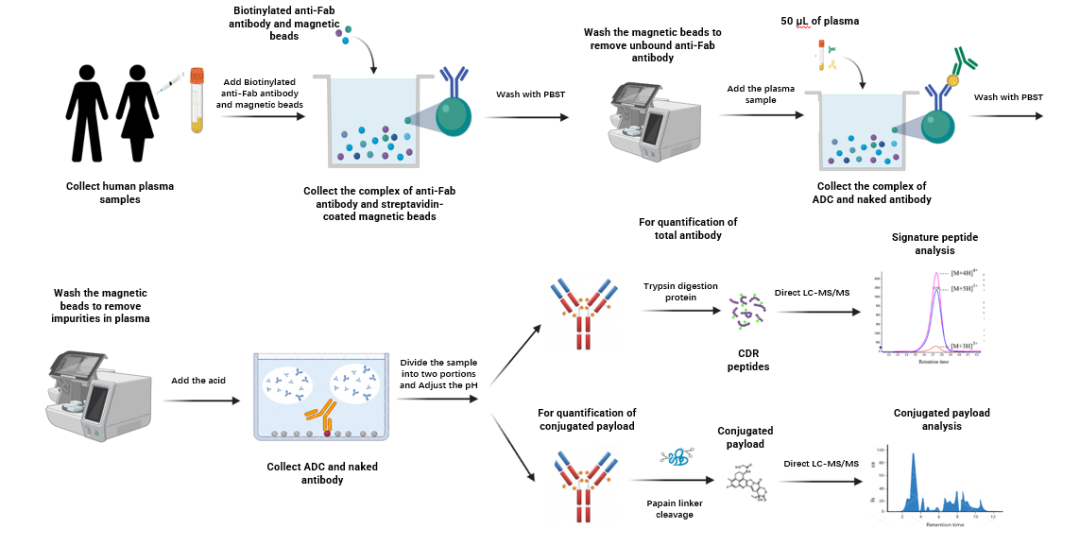
图5:同步测定总抗、偶联毒素小分子及DAR值方法策略图
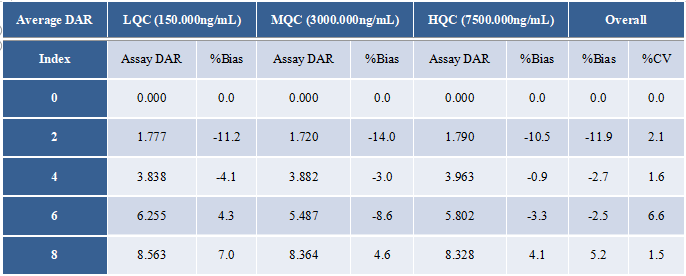
分析方法根据ICH M10指南要求完成了方法学验证,总抗(a)及偶联毒素小分子(b)的标准曲线见图6。准确度精密度结果见表1(总抗)和表2(偶联毒素小分子)。通过比较不同浓度水平的QC样本实测DAR值与理论DAR值的偏差(%Bias)及精密度(%CV),验证了分析方法对平均DAR值检测的准确性,结果见表3所示。
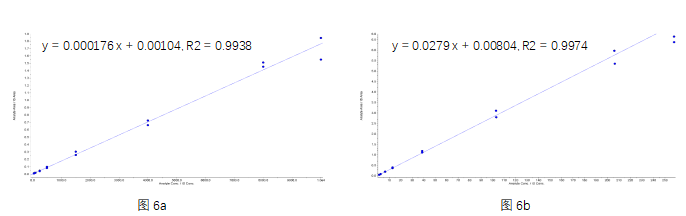
图6 总抗(a)和 偶联毒素小分子(b)的标准曲线
表1 血浆中总抗体检测的准确度与精密度结果
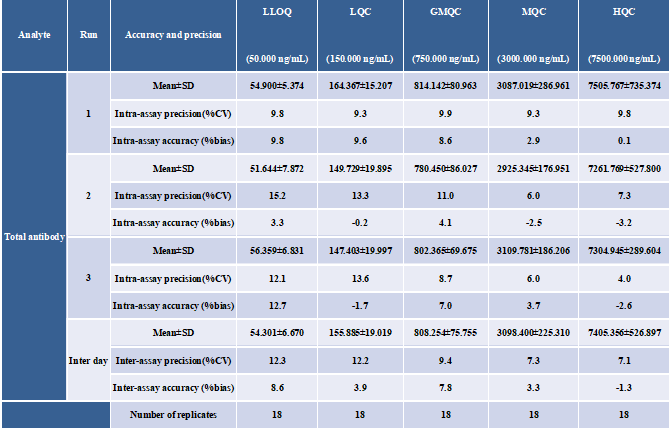
表2 血浆中偶联毒素小分子检测的准确度与精密度结果
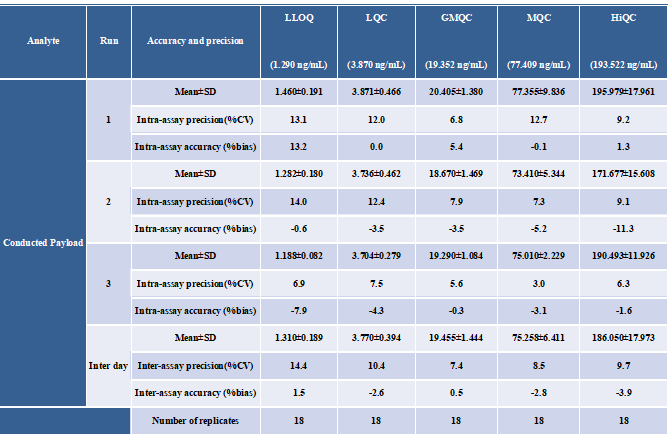
表3 不同DAR值ADC在血浆中的检测结果
1
选择益诺思
赋能ADC药物全生命周期开发一站式平台
益诺思已成为中国ADC领域不可或缺的研发引擎。我们的核心优势体现在:
规模化的项目经验:累计承接170+ 个ADC项目,涵盖所有热门靶点与技术路线,洞察行业趋势与研发难点。
全链条一体化服务:提供从早期靶点验证、药效药理、药代动力学(DMPK)到正式申报毒理研究的无缝衔接,极大提升研发效率。
经中美监管双重验证的质量体系:成功助力10+ 个项目获得中美双报IND批件,研究数据同时满足NMPA和FDA的严格要求,是客户出海的首选合作伙伴。
卓越的“出海”业绩:成功协助超过20% 的中国原创ADC药物实现海外授权或申报,是国际认可的中国CRO。(数据来自医药魔方,2021-2025H1)